Перейти
на главную страницу
Перейти
к Части 2
Оглавление
Предисловие
1. Спин-спиновые взаимодействия нуклонов
2. Банка
Никитина А. Н. или гидродинамическая модель образования
электрон-позитронной пары
3. Роль позитронной
прошивки нуклонов в строении элементарных частиц и стабилизации изотопов ядер
атомов
4. Строение атомных
ядер 120 химических элементов и их электронных оболочек
5. Таблица. Периодическая система протонной структуры ядер 120 химических
элементов по Никитину А.Н.
6. Легенда к
периодической системе протонной структуры ядер химических элементов
7. Таблица.
Завершённая периодическая система химических элементов Д.И.Менделеева по
Никитину А.Н.
8. Влияние строения атомного ядра на химические связи в молекулах
9. Сводная таблица.
Строение ядер инертных химических элементов по Никитину А.Н.
10. Таблица. Порядок заполнения –s, -p, -d, -f, протонами протонных оболочек 8 инертных ядер химических
элементов по Никитину А.Н.
11. Влияние строения атомного
ядра на виды радиоактивного распада
12. Квантование
геометрических размеров электронных оболочек 120 химических элементов
13. Таблица. Квантование геометрических размеров электронных оболочек
120 химических элементов
14. Кустарно - механический аналог поведения электрона в оболочке атома
водорода
15. Строение
электронной оболочки атома водорода по Никитину А. Н.
16. Лэмбовский сдвиг
17. Траектории
электронного вихря на прецессионных орбитах в атоме водорода
18. Таблица. Строение
электронной оболочки атома водорода по Никитину А. Н.
19. Легенда к таблице
20. Таблица – схема. Переходы и длина волны фотона первых 30 спектральных линий серии Лаймана по
Никитину А Н.
21. Таблица – схема.
Переходы и длина волны фотона первых 30
спектральных линий серии Бальмера по Никитину А Н.
22. Таблица - схема.
Переходы и длина волны фотона первых 11
спектральных линий серии Пашена по Никитину А. Н.
23. Таблица - схема.
Переходы и длина волны фотона первых 7
спектральных линий серии Брекета по Никитину А. Н.
24. Таблица - схема.
Переходы и длина волны фотона первых 6
спектральных линий серии Пфунда по Никитину А. Н.
25. Таблица - схема.
Переходы и длина волны фотона первых 5
спектральных линий серии Хемфри по Никитину А. Н.
26. Фотон - это
спиральная деформация эфира
27. Механизм излучения фотонов
28. Фотон геометрические размеры
29. Таблица.
Геометрические размеры фотонных импульсов в атоме водорода по Никитину
А. Н.
30.
Механизм возникновения элементарного
заряда
31. Механизм
возникновения электрического поля
32. Механизм
возникновения магнитного поля
33. Распад амера и образование пары электрон–позитрон из
фотонов
34. Взаимодействие электрона с
фотонами
35. Анализ таблицы амплитудных,
вращательных, прецессионных частот электрона и скоростей вращения на разных
орбитах в атоме водород
36.
Таблица. Амплитудные, вращательные, прецессионные частоты электрона и скорости
вращения на разных орбитах в атоме водорода по Никитину А. Н.
37. Уровни энергий
электрона в атоме водорода, частоты излучаемых фотонов νf
и длины волн λ f фотонов при различных энергетических переходах
38. Литература
Предисловие
Свою скромную задачу автор этой
работы видит в систематизации накопленных экспериментальных данных ядерной физики и спектроскопии для
построения на их основе новой теории
строения атомных ядер и их электронных оболочек.
Показать роль зарядовой симметрии протонов в стихийной самоорганизации
строения ядер атомов.
Как в электронной оболочке электроны, стремясь к зарядовой симметрии,
самоорганизуются, стягиваются магнитными силами в электронные жгуты – кластеры электронов.
Показать изоляционно-стабилизирующую роль
нейтронов в ядрах атомов.
Раскрыть роль позитронной прошивки нуклонов в стабилизации изотопов ядер атомов.
Объяснить, почему одни изотопы
стабильны, а другие существуют ничтожно малое время.
Раскрыть структуру элементарных частиц и принцип построения протонов,
нейтронов, мезонов, нейтрино из электрон-позитронных пар.
Визуально показать, как нейтрон превращается в протон и его обратное
превращение.
Объяснить и визуально показать, чем элементарные частицы отличаются от
античастиц.
Электрон-позитронные зеркальные вихревые пары рассматриваются как
элементарные кирпичики материи, из
которых построены все элементарные частицы.
Приводится опыт автора по гидродинамической
модели образования электрон-позитронной пары, объясняющей, почему
электрон-позитронные пары всегда рождаются одновременно.
Построена «таблица периодической системы протонной структуры ядер 120 химических
элементов» (аналог таблицы Менделеева), объясняющая природу переменной и предельно возможной валентности 120 химических
элементов.
Произведена визуализация структуры строения ядер изотопов 120
химических элементов в 2D и 3D формате с выборочной анимацией.
Автором построена «таблица квантования геометрических размеров электронных
оболочек 120 химических элементов», раскрывающих структуру строения и физический смысл квантования геометрических
размеров электронных оболочек.
Произведена визуализация структуры строения электронных оболочек в 2D и 3D
формате с выборочной анимацией.
Построена таблица «Порядок заполнения -s -p -d -f протонами
протонных оболочек 8 инертных ядер химических элементов».
Автором предложена «Завершённая периодическая система
химических элементов Д.И. Менделеева» с включением в периоды ещё не
открытых химических элементов. Таблица,
в новом формате, не имеет исключений из периодов двух групп элементов,
лантаноидов и актиноидов, и глубже раскрывает химическую периодичность
элементов.
Автор, опираясь на спектральный анализ
излучений электронной оболочки атома водорода, подробно объясняет, как образуются электронные орбиты атома
водорода.
Автор раскрывает механический смысл значения спина электронного вихря и как
механический спин электрона через собственный момент количества движения и
орбитальный момент количества движения жёстко связан с его прецессионными
орбитами.
Приводится «График изменения суммарного спина электрона от радиуса прецессионной
орбиты (s, p, d, f, g, h, I, k, l…) электронного вихря»
Приводится «Таблица строения электронной оболочки атома водорода». Где
приведены механические параметры орбиты
электронного вихря, собственный радиус электронного вихря, расстояние
до ядра атома и
радиус прецессионной
орбиты электрона.
Так же приведены значения собственных
скоростей и вращательных частот электрона и значения прецессионных скоростей
орбиты электрона.
На основании «Таблицы строения
электронной оболочки атома водорода»
построены структурные схемы энергетических переходов электрона с «верхних» орбит
на «нижние» орбиты. Приводится методика для расчёта длины волны и частоты излучаемого фотона.
Структурные схемы сведены в
таблицы с указанием длин фотонов, излучаемых при переходе электрона для серии Лаймана, серии Бальмера, серии
Пашена, серии Брекета, серии Пфунда, серии Хемфри.
На основе анализа таблицы амплитудных частот электрона в атоме водорода автор приходит к выводу, что частота Ридберга
3,29х1015гц - это частота амплитудных колебаний тора электрона, при
которых электрон покидает атом водорода. Электрон в свободном неподвижном
состоянии, в отсутствии магнитного или электрического поля, не имеет
направленной ориентации вращения.
Раскрыт механизм излучения фотона электронным вихрем с визуализацией
процесса излучения.
Приведены размеры и формы фотонов, образующихся при различных переходах
электронного вихря.
Вывод автора: фотон - это спиральная деформация эфира, механический импульс,
распространяющийся прямолинейно от одной частицы эфира к другой со скоростью
звука в эфире.
Рассмотрены возможные варианты взаимодействия электрона с фотонами.
Объяснён механизм возникновения элементарного заряда, механизм
возникновения электрического и магнитного поля и объяснена их механическая
сущность.
Новый взгляд на
строение атомов существенно повлияет на фундаментальные положения химии. Главную роль в образовании геометрической
(пространственной) структуры любых молекул, состоящих из атомов, принадлежит
валентным торцевым протонам, а не электронам, как это принято считать до сих
пор. Электроны ответственны только за силу этих связей, а не за их
направление. Ошибочной оказалась
существующая в физике и химии концепция так называемой гибридизации атомных
орбиталей.
Объяснена причина химической инертности
элементов экваториальным расположением всех электронных вихрей. А
химические связи между атомами обеспечиваются только полюсными электронными вихрями, жёстко связанными с торцевыми валентными протонами.
Рассмотрена роль спин-спиновых взаимодействий при
химических связях.
Объяснена причина радиоактивного распада ядер
атомов
Люди, страдающие топографическим
кретинизмом и блондинки должны отложить сей труд в сторону, нельзя издеваться над своей
природой. Ну а те, кто умеет читать географические карты и решать
геометрические задачи, могут сделать над собой усилие и читать далее, пока вас
не озарит! Боже мой, как в атоме всё
просто устроено, красиво, логично и главное, симметрично!
1. Спин-спиновые
взаимодействия
нуклонов
Мозг без картинки не усваивает информацию. Поэтому автор стремился максимально
насытить текст пояснительными рисунками и схемами.
Ядра
атомов состоят из протонов и нейтронов. Установлено, что протоны и нейтроны
имеют вихревое строение, на это
указывает наличие спина (механического момента вращения). А вращающиеся заряды электронов, протонов и
нейтронов создают магнитные поля. Было
установлено, что спин-спиновые взаимодействия на малых расстояниях (порядка 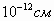 ) начинают играть существенную роль, определяют
величину и характер сил, действующих между поляризованными частицами.
) начинают играть существенную роль, определяют
величину и характер сил, действующих между поляризованными частицами.
|
|
|
|
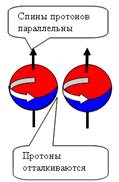
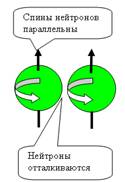
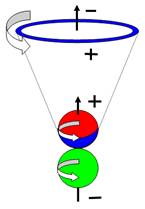
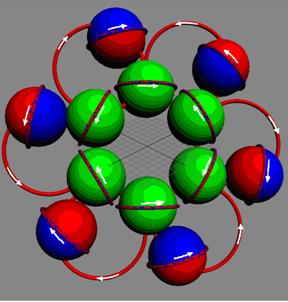
Рис. 1. Спин
протонов
|
Рис. 2. Спин
нейтронов
|
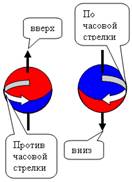
Спин - это одна из важнейших
характеристик элементарной частицы. Спин отображает вращение частицы вокруг
своей оси (см. рис. № 1-2-3). Спин направлен вверх (условно), если частица
вращается против часовой стрелки относительно наблюдателя. Если вращение по
часовой стрелке - спин направлен вниз. Представьте себе вращающуюся юлу. Как ее
перевернуть, не меняя вращения? Можно, конечно, это сделать, но придется
затратить большое количество энергии.
Специфика
спин-спинового взаимодействия состоит в самопроизвольном установлении и
поддержании единой ориентации систем ядерных магнитов. Этот вид взаимодействия
несводим не только к теплообмену, но и к электрическому или магнитному
взаимодействию, поскольку оно присуще и электрически нейтральным частицам, а
при ослаблении внешнего электрического или магнитного поля не вызывает
разупорядочивания ориентации электрических и магнитных диполей со свойственными
им временами релаксации.
|
|
|
Рис. 3.
Спин электрона в атоме
|
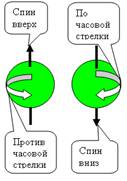
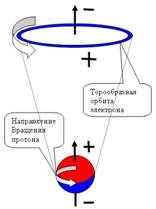
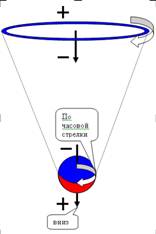
Электрон, двигаясь
по орбите, создает
электрический ток. Известно,
что при
движении ток в кольцевом проводнике вызывает магнитное поле.
Поэтому электрон, вращаясь по орбите, образует маленький прямой магнит,
расположенный вдоль оси вращения. Величина магнитного поля магнита,
образованного кольцевым током, характеризуется магнитным моментом.
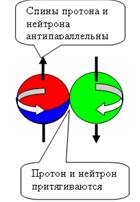
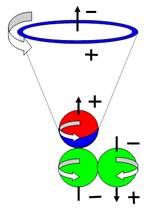
При взаимодействии протонов и нейтронов
возможен боковой и осевой контакт. Все другие углы контакта неустойчивы и
неизбежно переходят в два основных вида контакта.
Рассмотрим
следующие возможные комбинации контактов нуклонов, где Р + Р протон + протон, N + N нейтрон +
нейтрон, P + N протон + нейтрон.
Рис. 4. Боковой контакт нуклонов
После начала контакта нуклонов
определяющую роль сразу занимают вихревые силы,
более мощные, чем магнитные, и устанавливается антипараллельность спинов
при боковом контакте или их параллельность — при осевом.
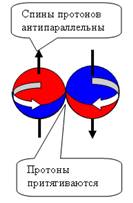
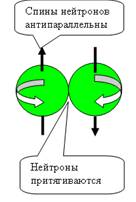
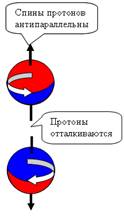
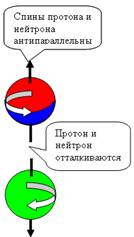
При боковом контакте нуклоны отталкиваются
при параллельных спинах и притягиваются при антипараллельных спинах (см. рис.
4).
Когда
мы видим вращательное движение, описать его вектором затруднительно, всё
зависит от точки зрения – то левое, то сзади правое. Поэтому физики условились,
вращаем штопор по направлению вращения часовой стрелки, и продольное движение
штопора - это вектор момента импульса вращения. Здесь все однозначно
получается. Вывод, физики 19–го века знали толк в вине.
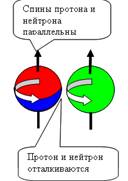
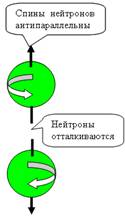
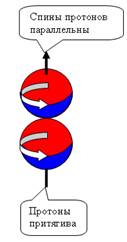
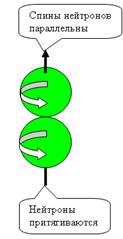
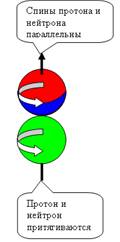
При осевом контакте, всё наоборот, Нуклоны
притягиваются при параллельных спинах и
отталкиваются при антипараллельных спинах (см. рис. 5).
Изотопическая инвариантность взаимодействия нуклонов согласуется с
данными о наличии черт геометрического
сходства структур протона и нейтрона и свидетельствует о равенстве их скоростей
вращения. Из-за малого радиуса действия Я.с. (1,5-2 ферми) притяжение оказывается достаточным для
возникновения только одного связанного состояния протона и нейтрона с
параллельными спинами (дейтрон) с энергией связи 2,2 МэВ.
Рис. 5. Осевой
контакт нуклонов
Два нейтрона (или два протона) вообще не образуют связанного состояния.
Почему?
Всё очень просто, взглянем на
изображения, как устроены протон и нейтрон. Но для этого сначала сделаем небольшое отступление.
2. Банка Никитина А. Н.
или гидродинамическая модель
образования
электрон-позитронной пары
Не стреляйте в пианиста,
он играет, как умеет.
Если некоторую область эфира
подвергнуть сильному воздействию электрического или магнитного поля, то в нём
возникнут деформации. Деформации - это перепады давления или плотности эфира.
Электрон и позитрон образуются только попарно и одновременно.
Снимите шляпы, господа, это
установленный научный факт!
Автор попытался смоделировать
этот процесс на известном с 1867 года генераторе дымовых колец шотландского
физика Питера Тейта. Вихревой генератор Тейта позволяет генерировать
тороидальные дымовые кольца.
Ряд исследователей проводили
опыты с этим генератором. Американский физик Роберт Вуд первым стал проводить
наглядные опыты с вихревыми дымовыми кольцами. Он опубликовал свою работу
"Вихревые кольца" в 1901 году в журнале Nature. С тех пор этот генератор
называют ящиком Вуда. Тесла работал с жидкостями в тридцатых годах двадцатого
века.
Опыт Тесла. «Потом я провёл исследование этого явления в воде. Взяв
металлическую банку, я вырезал с одной стороны небольшое отверстие, а с другой
стороны натянул тонкую кожу. Налив в банку немного чернил, я опустил её в
бассейн с водой. Когда я резко ударял пальцами по коже, из банки вылетали
чернильные кольца, которые пересекали весь бассейн и, столкнувшись с его
стенкой, разрушались, вызывая значительные колебания воды у стенки бассейна.
Вода в бассейне при этом оставалась совершенно спокойна».
Автор усовершенствовал генератор
Тейта, сделав его прозрачным. Это
усовершенствование позволяет видеть физические процессы, происходящие по обе
стороны отверстия генератора.
А посмотреть там есть на что!
При ударе по мембране генератора,
прозрачной трёхлитровой банке с отверстием в пластиковой крышке, образуются два
оппозитных вихря!
Один тороидальный вихрь вылетает
наружу из банки, это известный опыт Теслы.
Второй тороидальный вихрь
врывается внутрь банки!
Снимите шляпы, господа, это факт!
Мы имеем весьма близкую
физическую демонстрационную гидродинамическую
модель образования электрон-позитронной пары.
Подробности проведения опыта:
Берём трёхлитровую стеклянную
банку и отпилим донышко.
Затянем донышко резиновой
мембраной и зафиксируем её на банке изолентой.
Вырежем в пластиковой крышке
отверстие 18 мм.
Оклеим половину банки белой бумагой.
В тазик на 40 литров зальём воду.
Опустим банку- генератор в тазик
и зальём в неё воду, отверстие заткнём ваткой.
Окрасим воду в тазике чернилами.
Осторожно вынем ватку из
отверстия генератора.
Стукнем по мембране генератора.
Видно, как из генератора
вырвалась струя и ударилась в стенку тазика.
Одновременно в банку врывается
чернильный тор!!!
Процесс образования чернильных
торов продолжается, пока вибрирует мембрана.
Ни Питер Тейт, ни Роберт Вуд, ни
Никола Тесла не догадались делать коробки прозрачными! А то бы они увидели, что
у дымовых и чернильных
колец есть «отдача» -
наглядное подтверждение закона сохранения импульса.
Когда пушка стреляет, снаряд
летит в одну сторону, а пушка откатывается в противоположную сторону. В природе
ничто не проходит бесследно (это проявление закона сохранения импульса).
Когда рождается элементарная
частица, из-за «отдачи» в эфире рождается и оппозитная частица - её зеркальное
отражение. В тылу первого бублика, назовём его электрон, образуется второй
бублик, его зеркальное отражение, назовём его позитрон. Все их движения и
вращения как в зеркале противоположны. Движение бубликов будет происходить со
скоростью звука для данной среды (в эфире скорость звука 299792456,2 м/сек).
Единственные элементарные частицы, которые не удалось расщепить, это
электрон и позитрон. Все остальные псевдо «элементарные частицы» состоят из
набора электронов и позитронов.
3. Роль
позитронной прошивки нуклонов
в строении
элементарных частиц
и стабилизации
изотопов ядер
атомов
Итак, все элементарные частицы - это всего лишь набор или комбинация из
двух элементарных вихрей - электрона и позитрона, которые рождаются из эфира
только парно и одновременно.
|
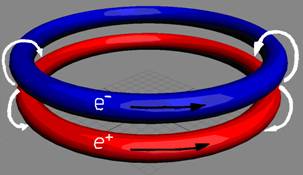
|

|
|
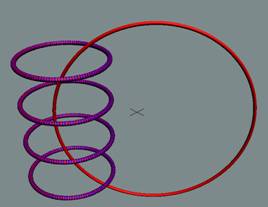
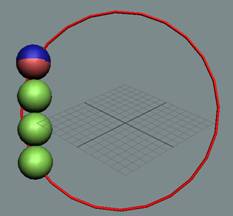
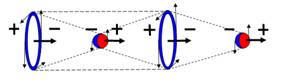
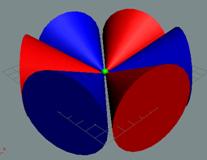
Электрон-позитронная
пара (амер) имеет круговое вращение в одну сторону, но их торы вращаются
навстречу друг другу. Такое вращение торов создаёт разряжение эфира между
ними, внешнее давление эфира прижимает их друг к другу. Такая сдвоенная
частица не имеет массы (трение об эфир), не имеет заряда. Так устроено
неуловимое нейтрино (амер). Во внешнем магнитном и электрическом поле
амер поляризуется.
|
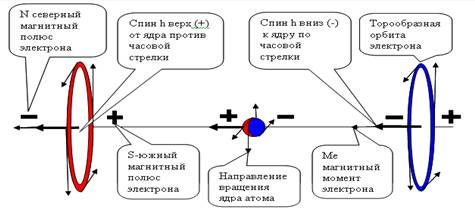
Тор электрона имеет
два вида вращения: круговое вращение обеспечивает заряд электрона,
направление вращения тора обеспечивает его магнитные свойства. Окружающие
электрон амеры закручиваются (поляризуются) и это воспринимается как заряд и
магнитное поле электрона. Так как амеры эфира, вращаясь, остаются на своих
местах, работы электрон не совершает и существует вечно. Магнитный момент
-1μ
|
|

|

|
|
Нейтрон, спин J =
1/2+, состоит из 918 или 919 электрон
- позитронных пар вихрей (амеров) и одного не спаренного электрона и
позитрона, насаженных на тор нуклона. Среднестатистический вес нейтрона
поэтому равен дробному числу масс покоя электрона 1838,68me. Позитрон и электрон
вращаются с разной скоростью. Фигура неустойчивая, быстро распадается на
протон, электрон и 1-2 амера. Период полураспада 10,82 минут.
|
Протон, спин J =
1/2+, состоит из 917 или 918 электрон
- позитронных пар вихрей (амеров) и
одного непарного позитрона, насаженного на тор нуклона. Поэтому
среднестатистический вес нейтрона равен дробному числу масс покоя электрона 1836,15me..
Фигура устойчивая. У протона положительный электрический заряд, равный заряду
электрона. Магнитный момент +2,79μ
|
|

|

|
|
Позитрон имеет сонаправленное с нуклоном круговое и
торовое вращение. Электрон тоже имеет сонаправленное с нуклоном круговое
вращение, но торовое вращение у него
встречное, это постоянное торможение электрона заканчивается разрывом тора
нуклона. Электрического заряда нейтрон не имеет, так как чётное число
электрон-позитронных пар взаимно компенсируют заряды. Как у всякой катушки с
током имеется магнитное поле. Магнитный момент --1,91μ
|
Протон состоит из нуклона и одного позитронного вихря,
насаженного на тор нуклона.
Позитронный вихрь вращается вокруг оси тора нуклона и защищает тор от
внешнего воздействия и внутренне стабилизирует нуклон от развала. Время
существования свободного протона практически не ограничено. Процесс распада протона на нейтрон и
электрон может происходить только в ядре.
|
|
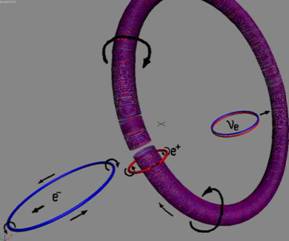
|

|
|
Позитронный вихрь
имеет то же направление вращения, что и тор нейтрона. Поэтому позитрон, при распаде нейтрона,
наворачивается на тор нуклонного вихря,
а электронный вихрь в 97% случаев навсегда покидает этот новый протон. Непрерывный характер спектра электронов (позитронов)
объясняется уносом излишка энергии и импульса 1-2 амером,
электрон-позитронной парой неуловимым «нейтрино»
|
Антипротон
отличается от протона заменой
позитрона е+ на электрон е-. Электронный вихрь
имеет встречное вращение, поэтому
такое событие встречается реже. При распаде протонов и антипротонов идёт
расщепление нуклонов с образованием 4-5 осколков весом примерно 270 me, называемых пи-мезонами. Их три вида π0, π+
и π−.
Если в осколке равное количество электронов и позитронов - это π0-мезон. Если в
осколке один лишний электрон - это π−-мезон, а если лишний позитрон - то это π+мезон
|
Все реакции синтеза связаны с
излучением фотонов и нейтрино (амеры или электрон–позитронные пары). И
наоборот, при реакциях распада именно такие же частицы «амеры» должны быть
поглощены. Происходит одновременное выделение
энергии и прирост массы нуклонов!
Каким образом происходит поглощение электрон-позитронных пар из
окружающего эфира нуклонами при реакциях распада?
Нам известно из опытов, что при сильном ударе с некоторой пороговой
энергией по структуре эфира в нём возникает электрон-позитронная пара.
При распаде ядер атомов
происходят разрывы позитронных связей нуклонов. При этом позитроны остаются с
протонами, а разорванное кольцо нейтрона начинает смыкаться с огромной силой
(см. рис.). Эфир, выдавленный торцами тора,
при ударе, закручиваются в два оппозитных электрон-позитронных вихря.
Удар от смыкающихся торцов
разорванного тора порождает электрон-позитронные пары. Они нанизаны на кольцо
тора нейтрона и им некуда деваться. В конечном итоге эти пары встраиваются в
кольцо тора нейтрона, пополняя его массу.
Сила удара от смыкания торцов тора настолько сильна, что по тору
прокатываются несколько раз встречные ударные волны. Ударные волны встречаются
на противоположной стороне кольца тора и рвут его там. При повторном смыкании
опять рождаются электрон-позитронные пары. И так продолжается несколько раз,
пока нейтрон не наберёт более-менее стабильную массу.
Кроме того, он восстанавливает
свой нормальный радиус. В свободном состоянии в малом радиусе нуклоны
существовать не могут. Малый радиус изгиба рвёт свободный нейтрон и свободный
протон.
|
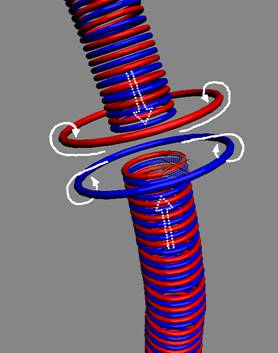
|

|
|
Разорванное кольцо нейтрона начинает смыкаться, вызывая
огромной силы удар. Эфир, выдавленный торцами тора, закручивается в два
оппозитных электрон – позитронных вихря. Сила удара настолько сильна, что по
тору несколько раз прокатываются встречные ударные волны.
|
Электрон-позитронные пары нанизаны на кольцо тора нейтрона
и им некуда деваться. В конечном итоге эти пары встраиваются в кольцо тора
нейтрона, пополняя его массу. Ударные волны встречаются на противоположной
стороне кольца тора и рвут его там. И всё повторяется.
|
4. Строение атомных
ядер
120 химических элементов
и их
электронных оболочек
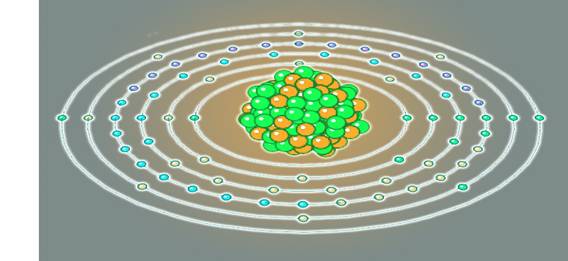
Так современные физики
представляют ядро атома и его электронную оболочку. В центре рисунка
бесструктурная кучка дерьма изображает ядро из протонов и нейтронов. Про
кулоновские силы отталкивания протонов они забыли, учёные блин! Электронная оболочка, где пусто,
где густо, почему? Как она связана с
ядром атома и почему электроны так сгрудились и не разлетаются под действием
кулоновских сил?
Природа любит
симметрию, и атомное ядро стремится, в основном
не в возбуждённом состоянии, к симметричной геометрической форме при
заданном количестве протонов.
Проследим, как
изменяется строение ядер химических элементов с ростом количества протонов. Все
результаты занесём в таблицу.
Обозначим в
таблице протон кружком, цвет которого соответствует спину, причём спин + вверх
обозначим красным цветом, а спин - вниз обозначим синим цветом. В пояснительных
рисунках протон обозначим шариком красно-синего цвета. Цвет обозначает
магнитную полярность юг - север. А нейтрон зелёным цветом, магнитную полярность
для простоты на нём указывать не будем. Магнитная полярность нейтрона в ядре
атома противоположна протонной полярности.
Из всех изотопов
химического элемента для поясняющей картинки будем брать самый распространённый
изотоп. А в таблицу заносить схематическое изображение протонной структуры ядра
химических элементов. Нейтроны для упрощения таблицы будем опускать.
Начнём с хорошо
изученных трёх изотопов водорода.
1 Водород существует в трёх изотопах, имеющих практическое
значение. Строение ядра трёх изотопов
водорода - протий, дейтерий и тритий отражено на рисунках ниже. Спины нейтрона
и протона в дейтроне (дейтерии) параллельны, в нем осуществляется их осевой
контакт. Это подтверждается результатами изучения дейтерия (дейтрона).
Спин водородных
ядер по своему характеру аналогичен спину электронов и также сопровождается
возникновением магнитных полей. Однако магнитные поля протонов примерно в 660
раз слабее полей, возникающих при спине электронов, причина этого объяснена
ранее. Направление магнитного поля протона противоположно магнитному полю
электрона.
Протон атома водорода
равновероятно может захватить свободный электрон двумя способами - северным
магнитным полюсом (спин J=
-1/2) и южным магнитным полюсом
(спин J=+1/2), см. рисунок. Существование двух аллотропных форм
атомарного водорода подтверждается спектральным анализом. Спектр атомарного
водорода имеет дублетную природу из-за наличия двух спинов 1/2+ и 1/2-.
|

|

|
|
Протон, он же
ядро атома водорода 1Н. Суммарный спин J = +-1/2
|
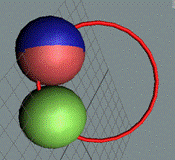
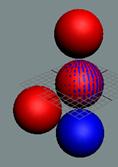
Дейтрон или дейтерий D состоит из двух нуклонов, прошитых
одним позитроном. Суммарный спин J = 1+
|
|
|
|
|
Дейтрон с учётом сферы непроницаемости
нуклонов удобнее изображать так
|
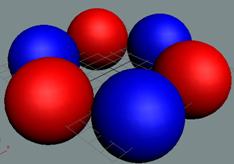
Вид трития с учётом сфер непроницаемости его нуклонов удобнее
изображать так
|
|
|
|
|
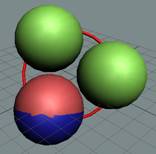
Тритий состоит из трёх нуклонов,
скрепленных одним позитроном. Суммарный спин J =
½+. Два нуклона вращаются в
одну сторону и имеют суммарный спин =1+. Третий нуклон вращается в
противоположную сторону и колеблется между крайними позициями, имеет спин J = ½-
|
Период полураспада трития 12,32
года. Но тритий не распадается, у него не полураспад, а превращение в
Гелий-3, той же массы. Суммарный спин гелия 3 J = ½+.
|
|
|
|
|
Нестабильный изотоп протона -
водорода 4Н1, суммарный спин J = 2-. Если у трития один нуклон не
может преодолеть силу двух нуклонов и занять третье место в стопке нуклонов,
то две стопки нуклонов притягиваются магнитными силами, смыкаются в одну
стопку и разваливают всю систему.
|
Вид изотопа водорода 4Н1 с учётом сфер непроницаемости. Время
жизни изотопа 4Н1 ничтожно мало - 1,39х10-22сек.
|
Атомарный
водород парамагнитен, он усиливает внешнее магнитное поле, выстраиваясь вдоль линий магнитного
поля. В магнитном поле спины электронов
атомарного водорода стремятся выстроиться по направлению поля, усиливая его,
хотя этот порядок и нарушается хаотическим тепловым движением. Поэтому
парамагнитная восприимчивость зависит от температуры: чем ниже температура, тем
выше значение. Все это происходит только
в магнитном поле, без него хаос и все микрочастицы сами по себе. Атомарный
водород может долгое время не образовывать молекулы в случае отсутствия в нем
примесей.
Отметим, что именно оно и
приводит к тому, что энергии электронов оказываются немного различающимися для
разных направлений спинов. Это и вызывает раздвоение спектральных линий: вместо
одной линии появляется пара линий-близнецов с одинаковыми яркостями.
Правда, такие
"двойняшки" рождаются обычно только в тех случаях, когда на внешней
электронной оболочке обитает один-единственный электрон. Если же число
электронов на этой оболочке растет, то могут рождаться и "тройни", и
"четверни", и даже более многочисленные "потомства" бывшей
спектральной линии.
|
Аллотропные формы водорода (протий)
|
Изотопы водорода
|
|
|
|
|
|
|

|

|
|
|

|
|
Водород спин J=1
/2+ валентность +1 -+1
|
Водород спин J =
1/2-
|
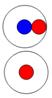
Суммарный спин дейтерия J = 1/2+1/2+=1+
|
Суммарный спин трития J = 1/2+1/2+3/2-- =1/2+
|
|
Рис. 6. Строение изотопов водорода.
|
Таким образом, когда образуется
молекула водорода, аллотропные атомы водорода могут соединиться тремя способами
см. рис. № 7-9, с суммарным спином:
J=1/2-
1/2+=0 ортоводород
J=1/2+1/2+=1+ параводород
J=1/2-
1/2- =1- параводород
Аллотропные формы молекулярного
водорода различны по строению и свойствам. Различие в строении параводорода и
ортоводорода отражено в рис. № 7-9. Дейтерий и тритий также имеют орто- и пара-
модификации: p-D2, o-D2, p-T2, o-T2.
Молекулы
ортоводорода и параводорода практически не взаимодействуют друг с другом и
ведут себя как различные модификации вещества с близкими свойствами.
В молекулах параводорода оба магнитных полюса имеют одинаковый знак, либо оба южных (++), либо оба северные(--). Такая молекула диамагнитна, во внешнем магнитном поле она выталкивается из него и стремится занять поперечное положение в плоскости, равноудалённой от магнитных полюсов. Химически параводород более активен, так как один наружный электрон всегда готов вступить в магнитную связь.
Ортоводород химически менее активен, чем параводород. У ортоводорода электроны спрятаны внутри молекулы водорода, а наружные протоны имеют магнитное поле в 660 раз слабее, чем электрон. Парамагнетизм молекулы ортоводорода обеспечивается диполем протонов. На одном конце молекулы ортоводорода северный магнитный полюс (-), на другом конце - южный магнитный полюс (+).
Молекулу удобно представлять как сравнительно жесткую конструкцию, построенную из шариков – атомов. При этом положения центров шариков, совпадающих с ядрами атомов, можно считать строго определёнными.
|
Аллотропные
формы молекулярного водорода
|
|
|
|
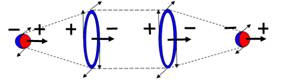
Рис.7. Параводород, активная
форма водорода, диамагнетик.
Суммарный спин J=1/2-1/2-=1-
|
|
|
|
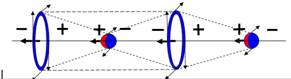
Рис.8.Параводород, активная форма
водорода, диамагнетик.
Суммарный спин J=1/2+1/2+=1+
|
|
|
|
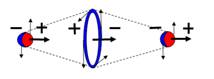
Рис.9. Ортоводород, не активная
форма водорода, он парамагнетик.
J = 1/2+1/2- =0
|
При
температурах выше 100 K отношение ортоводорода к параводороду равно 3:1 и не
изменяется с ростом температуры. Молекул ортоводорода больше в 3 раза, потому
что в магнитно-химической связи участвуют сразу два электрона. А магнитное поле
электрона в 660 раз сильнее магнитного поля протона. У параводорода в
магнитно-химической связи участвует только один электрон и один протон, такая связь слабее и легче
рвётся. Молекула H2 достаточно прочная и поэтому молекулярный
водород химически малоактивен. На рис. 10
представлены изображения ионов водорода.
|
|
|
Положительный ион молекулярного водорода Н2+, парамагнетик
|
|
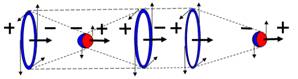
|
|
Отрицательный ион молекулярного водорода Н2-, диамагнетик
|
|
Рис.10. Ионы молекулярного водорода
|
Благодаря
различным формам водорода вода тоже существует в орто и паро состоянии. В
полосатом спектре вращения паров воды наблюдается чередование интенсивностей
линий вращения. Интенсивность спектральной линии зависит от вероятности
нахождения вещества в данной форме. Если свободные концы двух протонов водорода
молекулы воды имеют одинаковый магнитный полюс - то вода называется параводой,
а если разные магнитные полюса - то она называется ортоводой. Поскольку у воды
положительные протоны сбоку висят, она несимметричная в электрическом
отношении. Всегда против электрического поля разворачивается.
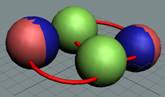
2
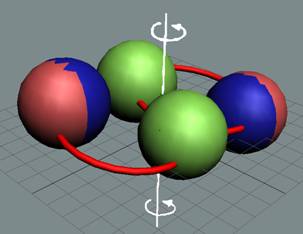
Гелий в основном состоянии не
имеет ни магнитного момента, ни электрического дипольного момента. Это возможно
только при структуре ядра, показанной на рисунке. Спиновые взаимодействия двух пар
протонно-нейтронных вихрей создают условия, при которых оба протона могут иметь
одноимённые свободные магнитные полюса. В результате одноимённые полюса будут иметь и электроны с
одинаковым спином, что создаёт условия для отсутствия магнитного момента у
атома гелия.
|
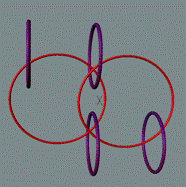
|

|
|
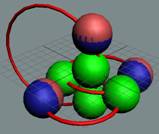
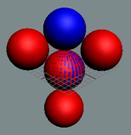
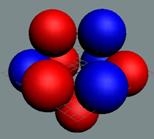
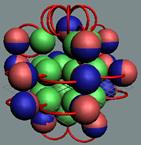
Изотоп гелия 4He2, вид сбоку. Двойная прошивка позитронными вихрями
двух центральных нуклонов объясняет особую прочность ядра атома гелия и альфа
частиц.
|
Изотоп гелия 4He2, вид сбоку. Суммарный спин J = 0.
|
|
|
|
|
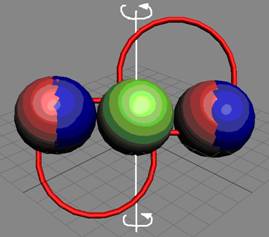
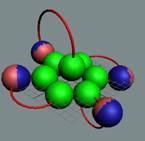
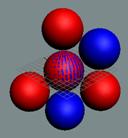
Вид изотопа гелия 4He2.. Хорошо
видна причина инертности гелия.
Позитроны не дают развернуться протонам из экваториального в полярное
валентное положение.
|
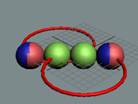
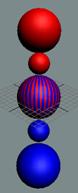
Вид изотопа гелия 3He2 с учётом сфер непроницаемости. Ось вращения
не позволяет гелию вступать в
химические реакции. Суммарный
спин J = +1/2
|
Химическая инертность гелия обеспечивается
осью вращения атома. Атом гелия как бумеранг вращается в плоскости расположения
нуклонов. В результате электроны, жёстко сцепленные магнитными силами с
протонами, вращаются с огромной скоростью в плоскости вращения атома гелия, не
имеют возможности вступать в магнитные взаимодействия с электронами других
химических элементов.
Совершенно
уникальным исключением из этого правила является димер гелия,
молекула He2. Это неожиданно большая молекула — среднее
расстояние между атомами гелия намного больше их размеров. Димер гелия обладает
исключительно маленькой энергией связи, около десятой доли микроэлектронвольта!
Такая молекула разрушается не только при комнатной температуре, но и при
температурах вплоть до милликельвинов. Можно с полным правом сказать, что
это самая хрупкая молекула, известная на сегодняшний день.
При
такой низкой температуре экваториальное вращение атомов гелия настолько
замедляется, что становится возможной химическая связь.
Спектр нейтрального гелия делится на две отдельные
категории, соответствующие термам, которые не были взаимно связаны. Эти
две системы совершенно независимых линий получили название спектров ортогелия и
парагелия. Два электрона атома гелия могут иметь спины параллельные (ортогелий
гелий2) или антипараллельные (парагелий гелий1). Обе формы сосуществуют в
обычном гелии, в соотношении примерно 1 к 3, причем переход между ними
относится к «запрещенным».
При наличии двух
электронов, как это происходит в гелии, суммарный спин обоих электронов равен 0
либо 1. Соответственно, мультиплетность будет равна 1 для парагелия с
одиночными линиями в спектре и равна 3 для ортогелия с триплетными линиями в
спектре.
При охлаждении
гелия до 2,17 °К под давлением собственного насыщенного пара (37,8 мм рт. ст.) происходит
фазовый переход второго рода и жидкий гелий
из обычной своей формы (т. н. гелнй I) переходит в другую модификацию (т. н.
гелий II).
Если
гелий I по свойствам подобен прочим сжиженным газам, то свойства гелия II в
некоторых отношениях совершенно необычны. Например, он обладает сверх
текучестью, т. е. обнаруживает практически полное отсутствие вязкости, а
теплопроводность его несравненно выше, чем даже у серебра!
Энергия основного состояния ортогелия выше, чем энергия основного состояния парагелия, однако переход ортогелия в парагелий невозможен, так как должен сопровождаться переворотом спина, поэтому состояния ортогелия устойчивы. Перевести ортогелий в парагелий возможно, например, путем бомбардировки атома пучком электронов, тогда, возможно, один из электронов в атоме заместится на электрон с противоположным спином из числа падающих на атом электронов, и состояние ортогелия превратится в возбужденное состояние парагелия.
|
|
|
|
|
|
|
|
|
|
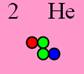
Гелий 2 ортогелий J = 0+ валентность 0
|
Гелий 1 пара гелий J
= 0+.диамагнетик валентность 0
|
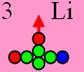
Литий7 J = 3/2- валентность +1
|
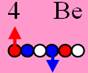
Бериллий11 J =
1/2- валентность +2
|
|

|

|
|
|
|
Электронная оболочка атома гелия
валентность 0
|
Электронная оболочка атома гелия (условное обозначение) валентность 0
|
Электронная оболочка атома лития из трёх электронных облаков
|
Электронная оболочка атома бериллия валентность +2 из четырёх облаков
|
3
Литий. Природный литий состоит из двух изотопов с массовыми числами
6(7,42%) и 7(97,58%). По способности захватывать тепловые нейтроны (поперечное
сечение захвата) ядра этих изотопов отличаются очень сильно.
Тяжелый
изотоп 7Li имеет сечение захвата 0,033 барн, он практически
прозрачен для нейтронов.
Зато
6L активно поглощает тепловые нейтроны, его сечение захвата 912
барн.
Почему?
Посмотрим
на изображение лёгкого изотопа 6L.
Видно, что он состоит из двух частей. Нижняя часть - это ядро атома гелия 4.
Двойная прошивка нуклонов позитронами придают гелию 4 большую прочность.
Верхняя
часть - это ядро атома водорода 2 дейтерий, в котором позитрон имеет весьма
большую круговую подвижность. Налетающий тепловой нейтрон легко насаживается на
кольцо позитрона, образуя ядро атома трития. Круговое вращение позитрона
обеспечивает большое сечение захвата теплового нейтрона.
Тяжелый
изотоп 7Li имеет другое строение. Посмотрим на изображение изотопа 7Li,
видно, что позитрон в этой конструкции жёстко зафиксирован и не имеет
возможности вращаться. Поэтому сечение захвата тепловых нейтронов очень
ограничено
|
|
|
|
|
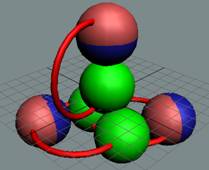
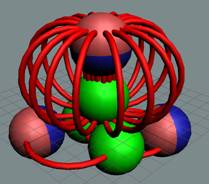
Лёгкий изотоп 6L состоит из двух частей. Нижняя
часть, это ядро атома гелия 4. Верхняя часть из дейтерия.
|
У изотопа 6L позитрон
имеет весьма большую круговую подвижность.
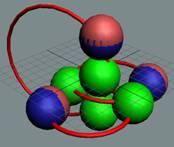
|
Изотоп 7Li, позитрон
жёстко зафиксирован и не имеет возможности вращаться
|
Почему энергия ионизации одного электрона
атома лития меньше энергии ионизации электрона атома водорода? Потому
что два других электрона атома лития, взаимодействуя со своими протонами в ядре,
удаляют от ядра первый электрон. В
результате его второй энергетический уровень оказывается нерабочим.
Литий
парамагнитен, соединения его диамагнитны.
Из
щелочных металлов Li обладает наименьшим атомным радиусом (0,157 нм), а
следовательно, наибольшим ионизационным потенциалом, равным 5,39
эВ, поэтому литий химически менее активен по сравнению с другими щелочными
металлами. Ионный радиус Li+ равен 0,068 нм. Благодаря малому атомному радиусу
литий обладает наиболее прочной кристаллической решеткой по сравнению с
остальными щелочными металлами. Это обусловливает наиболее высокие температуры
плавления и кипения лития по сравнению с его аналогами.
Природный
литий (эффективное поперечное сечение захвата
тепловых нейтронов 67±2-10-28 м2)
состоит из двух стабильных изотопов 6 Li (7,42 %) и 7 Li
(92,58 %). Тяжелый изотоп 7 Li прозрачен для нейтронов, имеет
эффективное поперечное сечение захвата тепловых нейтронов 0,033-Ю-28 м2;
e Li6 активно поглощает тепловые нейтроны; эффективное поперечное
сечение захвата тепловых нейтронов 912-Ю-28 м2.
|

|
|
|
Электронная оболочка атома лития (условное обозначение Не) валентность+1
|
Электронная оболочка атома бериллия
валентность +2
|
Для
самостоятельного проверочного расчёта спина ядер химических элементов приводим
таблицу расчёта спина нуклона в зависимости от расстояния до оси измерения (ось
вращения ядра атома), см. рисунок ниже.
|

|
|
|
Таблица расчёта спина нуклона в
зависимости от расстояния до оси измерения
|
|
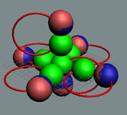
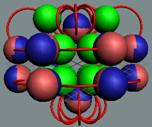
Изотоп бериллия 9В,
самый распространённый изотоп. Позитронная прошивка связывает все его
нуклоны
|
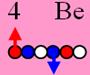
4 Бериллий. Шесть нейтронов образуют
шестигранный остов, на который примагничиваются четыре протонов. Уже у изотопа
бериллия 10Ве (спин / чётность J = 0+), мы впервые
наблюдаем образование этого шестинейтронного остова, см. рисунок. Это
симметричный атом. Каждый из его четырёх электронов взаимодействует со своим
протоном ядра. Симметричность ядра порождает симметричность атома и
симметричность электростатических сил, действующих между его электронами. В
результате, когда они все находятся в атоме, то энергии связи у них с протонами
ядра одинаковые на одноимённых энергетических уровнях. Но
протонное кольцо ещё не замкнутое, для его завершения не хватает двух
протонов. Ядро атома бериллия одновременно можно рассматривать и как кластер,
состоящий из двух альфа частиц. Центрально осевой нейтрон придаёт изотопу
берилий11 спин J = 1/2–.
Два
позитрона, лежащие в экваториальной плоскости вращения ядра изотопа, скрепляют
по три нуклона. Такая прошивка ограничивает их подвижность, и протон в такой
связке не может развернуться в валентное положение. Два других позитрона
скрепляют по одной паре нуклонов,
нейтрон и протон. Эта связка не ограничивает подвижность валентного
протона. Позитронная прошивка не позволяет двум протонам развернуться в
валентное положение. Поэтому в химических связях участвует только два протона и
их электроны.
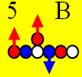
5 Бор. Атомное ядро следующего
химического элемента изотопа бора 11В имеет такой вид, см. рисунок
ниже. Ядро изотопа бора 11В не симметрично, что подтверждает его
спин ( J
= 3/2-). Пяти электронам невозможно симметрично разместиться на орбите,
предназначенной только для шести электронов. Пятый электрон выталкивается
электростатическими силами четырёх электронов в торец ядра. Протон, жёстко,
намертво сцепленный со своим электроном, следует за ним.
|
|
|
|
|
|
|
|
|

|
|
|
|
Электронная оболочка атома бериллия валентность +2
|
Электронная оболочка атома бора валентность +3
|
Электронная оболочка графита валентность 0
|
|
Берилий10 J = 0+ валентность +2
|
Бор11 J = 3/2+ валентность +3
|
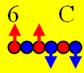
Углерод12 J = 0+ валентность +4
|
Алмаз
|
6 Углерод. Нейтроны экранируют протоны от
кулоновских сил отталкивания и позволяют протонам собираться в шестилучевые
«снежинки». Первая такая «снежинка» появляется у ядра атома углерода, см. рисунок выше. У изотопов углерода 12С
( J =0+) образуется
полностью замкнутое протонное кольцо, но оно ещё нестабильное. Одновременно
ядро атома углерода можно рассматривать как кластер, состоящий из трёх альфа
частиц.
Шесть
электронов атома углерода могут симметрично и равномерно разместить свои заряды
тремя способами. Первый способ - все шесть электронов равномерно, на одинаковом
расстоянии от ядра распределяются по окружности в одной плоскости. Углерод в
таком виде мы называем графитом. Графит химически инертен и не растворяется ни
в каких растворителях, кроме расплавленных металлов! Температура
воспламенения в струе кислорода составляет для явнокристаллических графитов
700-730°С! Температура плавления графита — 3845-3890°С! Известны смазочные свойства многослойного
графита со слабым взаимодействием между
слоями отдельных углеродных (графеновых) листов. Электрическая
проводимость монокристаллов
графита в направлении, параллельном базисной плоскости (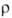 =0,385*10-6 Ом*м),
близка к металлической, в перпендикулярном в сотни раз меньше, чем у металлов
(52,0*10-6 Ом*м). Высокая анизотропия
свойств монокристаллов
графита обусловлена строением его кристаллической решетки. В направлении
базисных плоскостей тепловое расширение графита до 427 °С отрицательно (т.е. графит сжимается).
=0,385*10-6 Ом*м),
близка к металлической, в перпендикулярном в сотни раз меньше, чем у металлов
(52,0*10-6 Ом*м). Высокая анизотропия
свойств монокристаллов
графита обусловлена строением его кристаллической решетки. В направлении
базисных плоскостей тепловое расширение графита до 427 °С отрицательно (т.е. графит сжимается).
|
|
|
|
Ориентация спинов электронов и нуклонов ядра атома графита
|
Электронная оболочка инертного углерода
|
Электронная оболочка аморфного углерода, валентность +4
|
Спины
(оси вращения) всех электронов у графита перпендикулярны оси вращения ядра
атома. Такое нереакционноспособное состояние электронов называется триплетным.
Графит
с идеальной структурой диамагнетик.
Диамагнетики под действием внешнего магнитного поля, действующего на движущиеся электроны атома
углерода, прибавляют скорость вращения, в результате возникает дополнительный
магнитный момент, действующий против внешнего магнитного поля. Магнитное поле выталкивает графит, и
он устанавливаются перпендикулярно ему. Магнитная
восприимчивость велика в направлении, перпендикулярном базисным плоскостям (
-22*10-3), и незначительна в параллельном направлении ( -0,5*10-3).
Графит
с дефектами структуры способен самонамагничиваться.
Второй
способ равномерного и симметричного размещения электронов в пространстве вокруг
ядра углерода возможен, когда два электрона выталкиваются электростатическими
силами с окружной орбиты и занимают торцевые полярные положения. Полярное
торцевое положение электронов делает их валентными. Два его валентных
электрона примагничиваются к торцевым
валентным электронам других атомов, им не надо гасить инерцию вращения ядра
атома углерода. Такое валентное состояние электронов в атоме углерода называют синглетным. После того как два
валентных электрона атома углерода вступили в магнитную связь с двумя
инородными атомами, к ним могут подтянуться ещё два электрона. Таким образом,
углерод становится четырёхвалентным. Это
объясняет валентность углерода +2 и +4.
Такой
углерод мы называем аморфным углеродом. Уголь, кокс, сажа - являются аморфными
модификациями углерода, химически более активными, чем графит. Сажа пирофорна.
Два
неспаренных по спинам протона периодически выскакивают на нейтронное кольцо,
занимая валентное торцевое положение.
На круговой электронной оболочке в атоме углерода находятся 4 электрона
со спином J =1/2+ и 2
электрона со спином J =1/2-. И формы нахождения в природе -
алмаз, графит, уголь.
Третий
способ равномерного и симметричного размещения электронов в пространстве вокруг
ядра углерода реализован у алмаза. В
форме алмаза углерод имеет другое не кольцевое симметричное геометрическое
строение ядра.
В монокристалле
у каждой молекулы есть свое место, а весь монокристалл – повторение одной
элементарной ячейки. Алмаз - самое
твердое вещество, найденное в природе.

|
|
|
Кристалл алмаза
|
Строения ядра атома алмаза с
позитронной прошивкой
|

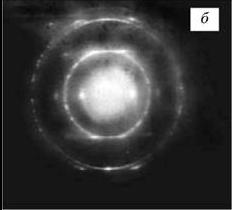
Типичные микроэлектронограммы углеродного волокна, полученного при 3000
"С:
а — точечная электронограмма
микрообъема волокна, характерная для крупнокристаллической структуры; б —
электронограмма более дисперсной части углеродной нити.
На электрограмме хорошо видны два энергетических уровня с
шестью узлами максимальной плотности электронов. Чем более упорядоченнее кристаллическая
структура графита, тем чётче картинка. Центральное пятно - это засветка от
электронного пучка, которым облучают нагретый образец.
Молекулы
образуются путем соединения разноименных магнитных полюсов их валентных
электронов, которые связаны с протонами ядер также магнитными полюсами.
|

|
|
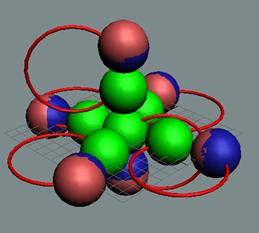
Позитронная прошивка всех
нуклонов изотопа углерода С12
|
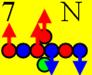
7 Азот.
Строение ядра изотопа азота 14N ( J = 1+). Ядро атома азота имеет несколько
способов позитронной прошивки.
Два
позитрона, лежащие в экваториальной плоскости, связывают по три нуклона сразу.
При таком способе позитронной прошивки протоны не имеют возможности
развернуться в валентное полярное положение. Поэтому два протона с их
электронами всегда химически инертны.
Два
центральных нуклона, протон и нейтрон, прошиты одним позитроном. Протон и его
электрон в таком валентном полярном положении обеспечивает постоянную
валентность атома азота +1, см.
рисунок ниже.
Оставшиеся
четыре протона могут переходить из экваториального инертного положения в
полярное валентное положение. Позитронная прошивка позволяет двум валентным
протонам, имеющим вращение, противоположное вращению центрального протона, разворачиваться
в свою сторону. Такая комбинация обеспечивает атому азота валентность +3, см. рисунок ниже.
Два
других протона у атома азота имеют такое же вращение, как и центральный протон,
поэтому они могут разворачиваться только в противоположную от протона сторону.
Один первый протон разворачивается легко, и его электрон занимает центральное
положение на противоположном торце атома азота, обеспечивает атому азота
валентность +4.
Пятый
протон и его электрон в валентное полярное положение разворачивается с большим
трудом. Ему мешает однонаправленное вращение четвёртого протона и электрона.
Для реализации валентности +5 атому азота нужна дополнительная энергетическая
накачка, см. рисунок.
|
|
|
|
|
|
Ядро изотопа азота 14 в трёхвалентном
состоянии
|
Молекула азота, атомы азота в
трёхвалентном состоянии
|
Ядро изотопа азота 14 в
пятивалентном состоянии
|
Пять валентных электронов у атома
азота
|
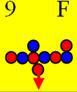
8 Кислород. Ядро изотопа 16О(99,759%)
кислорода имеет 8 протонов, это второе после гелия магическое число в ядерной
физике. У кислорода впервые образует полностью замкнутое, полностью стабильное,
химически инертное углеродное кольцо, см. рисунок ниже. В углеродном кольце шесть позитронов сшивают
по три нуклона, по одному протону и по два нейтрона.
Каждый
нейтрон прошит позитроном дважды, это объясняет особую прочность связей
нейтронов в ядре атома кислорода.
Шесть
позитронных колец лежат в экваториальной плоскости и у протонов нет никакой возможности
развернуться в валентное полярное положение, см. рисунок ниже.
Валентными
являются только два торцевых полярных протона, расположенных точно по центру
симметрии ядра атома (спинJ=0+),
отсюда такая химическая активность кислорода. Два его валентных электрона легко
примагничиваются к торцевым валентным электронам других атомов, ведь им не надо
гасить инерцию вращения ядра атома.
Каждый
валентный протон прошит общим позитроном с одним нейтроном. Пришитый нейтрон
имеет возможность вращаться вокруг протона, подавляя отдельные вылазки
кольцевых протонов.
Известно, например, что у всех лёгких элементов от лития до
кислорода (атомный номер 8) имеется только два стабильных изотопа, из которых
один (лёгкий) соответствует
равенству Ν=Ζ, а в другом (более тяжёлом) число
нейтронов на единицу больше числа протонов. У кислорода такие изотопы также
имеются, но, кроме того, у кислорода имеется и третий изотоп с массовым числом
18.
Начиная с кислорода, закономерность в числе изотопов другая -
элементы с нечётным Ζ имеют только один стабильный изотоп (F, Na,
ΑΙ, Ρ), а элементы с чётным Ζ обладают тремя изотопами (О,
Ne, Mg, S).
Происшедшее при Z=8
изменение в характере изотопного состава элементов является следствием того,
что нуклоны заполнили первую из ядерных слоёв-оболочек (первое углеродное
кольцо).
В литосфере
содержится более 47% кислорода по весу, в гидросфере — 85,89% и в атмосфере —
23,01%. И это не случайно. Природа отдаёт предпочтение симметричным ядрам
химических элементов с полностью заполненными ядерными слоями-оболочками.
Существует глубокий минимум
распространённости в области лития, бериллия и бора и максимум
распространенности углерода и кислорода!
Магические числа 2, 8, 14, 20, 28, 50, 82 и 126. Почему именно эти числа являются магическими в ядерной физике?
Магические
числа в ядерной физике являются следствием геометрически правильного строения
ядер атомов при заполнении очередного N-го
углеродного слоя- оболочки.
Ни азот с числом протонов 7, ни фтор с числом
протонов 9 не имеют такого красивого правильного абсолютно симметричного
строения, как ядро атома кислорода с числом протонов 8.
Молекула
кислорода О2. Химическая связь между атомами в молекуле прочная,
при образовании 1 моль O2 из атомов выделяется 493,57 кДж. Ранее
связь между атомами в молекуле O2 передавали схемой О=О. Однако
такая схема была бы правильной, если бы образование молекулы O2
происходило путем образования двух электронных пар из первоначально неспаренных
электронов, которых по два у каждого атома О. Но в действительности все
сложнее, см. рисунок.

|
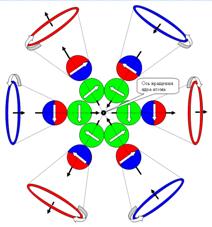
|
|
Положение двухвалентных
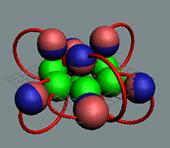
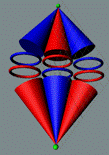
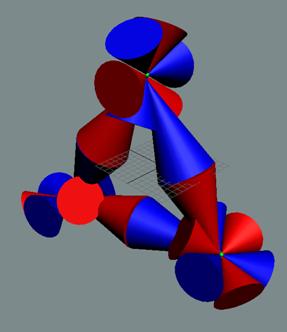
электронов в молекуле кислорода О2. и два не спаренных
валентных электрона. Плоскости
основания конусов - это плоскости вращения тора электрона. Цвет тора - это направление
вращение тора электрона для наблюдателя с поверхности ядра атома
|
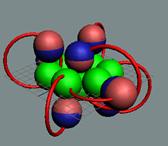
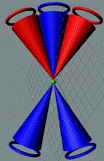
Положение шестивалентных
электронов в молекуле озона О3. Фигура неустойчивая, находятся под
сильным напряжением
|
Оказалось,
что в молекуле О2 содержится два неспаренных электрона. Этот вывод
следует из того твердо установленного факта, что вещество кислород обладает
магнитными свойствами (он парамагнитен). Так, струя жидкого кислорода реагирует
на магнитное поле, отклоняется при поднесении к ней постоянного магнита. Этим
кислород отличается, например, от немагнитных (диамагнитных) водорода, азота и
воды, в молекулах которых все электроны спарены.
Молекула озона О3. Элементу кислороду отвечают два газа – кислород О2
и озон О3. Молекула О3 имеет треугольное строение (см.
рисунок выше), в ней все шесть валентных электрона спарены, так что
газообразный озон – немагнитное (диамагнитное) вещество.
Озон - соединение неустойчивое, склонное к
самопроизвольному взрыву. Валентные электроны очень сильно наклонены друг к
другу и при малейшей возможности распрямляются с выделением энергии взрыва.
Все определяется магнитными
моментами электронов. Не все электроны участвуют в создании парамагнетизма, а
только неспаренные, т.е. у которых нескомпенсированный магнитный момент как у
молекулы кислорода.
Поэтому все инертные газы
диамагнетики, т.к. у них полностью заполненные электронные оболочки и значит,
все электронные моменты скомпенсированы. Также и поваренная соль (NaCl) - тоже
диамагнетик, т.к. если один электрон перейдет от натрия к хлору, то и у иона
натрия и у иона хлора будут полностью заполненные электронные оболочки.
Полными
аналогами кислорода по симметричному строению являются кальций Са и стронций Sr (см.
рисунок). Изотоп кальция 40Са, как и изотоп кислорода 16О, имеют дважды магическое ядро.
|
|
|
|
|
|

|
|
|
Азот14 J = 1+ валентность +1
|
Кислород16 J = 0+ валентность +2
|
Фтор19 J = 1/2+ валентность
-1
|
|
|
|
|
|
|
|

|
|
Электронная оболочка атома азота, валентность +5
|
Электронная оболочка атома кислорода и иона О –2
|
Электронная оболочка атома фтора, валентность
–1
|
9 Фтор. С ядра атома изотопа фтора 19F(100%) начинается одновременное
строительство с обоих торцов второго и третьего углеродного кольца.
Одинокий
торцевой валентный протон ядра атома фтора обеспечивает повышенную химическую
активность ( J =
½+). Почему фтор более химически активнее, чем кислород?
Это
объясняется строением его ядра, см. рисунок выше. На рисунке видно, что
одинокий протон ничем не связан, и позитрон имеет возможность свободно
вращаться. Эта энергия свободного позитрона передаётся валентному электрону.
Почему
два протона с противоположного торца ядра атома фтора не проявляют валентных
свойств?
Потому
что они пришиты позитронами к двум парам нейтронов. Плоскость вращения
позитронов параллельна экваториальной плоскости вращения ядра атома фтора. У
этих протонов нет возможности развернуться в валентное полярное положение, см.
рис.
Протонное
строение ядра атома фтора
повторяется у галогенов и всех щелочных
металлов,
вплоть до предпоследнего, ещё не синтезированного 119 химического элемента.
Одинаковое торцевое протонное строение фтора и щелочных металлов обеспечивает лёгкость протекания химических
реакций с их участием и прочность их химических соединений.
|
|
|
|
|
|
|
|
|
|
|
Неон20 J = 0+ валентность 0
|
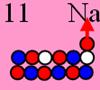
Натрий23 J = 3/2+ валентность +1
|
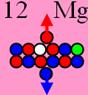
Магний25 J = 5/2-
валентность +2
|
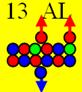
Алюминий27 J =5/2+
валентность +3
|
|

|

|

|

|
|
Электронная оболочка атома неона
валентность 0
|
Электронная оболочка атома натрия
валентность +1
|
Электронная оболочка атома магния валентность +2
|
Электронная оболочка атома алюминия валентность+3
|
|
|
|

|
|
|
Вид с торцов атома на валентные электроны
|
10 Неон. Изотоп неона 20N - самый
распространённый в природе (90,92%). Ядро атома неона можно рассматривать как
ассоциацию пяти альфа частиц. У неона
второе углеродное кольцо не достроено, оно состоит из двух атомов гелия, отсюда
такая химическая инертность.
Все
позитронные кольца, прошивающие по три нуклона сразу, лежат в экваториальной не
валентной плоскости. Протоны не имеют возможности развернуться в валентное
полярное положение.
Природа
использует все возможные варианты построения атомных ядер, статистическая
вероятность показывает её предпочтения. Ядро атома неона можно построить двумя
способами. Первый способ - это когда все четыре протона лежат в одной плоскости
на первом углеродном кольце, перпендикулярной оси вращения ядра атома. Во
втором способе с каждой стороны углеродного кольца лежат по два протона, см.
рисунок ниже.
Но
такое построение не может объяснить распухание диаметра атома неона в два раза
по сравнению с предыдущими атомами.
Единственное логическое объяснение - внутренние электронные облака первой
оболочки выталкивают вторую электронную
оболочку на более высокую орбиту.
|
|
|
|
|
Первый вариант плохо сбалансирован по спинам электронов, 4 электрона
тормозят друг друга
|
Второй вариант хорошо сбалансирован по спинам, но протоны не могут так
развернуть свои электроны
|
Третий вариант расположения сфер непроницаемости электронов оптимален
|
|
Рис. Электронная оболочка атома
неона
|
Третий
вариант отражён в таблице очерёдности заполнения электронной оболочки. Энергия
всех электронов при втором варианте одинакова.
|
|
2p
|
2p
|
|
|
2s
|
2p
|
|
|
2p
|
|
|
|
1s
|
2p
|
|
|
2s
|
2p
|
|
|
1s
|
|
|
очерёдность заполнения протонной оболочки ядра неона
|
|
После неона
следующие протоны симметрично поочерёдно собираются на торцах ядра атома
неона. Когда с каждой стороны первого углеродного кольца набралось по 6
протонов и 6 нейтронов, образуется тройное углеродное кольцо ядра атома
аргона, см. рис. Рассмотрим ход этого
строительство подробнее.
|
11 Натрий Изотоп 23N, единственный стабильный, имеет не
симметричное строение (J
= 3/2+).
Строение
его ядра и позитронная прошивка аналогична неону. Одиннадцатый протон занимает
положение, позволяющее ему сшивать своим позитроном ещё два нейтрона. Но для
центральной позиции ему не хватает оппозитного протона или нейтрона. А из
бокового положения его выталкивает электрон, который с ним жёстко связан.
Орбита рассчитана на 6 электронов, а пятый электрон образует
несимметричную фигуру, с которой пятый электрон принудительно выталкивается
электростатическими силами.
12 Магний, получив двенадцатый протон, выстраивает
два валентных торцевых протона по оси
симметрии. Два его изотопа 24Mg(10,13%) и 26Mg (78,7%) симметричны и немагнитны J = 0+, а изотоп 25Mg(11,17%) обладает
магнитными свойствами, он не симметричен
J = 5/2-.


Электронограммы алюминия при разных энергиях
облучения
13 Алюминий. Изотоп 27AL, единственный стабильный,
имеет два валентных протона с одной
стороны торца и третий валентный протон на оси симметрии. Между ними
периодически проскальзывает стабилизационный нейтрон. Два протонных вихря закручены в одну сторону, а стабилизационный
нейтрон закручен в обратную сторону, это не позволяет протонам тормозиться при
столкновениях. Это делает систему самоорганизующихся нуклонов устойчивой. С
противоположного торца симметрично бегает ещё один стабилизационный нейтрон, он
отвечает за валентность, не позволяет кольцевым протонам развернуться параллельно
оси вращения ядра атома. Во всех своих устойчивых соединениях алюминий
трёхвалентен. Это говорит о том, что три торцевых валентных электрона, жёстко
связанных с его торцевыми протонами, имеют одинаковую энергию и находятся на
практически одинаковом расстоянии от ядра. При высоких температурах алюминий
может проявлять валентность +1, это его единственный 3р электрон, при нагреве
удаляется от ядра дальше остальных двух 3s электронов.
Наиболее сильное расслоение наблюдается у
наружных валентных оболочек и незаполненных, которые обладают минимальной
устойчивостью (автор называет их активными). Это хорошо видно на примере
электронограммы алюминия, когда энергия бомбардирующих электронов различна.
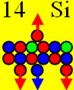
14 Кремний. Изотоп кремния 28Si самый распространённый (92,21%) в
четырёхвалентном состоянии имеет такой вид, см. рисунок ниже. Все 4 оси
валентных протонов параллельны оси вращения ядра атома. В двухвалентном
состоянии он бывает реже, но может принимать и инертную форму, 14 протонов
позволяю т это делать. В инертной форме все 14 осей вращения протонов
параллельны плоскости вращения ядра атома кремния. Поэтому изотоп кремния относят к магическим
ядрам. Кремний - второй после кислорода
по распространенности в земной коре элемент (27,6% по массе). И это не случайно. Природа отдаёт своё
предпочтение симметричным ядрам химических элементов с полностью заполненной
протонной оболочкой.
При
низких температурах кристаллический кремний
химически инертен, при
нагревании его реакционная способность резко возрастает. Судя по более
предпочтительной валентности +4, все его торцевые валентные электроны находятся
на примерно одинаковом расстоянии от ядра.
15 Фосфор имеет только один стабильный изотоп
31Р (см. рисунок ниже) и
может принимать валентные формы -3,+3, +1, +5. Элементарный фосфор в обычных
условиях представляет собой несколько устойчивых аллотропических модификаций.
Обычно выделяют четыре модификации простого вещества — белый, красный,
черный и металлический фосфор. В обычных
условиях существует только три аллотропических модификации фосфора, а в
условиях сверхвысоких давлений — также металлическая форма. Все модификации различаются по цвету,
плотности и другим физическим характеристикам. Заметна
тенденция к резкому убыванию химической активности при переходе от белого к
металлическому фосфору и нарастанию металлических свойств. Аллотропические модификации
фосфора имеют разное строение ядра атома и электронной оболочки, см.
таблицу аллотропических форм фосфора.
Валентные
протоны сосредоточены по торцам ядра атома неона. Два с одного и три с другого
торца. Наиболее характерная валентность +5 говорит о том, что все его валентные
торцевые электроны находятся на одинаковом расстоянии от ядра. Суммарный спин
1/2+ обеспечен смещением одного 3s протона с центрально осевого положения. Два валентных торцевых
протона находятся на нейтронных «балконах», это позволяет максимально разнести
три протонных вихря с одинаковым спином, вращающимся в одну сторону.
|
Таблица аллотропических модификаций фосфора
|
|
|
|
|
|
|
Белый фосфор,
валентность +5
|
Красный фосфор,
валентность +/-3
|
Чёрный фосфор,
валентность +1
|
Металлический фосфор, валентность 0
|
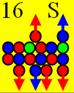
16 Сера. Самый распространённый изотоп
серы 32S (95%), см. рисунок ниже, может принимать валентные формы +2,
+4, +6. Три валентных 3р+ протона симметрично прилепились к 3s- протону, расположенному с одного торца ядра атома
неона. Четвёртый 3р+ протон расположен с другого торца.
17 Хлор. Изотоп 35Cl, распространённость
(75,53%), может принимать четыре валентные формы -1,+1 +3, +5, +7 редко +2 и
+4. У этого стабильного изотопа впервые формируется третье нейтронное кольцо,
18-ти нейтронов хватает на это. Валентные протоны распределились по торцам ядра
атома неона следующим образом. Три валентных протона со стороны недостроенного
второго слоя-оболочки. Два из этих протона достраивают второй слой-оболочку, а
третий осевой S протон обеспечивает валентность +1, -1. Ещё четыре валентных
протона начинают строительство нового третьего слоя-оболочки. В хлориде
натрия каждый атом Cl в кристалле NaCl связан с шестью другими атомами, плюс
седьмая связь с Na.
Атомы с торцевыми валентными s-электронами,
как с наинизшей энергией связи с протонами,
легко вступают в магнитные связи с другими валентными электронами, поэтому
такие атомы и их коллективы в виде, например, твердых тел, являются сильными
восстановителями и легко окисляются. Интересно отметить, что вещества и
материалы на основе s – элементов, как правило (кроме водорода и гелия) – это
металлы, и они также легко окисляются; способность быть восстановителем
усиливается с ростом n. По мере того как
образуются ионы, взаимодействующие друг с другом по законам электростатики, на
основе s-элементов образовано много положительных ионов. Как только в
пределах уровня появляются р-орбитали, т. е. более высокие по запасам энергии,
электроны увеличивают силы взаимодействия с ядром. Чем больше электронов на
p-подуровнях, тем менее свойственна этим атомам способность к потере
электронов. Более того, у них появляется способность к приобретению их, т. е. к
способности атома быть восстановителем добавляется способность атома быть
окислителем. Это уникальное свойство только р-элементов определенного уровня
заполнения; ни s - металлы, ни в последующем d-металлы не могут быть, как
правило, окислителями. Таким образом, при переходе с s- на p- конфигурацию к
свойству отдавать электроны добавляется свойство присоединять электроны. В
области p-элементов есть много таких (например, металл алюминий и неметаллы
кремний, германий), которые используются при изготовлении конструкционных
(алюминий) или полупроводниковых (кремний, германий) материалов. Из s-элементов
ранних уровней те, которые способны распаривать (промотировать) свои электроны
при определенных условиях с s- на
p-подуровни (например магний, бериллий),
также
могут быть использованы при получении конструкционных материалов. Среди
р-элементов металлов, применяемых широко в промышленности, не так много, кроме
алюминия – олово, свинец и некоторые другие.
Следующая
группа элементов – d-элементы, т.е. те, у которых заполняется d-конфигурация.
Как показывает опыт, они характеризуются в большей степени способностью к
отдаче электронов, т.е. являются металлами и восстановителями. Поскольку
энергия d- орбитали выше, чем s-, d- элементы более устойчивы в окружающей
среде, а некоторые благородные – золото, серебро – термодинамически стабильны,
вследствие чего на их основе изготавливают самые устойчивые в окислительной
среде материалы. Как правило, все
современное конструкционное материаловедение использует (в масштабах иногда до
сотен миллионов и тонн в год в мировом масштабе) именно d-металлы: железо,
титан, никель, хром, вольфрам, молибден, медь, кобальт.
|

|
|

|
|
|

|
|

|
|
Кремний28 J =
0+ в четырёхвалентном состоянии
|
Фосфор31 J = 1/2+ в пятивалентном состоянии
|
Сера32 J = 0+ в шестивалентном состоянии
|
Хлор35 J = 3/2+ в семивалентном состоянии
|
|
|

|
|
|
|
Кремний28 в двухвалентном состоянии
|
Фосфор31 в трёхвалентном состоянии
|
Сера32 в четырёхвалентном состоянии
|
Хлор35 в одновалентном состоянии
|
|
|
|
|
|
|
Кремний28 в инертном состоянии
|
Фосфор31 в одновалентном состоянии
|
Сера32 в двухвалентном состоянии
|
|
|

|
|
|
|
|
Электронная оболочка атома
кремния
валентность +4
|
Электронная оболочка атома
фосфора
валентность +5
|
Электронная оболочка атома серы
валентность +6
|
Электронная оболочка атома хлора
валентность +7
|
|
|
|
 
|
|
|
Расположение электронов на торцах атома при максимально возможной
валентности
|
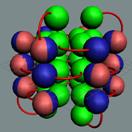
18 Аргон. Изотоп аргона 40Аr -
самый распространённый в природе (99,6%), его 18
протонов
хватает для полноценного заполнения трёх слоёв-оболочек. Следующие протоны
симметрично поочерёдно собираются на торцах ядра атома неона. Когда с каждой
стороны «снежинки» набралось по 6 протонов и 6 нейтронов, образуется тройная
«снежинка» ядра атома аргона, см. рисунок ниже.
Ядро атома аргона состоит из трёх углеродных колец, в которых нуклоны
уложены в плотную упаковку столбиком, см. рисунок ниже. На обоих торцах
находятся по два стабилизационных нейтрона. Два нейтрона занимают центрально
осевое положение, а два других стабилизационных бегают симметрично по торцам
ядра атома, сталкивая с торца валентные протоны. Этим объясняется химическая
инертность аргона. Ни один протон не может развернуться и стать валентным,
совместив свою ось вращения с осью вращения ядра атома.
Из
того факта, указанного В. Пакулиным (2004), что “поток электронов в мощной вакуумной дуге не расталкивается, а
стягивается (явление шнурования дуги)”, можно сделать вывод, что
кулоновское отталкивание электронов друг от друга в дуге отсутствует. В.
Пакулин объясняет это явление тем, что взаимодействие одноименных электрических
зарядов зависит от взаимной ориентации их “зарядовых трубок”. Если зарядовые трубки параллельны, то кулоновское
взаимодействие отсутствует.
|
|
|
|
Позитронная прошивка углеродного кольца вызывает смещение
сфер непроницаемости протона. Протон и его нейтрон вращаются немного не соосно. Плоскости их вращения находятся под
углом 300.
|
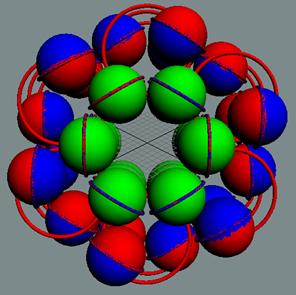
Инертное ядро атома аргона набирается из нескольких слоёв
углеродных колец. Каждый слой развёрнут на 1800 друг относительно
друга. Это позволяет нуклонам вращаться сонаправленно.
|
|
|
|
|
|
|

|

|

|
|
|
Неон20 J = 0+ валентность 0
|
Электронная оболочка
атома неона
|
Электронная оболочка
аргона валентность 0
|
Аргон40
J = 0+ валентность 0
|
У
изотопа аргон 40Ar18
видно, что двойная позитронная прошивка не даёт развернуться торцевым протонам
в валентное положение. Ещё двум протонам с каждого торца мешают торцевые
нейтроны. Оставшимся двум потенциально валентным протонам мешает встречное
вращение позитрона.
От
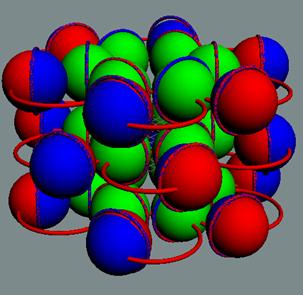
аргона до хрома строительство ядра атома идёт обычным способом. Протоны,
попеременно симметрично, с учётом спина, достраивают два новых углеродных
кольца с обоих торцов ядра атома аргона,
см. рисунок ниже.
|
|
|
|
Нейтронная сердцевина ядра укладывается правильными
стопками. А протонная оболочка смещается в шахматном порядке. У ядра атома
образуется шесть сдвоенных магнитных полюсных дорожек.
|
Три магнитных полюса северных и три магнитных полюса
южных. Каждая сдвоенная магнитная полюсная дорожка «смотрит» на свой
электронный цуг. Каждый протон «пристально смотрит» на свой электрон.
|
|
2p
|
3s
|
3p
|
|
3p
|
2s
|
2p
|
|
2p
|
1s
|
3p
|
|
3p
|
3s
|
2p
|
|
2p
|
2s
|
3p
|
|
3p
|
1s
|
2p
|
|
Порядок заполнения
протонной оболочки ядра атома аргона
|
19 Калий Изотоп калия 39К имеет спин J = 3/2+,
это говорит о том, что один валентный 4s протон бегает вокруг
центрального осевого нейтрона. Эта непрерывная беготня вызывает прецессию оси
вращения валентного 4s
протона. К валентному 4s протону жёстко прикреплён магнитными связями
4s валентный электрон.
Этот валентный 4s
электрон обшаривает всё полушарие над осью вращения ядра атома. Этот электрон,
как голодный волк, набрасывается на всё, что есть в его полушарии. Этим
объясняется повышенная химическая активность калия. Калий обладает большой сжимаемостью
при приложении внешнего давлении, т.к. его одинокий валентный торцевой электрон
далеко отбрасывается электростатическими силами.
20 Кальций 40Са ( J = 0+), этот изотоп имеет абсолютно
симметричное ядро атома. У него дважды магическое число - 20 протонов и 20
нейтронов входят в состав этого изотопа. У кальция два валентных 4s протона, но его химическая
активность ниже, чем у калия, в чём причина? Причина в центрально осевом положении
двух валентных 4s
протонов. Их оси вращения жёстко связаны с осью вращения ядра атома. Площадь
сегмента полусферы, доступная для контактов у кальция, гораздо меньше, чем у
калия. Этим объясняется меньшая
химическая активность кальция по сравнению с калием.
21 Скандий на 100% состоит из изотопа 45Sc. Такая не симметричная
комбинация зарядов из 21-го протона может устойчиво существовать только при
таком наборе нейтронов. Дополнительные шесть нейтронов образуют новый четвёртый
нейтронный слой и дают возможность устойчиво существовать нечётному 21-му
протону ( J = 7/2-). Со
скандия начинается строительство четвёртого углеродного кольца.
22 Титан. У самого распространённого (73,99%) изотопа
титана 48Ti
четвёртый протонно-нейтронный слой сбалансирован ( J = 0+), см. рисунок ниже. В последнем
ещё недостроенном протонном слое есть два вакантных места для двух протонов.
Повышенная химическая стойкость титана объясняется наличием этих вакантных
мест, их могут занимать валентные осевые торцевые 4s протоны. Заполнив недостроенный
четвёртый протонно-нейтронный слой протонами и нейтронами, ядро титана по
строению начинает напоминать ядро аргона. Четыре торцевых протона обеспечивают
валентность +2, +3, +4. Валентность +2 обеспечивают два торцевых 4s протона.
23 Ванадий. Пять торцевых протонов изотопа ванадия 51V обеспечивают
ему валентность +2, +3, +4, +5. Три торцевых 3р протона имеют одинаковый спин
1/2+. Они лежат на «боку» под углом 120 градусов в четвёртом протонном слое и
обеспечивают валентность +3, +4, +5. Изначально они не валентны, их электроны
перпендикулярны оси вращения ядра ванадия.
Первыми в магнитную связь вступают два торцевых электрона у осевых 4s протонов, обеспечивая
валентность +2. Эти осевые-торцевые электроны вращаются синхронно с ядром ванадия.
Им не надо гасить инерцию вращения тяжёлого ядра атома. Нечётный протон изотопа
V51 обеспечивает
суммарный ядерный спин J = 7/2-.

|
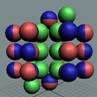
|
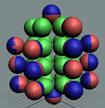
|

|
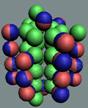
|
|
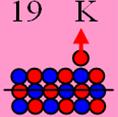
|
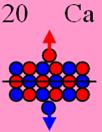
|
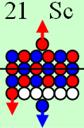
|
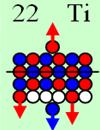
|
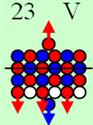
|
|
Калий39 J =3/2+ валентность +1
|
Кальций40 J=0+
валентность +2
|
Скандий45 J=5/2-3/2+1/2=7/2-
валентность +2
|
Титан48 J=0+
валентность +2
|
Ванадий51 J = 7/2- валентность +2
|
|

|

|

|
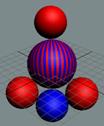
|

|
|
Электронная оболочка атома калия валентность +1
|
Электронная оболочка атома кальция валентность +2
|
Электронная оболочка атома скандия валентность +3
|
Электронная оболочка атома титана валентность +4
|
Электронная оболочка атома ванадия
валентность +5
|
|

|
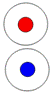
|
 
|
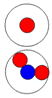
|
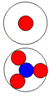
|
|
Расположение электронов на торцах атома при максимально возможной
валентности
|
24 Хром.
У хрома начинается строительство пятого протонно-нейтронного
углеродного кольца. Самый распространённый изотоп хрома 52Cr (83,76%), его ядро имеет
такой вид, см. рисунок ниже.
Хром
- первый химический элемент, у которого обнаружено нарушение в заполнении
электронной оболочки. По теории, электронная оболочка должна выглядеть так: (Аr)4s2 3d4. Спектральный анализ показывает такое строение: (Аr)4s1 3d5. Вместо одного отсутствующего 4s электрона появляется пятый 3d электрон.
Почему?
Прежде
всего, надо обратить внимание на то, что энергетически 4s электроны и 3d электроны практически идентичны. Что
до построения четвёртой 4р оболочки не встречалось. Эта энергетическая
равноценность электронных вихрей
вызывает сбои в дальнейшем построении электронных слоёв.
Взглянем
на рисунок ядра атома хрома, и всё становится ясно! Виновата зарядовая
симметрия (J=0+), у
ядра атома хрома появился пятый нейтронный слой, на котором можно удобно
разместиться протонам. Ни у ванадия, ни у титана нет такой возможности,
поэтому
их ядра зарядово не симметричны. А начиная с ядра атома хрома, начинает
восстанавливаться зарядовая симметрия!
Один осевой 4s+ протон
со спином 1/2+ покидает свой торец и занимает на противоположном торце позицию
3d со спином 3/2+. Две
энергетически одинаковые электронные сферы непроницаемости на одном торце атома
хрома занимают зарядово симметричные позиции. Поэтому с центральной осевой
позиции 4s+ протон
переходит в более удобную 3d
позицию. Все валентные протоны на торцах
ядра атома хрома, даже 4s+,
лежат в одной плоскости, перпендикулярной оси вращения, под углом 120 градусов
друг к другу. Это объясняет химическую стойкость хрома. Шесть торцевых
валентных протонов обеспечивают валентность +2, +3, +6. Хром антиферромагнетик,
антипараллельная ориентация элементарных магнитных моментов торцевых электронов причина этого. При
нагревании антиферромагнетик испытывает фазовый переход в парамагнитное состояние. Хром обладает всеми характерными свойствами металлов —
хорошо проводит тепло, почти не оказывает сопротивления электрическому току,
имеет присущий большинству металлов блеск.
Любопытна одна особенность хрома: при температуре около
37°С он ведет себя явно «вызывающе» — многие его физические свойства резко,
скачкообразно меняются. В этой температурной точке внутреннее трение хрома
достигает максимума, а модуль упругости падает до минимальных значений. Так же
внезапно изменяются электропроводность, коэффициент линейного расширения,
термоэлектродвижущая сила. Пока ученые не могут объяснить эту аномалию.
25 Марганец имеет только один
стабильный изотоп 55Mn.
Основные валентные состояния -1, 0, +2,
+4, +7. Семь валентных протонов размещаются на торцах ядра атома в соотношении
как 3 к 4. Ядро изотопа имеет не симметричное строение спин J=5/2-.
|
|
26 Железо имеет
четыре стабильных изотопа, самый распространённый 56Fe(91,66%),
54Fe(5,82%), 57Fe(2,19%), 58Fe(0,33%). Восемь протонов симметрично по четверо, размещаются
на четвёртом и пятом нейтронном кольце ядра атома железа, объясняют
экзотическую +8 предельную валентность железа. Четыре валентных протона на
торце ядра атома - предельно возможное состояние. Причём центральный протон,
чтобы не тормозить три боковых протона, должен иметь обратное вращение (спин).
Изображение ядра (на рисунке ниже) объясняет его предельную валентность +8 и
его химическую инертность к некоторым химическим веществам. Железо —
ферромагнетик, оно легко намагничивается, но теряет магнитные свойства при
снятии магнитного поля. С повышением температуры магнитные свойства железа
ухудшаются и выше 769°С оно практически не поддается намагничиванию (иногда
железо в интервале 769—910°С называют &betta;-Fe); γ-Fe не является
магнитным материалом.
При
температуре 769°С происходит перестройка ядра атома железа, из
обычного шестивалентного оно превращается в восьмивалентное. Одна из пар
нейтральных боковых протонов при нагревании распаривается и протон с
отрицательным 1/2- спином занимает центрально осевое положение. Вокруг него
группируются три протона с 5/2+ спином. Два торца ядра атома железа приобретают
зеркальную симметрию. Оба торца ядра атома оканчиваются протонами с 1/2-
спином. Отсюда немагнитные свойства &betta;-Fe и γ-Fe..
В
незаполненном подслое пять электронов обладают положительным (правым) спином и
лишь один – отрицательным (левым). Следовательно, атом железа имеет четыре не
скомпенсированных спина. Подобное отсутствие компенсации спиновых моментов в
одном из внутренних слоев электронной оболочки атома является необходимым
условием ферромагнетизма.
|
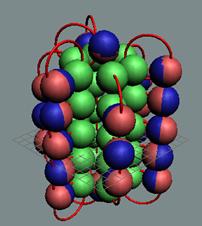
|

|
|
Позитронная прошивка нуклонов
изотопа двухвалентного железа 56Fe
|
Электронная оболочка
двухвалентного атома железа с инертной сферой непроницаемости и двумя
валентными электронными вихрями
|
27 Кобальт
имеет только один стабильный изотоп 59Со. Четвёртое углеродное
кольцо продолжает достраиваться у ядра
атома кобальта. Вторая пара протонов с
противоположными спинами, надёжно залегает в боковом положении, обеспечивая
предельную валентность +5. Ядро изотопа имеет не симметричное строение.
Какую
валентность следует приписать атому кобальта в его хлориде, присоединившем
шесть молекул аммиака с образованием соединения CoCl3·6NH3
(или, что то же, Co(NH3)6Cl3)? В нем атом
кобальта соединен одновременно с девятью атомами хлора и азота!
В
этом соединении кобальт находится либо в трёх, либо в пятивалентном состоянии.
28 Никель
имеет пять стабильных изотопов, самый распространённый 58Ni(67,76%), 60Ni(26,16%), 61Ni(1,25%), 62Ni(3,66%), 64Ni(1,16%). Окончательно достраивается четвёртое
углеродное кольцо у никеля. Предельная валентность +4, см. рисунок ниже.
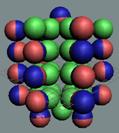
|
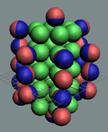
|

|
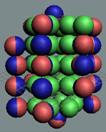
|
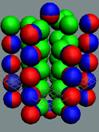
|
|
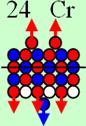
|
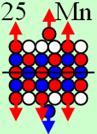
|
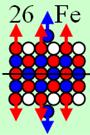
|
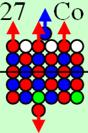
|
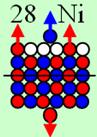
|
|
Хром52 J=0+ валентность +3
|
Марганец55 J=5/2-
валентность +2
|
Железо56
J=0+
валентность +8
|
Кобальт59 J=7/2-
валентность +2
|
Никель58 J=0+ валентность +2
|
|

|

|

|

|

|
|
Электронная оболочка атома хрома валентность +6
|
Электронная оболочка атома марганца валентность +7
|
Электронная оболочка атома железа валентность
+8
|
Электронная оболочка атома кобальта валентность +5
|
Электронная оболочка атома никеля валентность +4
|
|
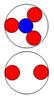
|
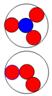
|
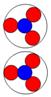
|
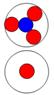
|
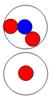
|
|
Расположение электронов на торцах атома при максимально возможной
валентности
|
29 Медь имеет два стабильных изотопа: 63Cu(69,1%) и 65Cu(30,9%). У меди мы
наблюдаем второй слой в электронном строении оболочки. Как видно из рисунка
ниже, у ядра изотопа атома 63Cu нет
одного торцевого 4s протона, его место занимает нейтрон. Как и у атома хрома,
второй 3d электрон
сталкивает 4s электрон
с центрально осевой позиции.
Такое
пространственное распределение зарядов оптимально для 29 протонов и объясняет
переменную валентность меди +1 и +2, обеспечиваемую 4s- протонами. Валентность +3 и +5 обеспечивают три торцовых 3d протона ядра
атома. С меди начинает строиться пятое углеродное кольцо в ядре. Но одна пара
протонов плохо, ненадёжно залегает в боковом положении, обеспечивая меди, как и
железу, переменную валентность.
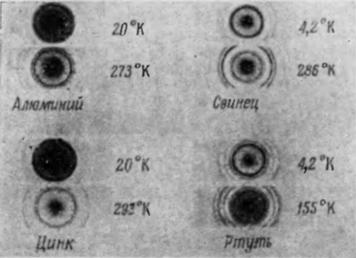
Электронограммы пленок алюминия,
цинка, свинца и ртути при температуре конденсации, а также после нагрева до комнатной
температуры
30 Цинк имеет пять стабильных изотопов,
самый распространённый 64Zn(48,89%), 66Zn(27,81%), 67Zn(4,11%), 68Zn(18,57%), 70Zn(0,62%). У ядра атома цинка полная
зарядовая симметрия, см рисунок ниже. Две пары протонов продолжают строить
пятое углеродное кольцо. Валентность +2 обеспечивают два торцевых 4s протона.
Бороться с «выскочками» помогают два торцевых стабилизирующих нейтрона, вращаясь вокруг центральных протонов, они
заталкивают на место боковые протоны. Этим обеспечивается стабильная
валентность цинка +2.
31 Галлий имеет два стабильных изотопа 69Ga(60,4%) и 71Ga(39,6%). Ядро галлия с
одного торца имеет один стабилизирующий торцевой нейтрон, расположенный
оппозитно 4р+ протону, обеспечивая симметричность расположения протона.
Строительство пятого углеродного кольца приостанавливается, начинается
строительство шестого углеродного кольца. Запас 3d электронов закончился. Устойчивый
фундамент из 3d
электронных облаков для 4р электронов возведён. С галлия начинает достраиваться
4р электронный слой-оболочка.
32 Германий имеет пять стабильных
изотопов, самый распространённый 74Ge(36,54%), 70Ge(20,52%), 72Ge(27,43%), 73Ge(7,76%), 76Ge(7,76%). Появляется второй
4р+ протон с положительным спином с одного торца ядра атома. Заряд ядра
германия 32 чётный, изоспин ядра J= 0+.
33
Мышьяк имеет только один стабильный
изотоп 75As. Появляется третий 4р+
протон с положительным спином с одного торца ядра атома.
Из
таблицы периодической системы протонной структуры ядер 120 химических элементов
можно заметить и сделать следующий вывод: Все
три 4р+ протона с положительным спином появляются только со стороны 4s- протона с отрицательным спином. И наоборот все три 4р- протона
с отрицательным спином появляются со
стороны 4s+ протона с положительным спином.
Физический
смысл происходящего: спин-спиновые взаимодействия протонов в ядре атома.
Происходит стихийное самосогласование вращений протонных вихрей.
Центральный-полярный 4s
протонный вихрь вращается «попутно» 4р протонным вихрям.
|
|
|
|
|
|
|
|
|
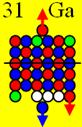
|
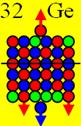
|
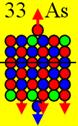
|
|
Медь63 J = 3/2- валентность +5
|
Цинк 64 J = 0+ валентность +2
|
Галлий 69 J = 3/2- валентность +3
|
Германий 74 J= 0+ валентность +4
|
Мышьяк75 J = 3/2- Валентность +5
|
|

|

|

|

|

|
|
Электронная оболочка атома меди валентность +5
|
Электронная оболочка атома цинка валентность +2
|
Электронная оболочка атома галлия валентность +3
|
Электронная оболочка атома германия валентность +4
|
Электронная оболочка атома мышьяка
валентность +5
|
|
|

|


|

|

|
|
Расположение электронов на торцах атома при максимально
возможной валентности
|
34 Селен имеет шесть стабильных
изотопов, самый распространённый 80Se(49,82%), 74Se(0,87%), 76Se(9,02%), 77Se(7,58%), 78Se(23,52%), 82Se(9,19%). В химических
соединениях селен обычно проявляет валентность +4 +6 и –2. Один
торец ядра полностью насыщен 4 шт. валентными протонами. Судя
по валентности, на другом торце его ядра
появляется первый 4р- протон с отрицательным спином. Начинается
строительство седьмого углеродного кольца. Стихийная самоорганизация начинает
восстанавливать зарядовое равновесие.
35 Бром имеет два стабильных изотопа 79Br(50,537%), 81Br(49,463%). Предельная валентность +7.
Появляется второй 4р- протон в седьмом строящимся углеродном слое.
|
|
|
|
|
|
|

|
|
|
|
|
Селен80 J =0+ валентность +6
|
Бром79 J = 3/2- валентность+7
|
Криптон84
J = 0+
валентность 0
|
Рубидий85 J = 5/2- валентность+1
|
Стронций88
J
= 0+ валентность+2
|
|
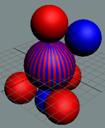
|
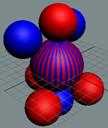
|
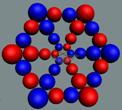
|

|

|
|
Электронная оболочка атома селена
валентность +6
|
Электронная оболочка атома брома
валентность +7
|
Электронная оболочка атома криптона
валентность 0
|
Электронная оболочка атома
рубидия валентность +1
|
Электронная оболочка атома стронция валентность +2
|
|
n
|
3d
|
2p
|
3s
|
3p
|
3d
|
4p
|
|
4p
|
3d
|
3p
|
2s
|
2p
|
3d
|
n
|
|
n
|
4s
|
2p
|
1s
|
3p
|
3d
|
4p
|
|
4p
|
3d
|
3p
|
3s
|
2p
|
3d
|
n
|
|
n
|
3d
|
2p
|
2s
|
3p
|
3d
|
4p
|
|
4p
|
3d
|
3p
|
1s
|
2p
|
4s
|
n
|
|
Порядок заполнения
протон-
ной оболочки ядра
атома криптона
|
36 Криптон имеет шесть стабильных
изотопов, самый распространённый 84Kr(56,90%), 78Kr(0,354%), 80Kr(2,27%), 82Kr(11,56%), 83Kr(11,55%), 86Kr(17,37%). Шестое и седьмое
углеродное кольцо одновременно достраивается у криптона. Третий 4р- протон
заканчивает строительство седьмого протонного кольца. А два 4s
протона прочно залегают в шестом углеродном 3d кольце, достраивая его. При этом наружная электронная оболочка
образует три замкнутых слоя по 6 электронов в слое, а в четвёртом электронном
слое сразу 18 электронов. Все 36 электрона трёх электронных слоев вступают в
магнитную связь между собой, образуя 6
цугов по 3 электрона в каждом цуге, и закладывается фундамент для 12 боковых 3d цугов.
У
изотопа 84Kr на торцах ядра атома располагаются два протонных кольца, состоящих из 4р+/- протонов. Это самый
устойчивый и самый распространённый в природе изотоп криптона (56,9%). Ядро изотопа криптона абсолютно
симметрично, у него геометрически правильное строения ядра.
У
86Kr магическое число нейтронов - 50, но он менее распространён в
природе, всего 17,37%. Так что его
магический статут сомнителен.
37 Рубидий
имеет один стабильный изотоп 85Rb(72,15%) и один радиоактивный изотоп 87Rb(27,85%) с периодом
полураспада 5х1010лет. Спин J = 5/2- говорит о нецентральном положении 5s+ протона.
Вывод:
одиночные s протоны всегда на торце ядра атома занимают нецентральное осевое положение.
Физический
смысл происходящего: первый одиночный s протон вносит дисбаланс в симметричное ядро инертного атома и
центробежные силы при вращении неизбежно отбрасывают его на край торца ядра.
Как
только появляется второй s
протон, симметрия восстанавливается, что мы видим на примере следующего
элемента стронция.
38 Стронций имеет четыре стабильных
изотопа, самый распространённый 88Sr(82,56%), 84Sr(0,56%), 86Sr(9,86%), 87Sr(7,02%). Изотоп стронция 88Sr тоже
обладает магическим статутом, у него 50 нейтронов. Два торцевых валентных 5s протона
обеспечивают стабильную валентность +2.
39 Иттрий имеет
только один стабильный изотоп 89Y. С иттрия начинается строительство «фундамента» для 5р
электронных сфер непроницаемости. Между 5р электронными сферами может свободно
разместиться двенадцать 4d электронных сфер непроницаемости. Так появляется
первый 4d+ протон. Валентность +3. Суммарный спин ядра J = 1/2- обеспечивается тем,
что сфера непроницаемости 4d+ электрона имеет примерно одинаковый размер с
торцевой 5s+
сферой непроницаемости. Сфера
непроницаемости 4d+ электрона мешает занять центрально осевое положение 5s+ сфере непроницаемости. Они, 4d+ и 5s сферы непроницаемости занимают симметричное
положение относительно оси вращение ядра
изотопа. И 5s+ электрон
стягивает 5s+ протон с
центрально осевого положения со спином J = 1/2+ в позицию со спином J = 3/2+. Оставшийся в одиночестве другой 5s- протон обеспечивает ядру изотопа 89Y спин J =
1/2-.
40 Цирконий имеет пять стабильных
изотопов, самый распространённый 90Zr(51,46%), 91Zr(11,23%), 92Zr(17,11%), 94Zr(17,40%), 96Zr(2,80%). У циркония появляется второй 4d+ протон.
Суммарный спин ядра J = 0+. Предельная
валентность +4.
41 Ниобий имеет
только один стабильный изотоп 93Nb. У ниобия появляется третье, после хрома и меди,
нарушение в строительстве электронной оболочки. Спектральный анализ показывает
5s1 4d4, а по
теории должно быть 5s2
4d3. Вместо двух 5s электронов у ниобия обнаружен только
один 5s электрон.
Почему? Электроны 5s и 4d имеют практически одинаковую энергию и геометрические
размеры сфер непроницаемости, см. таблицу квантования геометрических размеров электронных оболочек 120 химических
элементов. У них практически одинаковый
радиус сфер непроницаемости и они находятся на практически одинаковом
расстоянии от ядра атома. Поэтому, когда появляется третий 4d+ электрон, он предпочитает не тесниться вчетвером на одном торце ядра атома
ниобия. Этот электрон стремится
восстановить зарядовую симметрию 5р электронной оболочки. Жёстко прикреплённый
к нему 4d+ протон появляется на противоположном торце ядра атома. Две сферы непроницаемости 5s+ и 4d+ электронов с
одинаковой энергией и одинаковым спином конкурируют за центрально осевое
положение 5s+
электрона. В результате оно остаётся вакантным.
И как у меди и хрома два валентных торцевых электрона
ниобия занимают симметричное положение относительно оси вращения ядра атома.
При этом 5s+ электрон стягивает 5s+ протон с центрально
осевого положения со спином J = 1/2+ в позицию
со
|
|
|
|

|

|
|
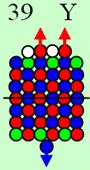
|
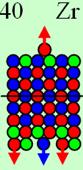
|
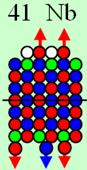
|
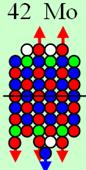
|
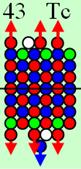
|
|
Иттрий89 J = 1/2- валентность+3
|
Цирконий90 J = 0+ валентность+4
|
Ниобий93 J = 9/2+ валентность+5
|
Молибден98 J = 0+ валентность+6
|
Технеций97 J = 9/2+ валентность+7
|
|

|
|
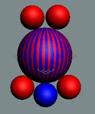
|

|

|
|
Электронная оболочка атома иттрия
валентность +3
|
Электронная оболочка атома
циркония валентность +4
|
Электронная оболочка атома ниобия
валентность +5
|
Электронная оболочка атома
молибдена валентность +6
|
Электронная оболочка атома
технеция валентность +7
|
спином
J = 3/2+. Оставшиеся
два не сбалансированных 4d+ протона и один центрально
осевой 5s-
протон обеспечивает ядру изотопа 93Nb суммарный
спин J = 5/2+
5/2+1/2-.=9/2+.
42 Молибден имеет семь стабильных
изотопов, самый распространённый 98Мо(23,75%), 92Мо(15,86%), 94Мо(9,12%), 95Мо(15,7%), 96Мо(16,5%),
97Мо(9,45%), 100Мо(9,62%).
Точно такая же ситуация складывается и у
молибдена. Две сферы непроницаемости
5s+ и 4d+ электронов с
одинаковой энергией и одинаковым спином конкурируют за центрально осевое
положение 5s+
электрона на одном торце ядра атома. В
результате оно остаётся вакантным. И мы видим нарушение в строительстве
электронной оболочки 5s1
4d5, а
должно быть 5s2 4d4. Вместо двух 5s электронов у ниобия обнаружен только
один 5s электрон.
Предельная валентность +6.
43 Технеций не имеет стабильного
изотопа. Максимальная валентность+7. Восстанавливается
обычный порядок строительства электронной оболочки. Видимо, при одновременной конкуренции трех
электронных сфер непроницаемости - это
оптимальный
зарядовый баланс. Суммарный спин ядра изотопа 97Тс J = 9/2+ указывает, что оставшиеся два не
сбалансированных 4d+ протона и один центрально
осевой 5s-
протон обеспечивает ядру самого долгоживущего
изотопа 97Тс суммарный спин J = 5/2+ 5/2+1/2-.=9/2+.
44 Рутений имеет семь стабильных
изотопов, самый распространённый 102Ru(31,61%), 96Ru(5,51%), 98Ru(1,87%),
99Ru(12,72%), 100Ru(12,61%),
101Ru(17,07%), 104Ru(18,58%).
Наиболее характерная валентность +3 и +4, но экстремальная валентность +8, как
у железа. Две пары электронов со спинами + и - симметрично попарно залегают на
экваторе и перестают быть валентными. Оставшиеся четыре электрона симметрично
перераспределяются по торцам ядра атома рутения. Но с одного торца не хватает
одного 5s-
электрона. Его место оспаривают два 4d+ электрона, в
результате оно остаётся вакантным. И снова в электронной оболочке у рутения
обнаруживается нарушение 5s1 4d7, а должно быть 5s2 4d6.
RuO4 – очень интересное соединение. В обычных
условиях это золотисто-желтые иглообразные кристаллы, которые уже при 25°C плавятся,
превращаясь в коричнево-оранжевую жидкость со специфическим запахом, похожим на
запах озона. При соприкосновении с малейшими следами большинства органических
веществ четырехокись рутения моментально взрывается. Свойство взрываться RuO4 говорит об огромной скрытой энергии,
потребовавшейся для получения этой +8 валентности и о её неестественности.
Поэтому
в таблице периодической системы
протонной структуры ядер 120 химических элементов приводится вторая более
естественная +6 валентная форма рутения, соответствующая спектральному анализу.
При этой валентности одна пара протонов залегает набок и более не участвует в
валентных связях.
45 Родий имеет
только один стабильный изотоп 103Rh. О существовании соединений шестивалентного
родия в литературе сообщалось неоднократно, однако окончательно это до сих пор
не установлено. Родий образует довольно устойчивые комплексные соединения. Их
можно разделить на два класса: соединения с комплексным катионом и соединения с
комплексным анионом. В соединениях первого типа родий имеет координационное
число 6. Некоторые соединения родия, кажущиеся по своему валовому составу
простыми солями, имеют в действительности сложное строение. Иногда они образуют
даже изомеры.
Высшую
степень окисления +6 родий проявляет в гексафториде RhF6, который
образуется при прямом сжигании родия во фторе. Соединение неустойчиво. Суммарный
спин ядра J = 1/2- указывает на отсутствие с
одного торца ядра 5s+
протона. Спектральный анализ показывает нарушение в
строительстве электронной оболочки 5s1 4d8, а должно быть 5s2 4d7. Вместо двух 5s электронов у родия
обнаружено только один 5s
электрон. Две сферы непроницаемости 5s+ и 4d+ электронов с
одинаковой энергией и одинаковым спином конкурируют за центрально осевое
положение 5s+
электрона на одном торце ядра атома.
46 Палладий имеет шесть стабильных
изотопов, самый распространённый 106Pd(27,33%), 102Pd(0,96%), 104Pd(10,97%), 105Pd(22,33%), 108Pd(26,71%), 110Pd(11,81%). У палладия
спектральный анализ вообще не обнаружил 5s электроны. На каждом торце
ядра атома палладия в последних углеродных кольцах по пять протонов, из них по
два протона парных не валентных, «залёгших» навсегда. Оставшиеся протоны по три на каждом торце ядра атома
обеспечивают палладию предельную валентность +6. Эта «лямур де труа», любовь
втроем, настолько сильна, что сталкивает 5s протоны из валентного, центрально осевого положение в
невалентное, лежачее боковое 4d
положение.
|
|
|

|

|
|
|
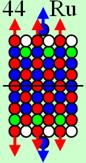
|
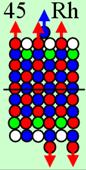
|
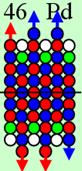
|
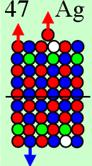
|
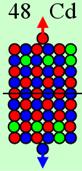
|
|
Рутений102 J = 0+
валентность +8
|
Родий103 J = 1/2- валентность +6
|
Палладий106 J = 0+ валентность +6
|
Серебро107 J = 1/2- валентность +3
|
Кадмий114 J = 0+ валентность +2
|
|

|

|
|

|

|
|
Электронная оболочка атома
рутения валентность +8
|
Электронная оболочка атома родия
валентность +6
|
Электронная оболочка атома
палладия валентность +6
|
Электронная оболочка атома
серебра валентность +3
|
Электронная оболочка атома кадмия
валентность +2
|
У
ядра изотопа палладия 106Pd господствует полная зарядовая
симметрия.
47 Серебро имеет два стабильных изотопа
107Ag(51,35%),
109Ag(48,65%).
Суммарный спин ядра J = 1/2- указывает на отсутствие с
одного торца ядра 5s+
протона. Оставшийся в одиночестве 5s протон обеспечивает валентность +1. На каждом торце ядра по две
пары «залёгших» не валентных 4d протонов. И два 4d и
5s протона не парных,
по одному с каждого торца. Эти два 4d и 5s протона обеспечивают
валентность серебра +3. Спектральный анализ показывает на отсутствие одного 5s электрона и в электронной
оболочке атома серебра.
48 Кадмий имеет семь стабильных
изотопов, самый распространённый 114Cd(28,86%), 106Cd(1,215%),
108Cd(0,875%), 110Cd(12,39%),
111Cd(12,75%), 112Cd(24,08%),
116Cd(7,58%). Достроено седьмое протонное кольцо. С 5s
электронами всё в порядке, все в наличии. Они обеспечивают устойчивую
валентность +2. Десять 4d электронов
создали надёжный фундамент для 5р электронов, заполнив пустующие промежутки
между будущими 5р электронными облаками сферами непроницаемости.

|

|
|
|
|
|
|

|

|
|

|
|
Индий115 J=5/2+3/2+1/2+ = 9/2+ вал.+3
|
Олово 120
J = 0+ валентность .+4
|
Сурьма121 J = 5/2+ валентность .+5
|
Теллур130 J = 0+ валентность .+6
|
Йод J = 5/2+ валентность +7
|
|

|

|

|

|

|
|
Электронная оболочка атома индия
валентность +3
|
Электронная оболочка атома олова
валентность +4
|
Электронная оболочка атома сурьмы
валентность +5
|
Электронная оболочка атома
теллура валентность +6
|
Электронная оболочка атома йода
валентность +7
|
49 Индий имеет
только один стабильный изотоп 113In. Начинается строительство десятого углеродного слоя -
5р протонной оболочки ядра и заполнение первым 5р+ электроном электронной 5р
оболочки. Предельная валентность +3. Суммарный спин ядра изотопа 113In J=5/2+3/2+1/2+ = 9/2+, что
указывает на не симметричное расположение 5s протонов. Один 5s
протон занимает не центрально осевое положение, его спин J=3/2+.
50 Олово имеет десять стабильных изотопов! Олово
рекордсмен по числу устойчивых изотопов, самый распространённый 120Sn(32,97%), 112Sn(0,95%), 114Sn(0,65%), 115Sn(0,34%), 116Sn(14,24%), 117Sn(7,57%), 118Sn(24,01%), 119Sn(8,58%), 122Sn(4,71%), 124Sn(5,98%). В строящемся десятом
углеродном слое появляется второй 5р+ электрон. Предельная
валентность +4.
51. Сурьма имеет два стабильных изотопа
121Sb(57,25%),
123Sb(42,75%).
В десятом углеродном кольце появляется третий
5р+ электрон. Предельная валентность +5.
|

|

|

|
|
Электронограмма. Конденсированная
пленка олова толщиной 320Е на графитовой подложке (увеличение 18 000х)
|
Электронограмма. Та же пленка капельной фазы олова при 4500С
после воздействия правым торсионным полем в течении 8 минут
|
Электронограмма той же фазы после обработки
левым торсионным полем в течении 8 минут
|
52 Теллур имеет семь стабильных изотопов,
самый распространённый 130Те(34,48%),
120Те(0,089%), 122Те(2,46%), 124Те(4,61%), 125Те(6,99%),
126Те(18,71%), 128Те(31,79%). Начинается строительство
одиннадцатого углеродного кольца, появляется
четвёртый 5р- электрон. Предельная валентность
+6.
53 Йод
имеет только один стабильный изотоп
127I. Появляется пятый 5р-протон в одиннадцатом протонном слое. Предельная
валентность +7. Суммарный
спин ядра изотопа 127I J = 5/2+.
|
|
|
n
|
4d
|
n
|
3d
|
2p
|
3s
|
3p
|
3d
|
4p
|
4d
|
5p
|
|
5p
|
4d
|
4p
|
3d
|
3p
|
2s
|
2p
|
3d
|
n
|
4d
|
n
|
|
n
|
4d
|
n
|
4s
|
2p
|
1s
|
3p
|
3d
|
4p
|
4d
|
5p
|
|
5p
|
4d
|
4p
|
3d
|
3p
|
3s
|
2p
|
3d
|
n
|
4d
|
n
|
|
n
|
5s
|
n
|
3d
|
2p
|
2s
|
3p
|
3d
|
4p
|
4d
|
5p
|
|
5p
|
4d
|
4p
|
3d
|
3p
|
1s
|
2p
|
4s
|
n
|
5s
|
n
|
|
|
Электронная оболочка инертного газа ксенона
|
Порядок заполнения протонной оболочки ядра атома ксенона
|
54 Ксенон имеет девять стабильных
изотопов, самый распространённый 132Xe(26,89%), 124Xe(0,096%),
126Xe(0,09%), 128Xe(1,919%),
129Xe(26,44%), 130Xe(21,18%),
131Xe(26,89%), 134Xe(10,44%),
136Xe(8,87%).
Шестой 5р-
электрон завершает строительство одиннадцатого 5р слоя-оболочки инертного
одноатомного газа ксенона. Каждый торец ядра атома ксенона, как и у
криптона, прикрыт разряжённым р-
протонным слоем из трёх р-протонов, вместо обычных шести протонов. Вакантные
места трёх протонов занимают нейтроны. Эти две
нейтронные «гайка» придавливают, стягивают посредством позитронной
прошивки разбегающиеся под действием кулоновских сил протоны. Позитронная
прошивка нейтронов не позволяет связанным р- протонам развернуться в валентное
положение. Позитронная прошивка обеспечивает инертные свойства одноатомного
газа ксенона. У ксенона девять стабильных изотопов! Эффективность нейтронных
«гаек» с позитронной прошивкой налицо.
55 Цезий имеет
только один стабильный изотоп 133Cs.
Пятьдесят пятый 6s+ протон не может занять центрально-осевое положение
из-за вращения ядра атома. Его откидывает центробежная сила на периферию торца
ядра. Об этом говорит суммарный спин ядра атома, равный J = 7/2+. Валентный электрон занимает полярную область
и обеспечивает валентность +1.
56 Барий имеет семь стабильных
изотопов, самый распространённый 138Ва(71,66%), 130Ва(0,101%),
132Ва(0,097%), 134Ва(2,42%), 135Ва(6,59%), 136Ва(7,81%),
137Ва(11,32%). Следующий пятьдесят шестой 6s- протон
исправляет ситуацию. Между торцевыми валентными протонами
устанавливается магнитная связь и они занимают центрально осевое положение.
Суммарный спин J
=0+ говорит об этом. Полярные 6s электроны
обеспечивают предельную валентность +2.
57 Лантан имеет только один стабильный
изотоп 139La(99,911%).
После формирования замкнутой 5р электронной оболочки ксенона начинается
строительство шестой электронной оболочки с поочерёдным появлением двух
валентных 6s
электронных сфер непроницаемости радиуса 6R на оси вращения замкнутой оболочки атома ксенона. Так
появляются одновалентный химический элемент цезий Cs55 и двухвалентный барий Ba56. Далее идёт
традиционное строительство - оболочки лантана La57 как у скандия Sc21 и у иттрия Y39.
У
ядра атома лантана начинается строительство двенадцатого протонного слоя.
Суммарный спин ядра изотопа 139La J = 3/2+1/2-5/2+=7/2+ говорит о том, что на
одном из торцов ядра изотопа один 4d+ протон имеет спин J =5/2+, а 6s+протон имеет спин J =3/2+, т.е. он не занимает осевое положение. Стабильная валентность +3 .
58 Церий имеет четыре стабильных
изотопа, самый распространённый 140Се(88,48%), 136Се(0,193%),
138Се(0,25%), 142Се(11,07%). У ядра атома церия
продолжается строительство двенадцатого протонного слоя. Ещё один валентный
протон обеспечивает церию предельную валентность +4. Спектральный анализ
показывает различные варианты строительства электронной оболочки у церия. Либо (Xe)6s24f2
либо (Xe)6s24f15d1. Это говорит о
том, что сфера непроницаемости четвёртого валентного электрона может занимать
несколько энергетически удобных положений.
Но
фундамент (замкнутая электронная оболочка), на который опираются 5d электронные оболочки,
становится к этому времени рыхлым и неплотным. В электронном слое 4р расстояние
или разрывы между электронными оболочками 4р и 4d достигают 4,2R. Такая же ситуация сложилась и в
боковых 4d электронных
слоях. Разрыв в слое 4р между соседними четырьмя электронными облаками 4р и 4d достигает 4,5R. А расстояние-щель между торцевым осевым 6s электронным облаком и боковым 4d электронным облаком
превышает 4,5R. В эту
щель, начиная с церия58, проваливаются все последующие новые 5d электронные облака. Провалившись на
более низкий энергетический уровень-орбиту, 5d электронное облако увеличивает свою энергию связи с протонами
ядра. Это вызывает увеличение скорости вращения электронного вихря и уменьшение
радиуса его вращения (эффект фигуриста на льду, сводящего раскинутые руки) с
5,5R до 4,5R. Сжавшись до диаметра
размера 9R (радиус 4,5R) 4f электронное облако
занимает позицию между четырьмя электронными облаками, двумя 4р и двумя 4d.
|
|
|
|
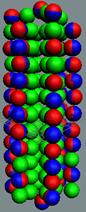
|
|

|
|

|

|

|
|
Ксенон132 J = 0+ валентность 0
|
Цезий133
J = 3/2+1/2-5/2+=7/2+ валентность +1
|
Барий138 J =0+ валентность +2
|
Лантан139
J =
3/2+1/2-5/2+=7/2+ валентность +3
|
Церий140 J = 0+
валентность +4
|
|
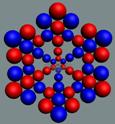
|

|

|

|

|
|
|
|
|
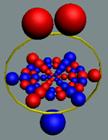
|
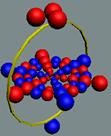
|
|
Электронная оболочка атома ксенона валентность 0
|
Электронная оболочка атома цезия валентность +1
|
Электронная оболочка атома бария валентность
+2
|
Электронная оболочка атома лантана валентность +3
|
Электронная оболочка атома церия валентность +4
|
59 Празеодим имеет только один
стабильный изотоп 141Pr. Если
церий Се58 и в меньшей мере празеодим Pr59 ещё показывают
переменную валентность +3 и +4 и соответственно в спектре его можно обнаружить
линии как 5d тик и 4f,
то у последующих химических элементов, до европия Eu63 включительно, этого нет.
Что произошло?
Торцевые
4f + протоны
начинают спариваться с 5р- протонами, теряя возможность иметь валентный
электрон. У празеодима
залегает навсегда первый
такой протон. Два
других
4f+ протона иногда, при
определённых условиях, присоединяются к нему, обеспечивая переменную
валентность +2, +3, +4.
60 Неодим имеет шесть стабильных
изотопов, самый распространённый 142Nd(27,11%), 143Nd(12,17%), 145Nd(8,30%), 146Nd(17,22%), 148Nd(5,72%), 150Nd(5,60%), и один
долгоживущий изотоп 144Nd(23,83%) с периодом полураспада 5х1015лет. Ёмкость разрывов
между электронными оболочками 4р и 4d ограничена шестью позициями. В этот разрыв падает третье 4f+ электронное облако. Два
торцевых 4f+ протона
спариваются с двумя 5р- протонами, теряя возможность иметь валентный электрон.
Залёгшие 4f + протонные вихри сцепляются с противоположно вращающимися
протонными вихрями. Переменная валентность +3 +4.
61 Прометий не имеет стабильных
изотопов, самый долгоживущий изотоп 145Pm имеет период
полураспада 17,7 года. Радиоактивен.
Если у неодима гарантированно залипают на
экваторе две сферы непроницаемости 4f+, то у прометия надёжно залипает четыре 4f+
электронных вихря, образуя симметричную электронную оболочку. Предельная валентность +3.
62 Самарий имеет шесть стабильных
изотопов, самый распространённый 152Sm(26,63%), 144Sm(3,16%), 148Sm(11,27%), 149Sm(13,82%), 150Sm(7,47%), 154Sm(22,52%), и два
долгоживущих изотопа 147Sm(15,07%), 146Sm. Начинает строиться тринадцатый протонный слой. У самария все шесть 4f+ электронных облака могут залипать на трёх
электронных 5р- жгутах-цугах,
обеспечивая симметричную форму строения электронных оболочек, см. рисунок ниже.
Залипать на 6s- электроне может один валентный 4f+ электрон, обеспечивая
самарию этим валентность +3, или +2, если он выпадает на экватор и становится
инертным.
63 Европий имеет два стабильных изотопа
153Eu(52,18%),
151Eu(47,82%).
У европия семь 4f+
электронов. Шесть из них залипают на 5р- жгутах-цугах, образуя симметричную,
хорошо сбалансированную по зарядом электронную оболочку. Седьмой 4f+ остаётся валентным, он залипает на 6s- электроне. Предельная валентность +3. У s- и p-элементов изменение атомных
радиусов как в периодах, так и в подгруппах более ярко, чем у d- и f-элементов,
поскольку d- и f-электроны внутренние. Уменьшение радиусов у d-
и f-элементов в периодах называется d- и
f-сжатием. Следствием f-сжатия является то, что атомные
радиусы электронных аналогов d-элементов
пятого и шестого периодов практически одинаковы: Zn – Hf 0,160 – 0,159 rатома, нм и Nb – Ta
0,145 – 0,146 rатома, нм.
|
|
|
|

|
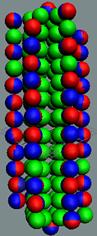
|
|
|
|
|
|
|
|
Празеодим141 J
= 5/2+
|
Неодим142 J = 0+
|
Прометий145 J = 5/2+
|
Самарий152 J = 0+
|
Европий153 J = 5/2+
|
|
|
|
|
|
|
|
Электронная оболочка атома празеодим валентность +4
|
Электронная оболочка атома неодима валентность +4
|
Электронная оболочка атома прометий валентность +3
|
Электронная оболочка атома самария валентность +3
|
Электронная оболочка атома европия валентность +3
|
64 Гадолиний имеет шесть стабильных
изотопов, самый распространённый 158Gd(24,87%),154Gd(2,15%), 155Gd(14,73%), 156Gd(20,47%), 157Gd(15,68%), 160Gd(21,9%) и два долгоживущих
изотопа 152Gd(0,20%),
150Gd. Гадолиний имеет нарушение в порядке заполнения
электронной оболочки, вместо (Хе)6s2 4f8 у гадолиния
появляется один электрон на 5d оболочке и электронная
оболочка выглядит так: (Хе)6s2
4f7 5d1. У гадолиния
уникально высокое сечение захвата 46000барн, а у изотопа 157 150000барн. Он
ферромагнетик более сильный, чем никель и кобальт. Эти уникальные свойства
становятся понятны, если внимательно приглядеться к строению изотопа гадолиния 158Gd и его электронной оболочки. Два его торцевых
валентных 6s протона
возвышаются над торцами с явным дефицитом нейтронов, обеспечивая свободные
магнитные площадки для захвата
пролетающих мимо нейтронов и протонов. На положительном магнитном торце
ядра изотопа 9
вакантных мест для
нуклонов, на отрицательном
магнитном торце 15
вакантных
мест для захвата нуклонов. Два магнитно
несбалансированных седьмой 4f+ и один 5d+ протона с их электронами обеспечивают высокие ферримагнитные
свойства. Постоянная валентность +3 обеспечивается 5d+ протоном и двумя 6s протонами.
Шесть
4f+ протонов занимают
все вакантные места с положительным (+)
спином, на двух торцах ядра атома гадолиния. Остались только шесть вакантных
мест со спином минус (-). Следующий седьмой 4f+ протон занимает вакантное место со спином плюс (+), находится
между 5р- (минус) протонами. Электронная оболочка атома реагирует на начало
заполнения 4f- минус
протонами появлением 5d+
электрона.
Они,
5d+ электроны, не могут
появляться, пока не заполнен хотя бы один разрыв между будущими 6р электронными
облаками.
Но
ёмкость разрывов между электронными оболочками 4р 4d+ ограничена шестью позициями, по три
позиции с каждого торца электронного облака с одинаковым спином +1/2. У
гадолиния64 происходит полное заполнение шести позиций со спином +1/2, седьмой
валентный 5d+ электронный вихрь залип на 6s- электронном вихре,
обеспечивая валентность +3.
Из
графика металлических радиусов видно, что лантаноиды, проявляющие валентность 2+, европий и
иттербий, имеют максимальные радиусы. И у них минимальная
температура
плавления.
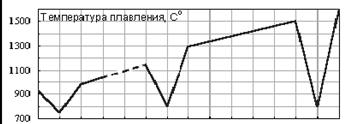
Зависимость
орбитального радиуса (радиуса внешних орбиталей) f-элементов 6-го периода от заряда ядра.
|
|
|
|
|
|
|
|

|

|

|
|
Гадолиний158
J = 0+ вал+3
|
Тербий159 J = 3/2+ вал+4
|
Диспрозий164 J = 0+ вал+4
|
Гольмий165 J = 7/2- вал+3
|
Эрбий166 J = 0+ вал+3
|
|
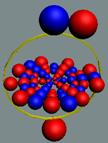
|
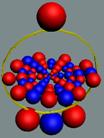
|
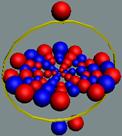
|
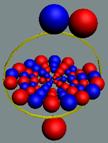
|
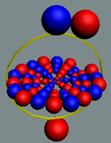
|
|
Электронная оболочка атома
гадолиния валентность +3
|
Электронная оболочка атома тербия
валентность +4
|
Электронная оболочка атома
диспрозия валентность +3
|
Электронная оболочка атома
гольмия валентность +3
|
Электронная оболочка атома эрбия
валентность +3
|
65 Тербий имеет только один стабильный
изотоп 159Tb.
Последующие электронные оболочки химических элементов №№65-70 достраиваются
только электронными вихрями с отрицательным спином -1/2. У тербия переменная
валентность +3, +4, тоже возникает из-за наличия на торцах ядра атома двух 4f
протонов со спинами (+) и (-).
Предельная валентность +4. Стабилизационный нейтрон, вращающийся вокруг 6s протона, придаёт ядру
изотопа тербия 159Tb
суммарный спин J =
3/2+.
66 Диспрозий имеет семь стабильных
изотопов, самый распространённый 164Dy(28,18%), 156Dy(0,0524%), 158Dy(0,0902%), 160Dy(2,294%), 161Dy(18,88%), 162Dy(25,53%), 163Dy(24,97%). Начинается
строительство четырнадцатого протонного слоя. У диспрозия переменная
валентность +3, +4, возникает из-за
наличия на торцах ядра атома двух 4f
протонов со спинами (+) и (-) и двух 6s протонов. Симметрия,
однако!
Из
десяти 4f протонов восемь
протонов симметрично намертво «залегли» и перестали быть валентными.
67 Гольмий имеет только один стабильный
изотоп 165Но. Из одиннадцати 4f
протонов у гольмия десять протонов симметрично намертво
«залегли» и перестали быть валентными. Симметрия, однако! Не симметричный
одиннадцатый 4f+ протон
и два 6s протона
обеспечивают стабильную валентность +3.
68 Эрбий имеет шесть стабильных
изотопов, самый распространённый 166Er(27,07%), 162Er(0,136%), 164Er(1,56%), 167Er(22,94%), 168Er(27,07%), 170Er(14,88%). Закончено
строительство десятого протонного слоя. Двенадцатый, не спаренный 4f+ протон и два 6s протона обеспечивают
стабильную валентность +3.
69 Тулий имеет только один стабильный
изотоп 169Tu.
Как натрий, калий, рубидий, имеет на торце валентный 6s протон со
смещением от центра симметрии ядра (J = 5/2- ). Его уравновешивает тринадцатый 4f + протон. Закончено
строительство одиннадцатого протонного слоя. Протон 4f + иногда западает,
обеспечивая туллию валентность +2, обычная валентность +3.
70 Иттербий имеет семь стабильных
изотопов, самый распространённый 174Yb(31,84%), 168Yb(0,140%), 170Yb(3,03%), 171Yb(14,31%), 172Yb(21,82%), 173Yb(16,13%), 176Yb(12,73%). Появляется последний четырнадцатый 4f – протон. Два 4f протона часто симметрично залипают,
обеспечивая валентность +2, обычная валентность
+3.
71 Лютеции имеет только один стабильный
изотоп 175Lu(97,41%)
и один долгоживущий 176Lu(2,59%) с периодом полураспада 2,4х1010 лет. С
лютеция начинает застраиваться пятнадцатый
протонный 5d слой.
Первый 5d+ протон
появляется со стороны 6s-
протона, обеспечивая совместно с 6s протонами валентность +3. Последний 4f протон навсегда залипает под нейтронными «гайками» и его
электрон более не участвует в валентных связях.
72 Гафний имеет пять стабильных
изотопов, самый распространённый 180Hf(35,22%), 176Hf(5,21%), 177Hf(18,56%), 178Hf(27,1%), 179Hf(13,75%), и два
радиоактивных долгоживущих изотопа 174Hf(0,163%) 182Hf. Два 5d+ протона липнут к 6s- протону с одного торца ядра атома, обеспечивая максимальную валентность +4.
73 Тантал имеет только один стабильный
изотоп 181Та(99,9877%) и
один долгоживущий 180Та(0,0123%). Третий 5d+ протон заполняет все вакантные места
для 5d+ протонов на
одном торце ядра атома тантала. Максимальная валентность +5.
|
|
|
|
|
|

|

|
|
|

|
|
Тулий169
J=1/2+
валентность+3
|
Иттербий 174 J = 0+ валентность+3
|
Лютеций175 J = 7/2- валентность+3
|
Гафний180 J = 0+ валентность+4
|
Тантал181
J=
5/2+3/2+1/2-=7/2+ валентность+5
|
|
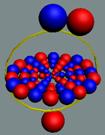
|
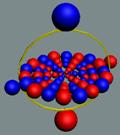
|
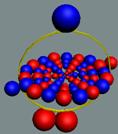
|
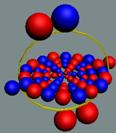
|
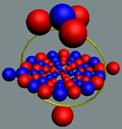
|
|
Электронная оболочка атома тулия валентность+3
|
Электронная оболочка атома иттербия
валентность+2
|
Электронная оболочка атома лютеция валентность+3
|
Электронная оболочка атома гафния валентность +4
|
Электронная оболочка атома тантала валентность+5
|
|
|
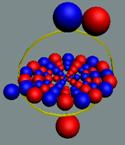
|
|
|
|
|
|
Электронная оболочка атома иттербия
валентность +3
|
|
|
|
74 Вольфрам имеет пять стабильных
изотопов, самый распространённый 184W(30,64%), 180W(0,135%), 182W(26,41%), 183W(14,4%), 186W(28,41%). У вольфрама
начинает застраиваться 5d+
протонами второй торец ядра атома.
Максимальная валентность +6.
75 Рений имеет только один стабильный
изотоп 185Re(37,07%)
и один долгоживущий 187Re(62,93%) с периодом полураспада 1011лет. Рений
строит нейтронную башенку с одного торца ядра. Это позволяет разнести
односторонне вращающиеся протонные вихри в разные плоскости. Для достройки этой
башенки не хватает одного протона, недостающий шестой протон выдёргивается из
предыдущего слоя, поэтому ядро изотопа рений187 имеет J = 5/2+. В валентных связях могут принимать участие
два 6s протона на
торцах ядра и пять 5d протонов, для которых на торцах ядра устроены удобные
нейтронные «балкончики». Протоны 5d могут на своих балкончиках занимать две разные осевые
ориентации, обеспечивая разную валентность рению от +2 до +7. Валентность +1 и +2 обеспечивают 6s протоны, а +3, +4, +5, +6, +7 5d протоны. Если ось вращения протона параллельна оси
вращения ядра атома, то он валентный, если ось вращения протона перпендикулярна оси вращения ядра
атома, то он инертный.
76 Осмий
имеет семь стабильных изотопов, самый распространённый 192Os(41,0%), 184Os(0,018%), 186Os(1,59%), 187Os(1,64%), 188Os(13,3%), 189Os(16,1%), 190Os(26,4%). Как железо, рутений и хассий, осмий может быть в
редком, предельно возможном восьмивалентном состоянии. В этом ему помогает
шестой появившийся 5d-
протон. Имея противоположное вращение, он строит вокруг себя тройку валентных
протонов - два 5d+
протона и один 6s+
протон.
77 Иридий имеет два стабильных изотопа 193Ir(62,7%) и 191Ir(37,3%). Перегруженная валентными торцевыми протонами
система зарядов начинает упрощаться. Три 5d+ протона
навсегда залегают в боковой не валентной позиции.
78 Платина имеет четыре стабильных
изотопа, самый распространённый 195Pt(33,8%), 194Pt(32,9%), 196Pt(25,2%), 198Pt(7,19%) и два долгоживущих
изотопа 190Pt(0,0127%),
и 192Pt(0,78%).
У платины в строении электронной оболочки обнаружены нарушения, исчезает
один 6s электрон, и дополнительно вместо него появляется лишний 5d протон. Из рисунка строения ядра атома
платины видно, что на одном из торцов происходит достраивание двенадцатого
протонного слоя. В этом двенадцатом
протонном слое есть два вакантных места, на которые претендуют один 6s+ и один 5d- протон. Это заставляет менять 6s+ протон своё положение на торце
ядра, из центрально осевого на симметрично оппозитное положение с 5d-.
|
|
|
|
|
|

|
|
|

|

|
|
Вольфрам184
J = 0+ валентность+6
|
Рений187 J = 5/2+ валентность+7
|
Осмий192 J = 0+
валентность+8
|
Иридий193 J = 3/2+ валентность+6
|
Платина195 J = 1/2- валентность+6
|
|
|
|
|
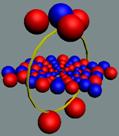
|
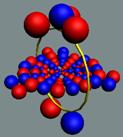
|
|
Электронная оболочка атома вольфрама валентность +6
|
Электронная оболочка атома рения валентность +7
|
Электронная оболочка атома осмия валентность +8
|
Электронная оболочка атома иридия валентность +6
|
Электронная оболочка атома платины валентность +6
|
79 Золото имеет только один стабильный
изотоп 197Au.
Электронная оболочка как и у платины не имеет одного 6s электрона. Из
рисунка строения ядра атома золота видно, что сразу на двух торцах происходит одновременное достраивание
шестнадцатого и семнадцатого протонного слоя.
В этих протонных слоях есть по два вакантных места, на которые
претендуют один 6s+ и
один 5d- протон. Это
заставляет менять 6s+ протон своё положение на торце ядра из центрально осевого на симметрично
оппозитное положение с 5d-.
Эта пара протонов готовятся совместно достроить один 5d слой-оболочку. Здесь 6s протон
выступает как десятый 5d
протон. С другого торца два других 5d+ и 5d-
протона собираются достроить семнадцатую 5d слой-оболочку. На
рисунке ядро изотопа золота 197Au показано в максимально возможном пяти
валентном состоянии. Место отсутствующего центрально осевого 6s - протона
занимает один из двух торцевых стаби-
лизационных
нейтронов с J = 1/2-.
Второй стабилизационный торцевой нейтрон из-за этого получается не сбалансированным
и придаёт всему изотопу золота197 J = 3/2+. С другого торца
вокруг центрально осевого 6s
+ протона бегают два стабилизационных протона, мешая установлению валентных
связей.
|
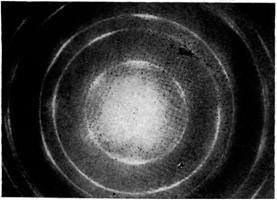
|
|
Электронограмма пленки золота, полученной конденсацией на скол слюды
|
80 Ртуть имеет семь стабильных
изотопов, самый распространённый 202Hg(29,8%), 196Hg(0,146%), 198Hg(10,02%), 199Hg(16,84%), 200Hg(23,13%), 201Hg(13,22%), 204Hg(6,85%). Одновременно
закончено строительство двух нейтронных «гаек» слоёв-оболочек - шестнадцатой и семнадцатой. В валентных
связях участвуют только два 6s
торцевых протона. Максимальная валентность+2. У ртути появляется возможность
разрушения очень устойчивой 6d10-электронной оболочки, что приводит к
возможности существования соединений ртути (+4). Так, кроме малорастворимого Hg2F2
и разлагающегося водой HgF2 существует и HgF4, получаемый
при взаимодействии атомов ртути и смеси неона и фтора при температуре 4оК.
Ртуть
– диамагнетик, как инертные газы, графит ит.д. Диамагнетизм говорит о том, что электронная оболочка у ртути имеет
аналогичное строение, как у инертных газов и графита. Видимо, валентные
торцевые 6s протоны
легко сваливаются на бок, на вакантные места торцевых нейтронов и становятся
инертными. В результате 6s электроны не проявляют энтузиазма к участию в
образовании кристаллической решетки, и при обычных условиях ртуть - жидкость.
81 Таллий имеет два стабильных изотопа
205Tl(70,50%) и 203Tl(29,50%). С
таллия начинают заполняться 6р вакантные места в торцевых «нейтронных гайках».
Предельная валентность +3. Суммарный спин ядра J = 1/2+ говорит о том, что на одном
торце ядра 6s протон не
занимает осевое положение, 6s
и 6р протоны занимают оппозитное положение,
и суммарный спин ядра определяется центрально осевым 6s протоном.
82 Свинец имеет четыре стабильных
изотопа, самый распространённый 208Pb(52,3%), 204Pb(1,48%), 206Pb(23,6%),
207Pb(22,6%). Второй 6р+ протон придаёт предельную валентность
свинцу +4. На обоих торцах ядра «накручены» по две «нейтронные гайки». Это
последний стабильный химический элемент, все последующие химические элементы не
имеют стабильных изотопов.
83 Висмут имеет только один долгоживущий изотоп 209Bi. Природный висмут состоит из одного изотопа 209Bi, который считался самым тяжёлым
из существующих в природе стабильных изотопов. Однако в 2003 году было экспериментально доказано, что он является альфа-радиоактивным с периодом
полураспада 1,9±0,2×1019 лет.
|
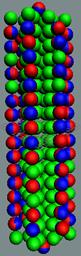
|
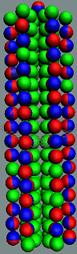
|
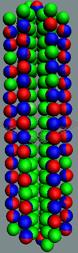
|

|
|

|

|

|

|

|
|
Золото197 J = 3/2+ валентность +5
|
Ртуть202 J = 0+ валентность +2
|
Таллий205 J = 1/2+ валентность +3
|
Свинец208
J = 0+ валентность +4
|
Висмут209 J = 5/2-5/2-1/2+=9/2- валентность +5
|
|
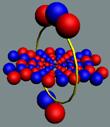
|
|
|
|
|
|
Электронная оболочка атома золота валентность +5
|
Электронная оболочка атома ртути валентность +2
|
Электронная оболочка атома таллия валентность +3
|
Электронная оболочка атома свинца валентность +4
|
Электронная оболочка атома висмута валентность +5
|
|
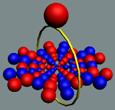
|
|
|
|
|
|
Электронная оболочка атома золота валентность +1
|
|
|
|
|
Таким
образом, все известные изотопы висмута радиоактивны.
Почему?
Силы кулоновского отталкивания достигли такого уровня, что «нейтронные гайки»
на торцах ядра атома уже не способны бесконечно долго сохранять целостность
атома. С одного торца у 209Bi есть уже одна практически готовая альфа
частица, в любой момент готовая сорваться и улететь в вечность.
Немедленному альфа распаду 209Bi мешает только
несогласованность по спину торцевых валентных протонов.
Третий 6р+ протон придаёт предельную валентность висмуту +5.
84 Полоний. Полоний открывает ряд
откровенно радиоактивных нестабильных химических элементов, не имеющих
стабильных изотопов. Самый долгоживущий изотоп
полония 210Ро имеет период полураспада 138,401 дней. При
таком количестве протонов и их спиновой ориентацией природе не удалось создать
стабильный изотоп полония. Хотя если разобраться, то полоний можно представить
как набор из 14 замкнутых углеродных колец (14слоёв х 6протонов = 84протона). Я
уверен, что при большом давлении должна
существовать аллотропическая модификация не радиоактивного полония.
Четвертый 6р- протон придаёт предельную
валентность полонию +6.
85 Астат - радиоактивный химический
элемент, не имеет долгоживущих изотопов. Пятый
6р- протон придаёт предельную валентность астату +7. Два протона придают ядру
изотопа астата211 суммарный спин J = 9/2-.
|
|
|
Электронная оболочка
атома радона
|
86 Радон. Шестой
6р- протон заканчивает строительство замкнутой 6р слоя оболочки. Две
«нейтронные гайки» удерживают ядро атома радона от немедленного распада,
радиоактивный распад идёт медленно. В торцевых «нейтронных слоях – гайках» на
обоих торцах ядра встроены 6s протоны. Чисто нейтронные слои нестабильны и не могут долго
существовать без позитронной прошивки. В последних двух торцевых слоях изотопа
радона 222Rn на шестнадцать нейтронов приходится всего четыре протона.
Четыре позитрона не могут надёжно прошить шестнадцать нейтронов. Период
полураспада самого долгоживущего изотопа 222Rn 3,8229 дней. Формально газ инертный,
фактически имеет валентность +2, +4, +6. Из строения ядра видно, почему радон
химически активен.
|
|
n
|
5d
|
4f
|
n
|
4d
|
n
|
3d
|
2p
|
3s
|
3p
|
3d
|
4p
|
4d
|
5p
|
4f
|
5d
|
6p
|
n
|
|
n
|
6p
|
5d
|
4f
|
5p
|
4d
|
4p
|
3d
|
3p
|
2s
|
2p
|
3d
|
n
|
4d
|
n
|
4f
|
5d
|
n
|
|
|
6s
|
n
|
5d
|
4f
|
n
|
5s
|
n
|
4s
|
2p
|
1s
|
3p
|
3d
|
4p
|
4d
|
5p
|
4f
|
4f
|
6p
|
n
|
|
n
|
6p
|
5d
|
4f
|
5p
|
4d
|
4p
|
3d
|
3p
|
3s
|
2p
|
3d
|
n
|
4d
|
n
|
4f
|
5d
|
n
|
|
|
|
n
|
5d
|
4f
|
n
|
4d
|
n
|
3d
|
2p
|
2s
|
3p
|
3d
|
4p
|
4d
|
5p
|
4f
|
5d
|
6p
|
n
|
|
n
|
6p
|
4f
|
4f
|
5p
|
4d
|
4p
|
3d
|
3p
|
1s
|
2p
|
4s
|
n
|
5s
|
n
|
4f
|
5d
|
n
|
6s
|
|
Порядок заполнения протонной оболочки ядра атома радона
|
87 Франций. Самый долгоживущий изотоп
223Fr имеет
период полураспада 22минуты. Первый 7s протон
валентный торцевой появляется у франция. Валентность +1. Суммарный спин ядра J = 3/2- говорит о не
центрально осевом расположении 7s протона.
|
|
|
|
|
|

|

|

|

|

|
|
Полоний210
J = 0+
валентность +2
|
Астат211
J = 9/2-
валентность +2
|
Радон222 J = 0+ валентность +2
|
Франций223 J = 3/2- валентность +2
|
Радий226 J = 0+ валентность +2
|
|
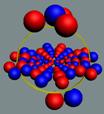
|
|
|
|
|
|
Электронная оболочка атома полония валентность+6
|
Электронная оболочка атома астата валентность+7
|
Электронная оболочка атома радона валентность 0 +2
|
Электронная оболочка атома франция валентность +1
|
Электронная оболочка атома радона валентность +2
|
88 Радий. Самый долгоживущий изотоп 226Ra имеет период полураспада
1600 лет. Второй валентный 7s протон обеспечивает предельную валентность радия +2.
89 Актиний. Самый долгоживущий изотоп 227Ас
имеет период полураспада 21,6 года. Актиний открывает вторую, после лантаноидов, группу химических
элементов, у которых сначала строится электронная 5f оболочка.
Но
сначала вместо 5f электронов у
первых шести актиноидов с №89 по №94
появляется 6d электрон. Почему? Внимательно посмотрим на строение последней 6р
электронной оболочки атома радона. На ней мы видим две оппозитные площадки,
образованные четырьмя сферами непроницаемости электронных
облаков, 5d, f4, 6р, 7s.
Каждое
из двух 5d+ и5d- электронное облако окружает три электронных облака f4, 6р, 7s с противоположным
знаком спина. Поэтому вновь появившееся 6d+ электронное облако, как бильярдный
шар в лузу, неизбежно садится на 5d+ электронное облако, где его нежно с трёх
сторон фиксируют f4-,
6р-, 7s- электронные облака. Если 6d+ электрон становится валентным, то он по
квантованному радиусу 56,25R поднимается из экваториального инертного положения
в полярное валентное.
Предельная
валентность актиния +3. Суммарный спин J = 3/2- у ядра изотопа актиний225 обеспечивается нейтроном.
90 Торий. Самый долгоживущий изотоп 232Th имеет
период полураспада 1,39х1010 лет. Дальше
больше, у тория появляется второй 6d- электрон, который занимает вторую
оппозитную площадку. Предельная валентность тория +4. Суммарный спин J =0+.
91 Протактиний. Самый долгоживущий
изотоп 231Ра имеет период полураспада 3,43х104 лет.
Наконец появилось сразу два 5f
электрона, но исчез один 6d- электрон. Почему
исчез один 6d- электрон?
Ещё
раз внимательно посмотрим на строение
последней 6р электронной оболочки атома радона. Можно ли построить сбалансированную
оболочку из трёх электронных облаков, два из которых 6d.
Нет! А из двух 5f+ электронов и одного 6d+
электрона легко! Получается равносторонний треугольник в экваториальной
плоскости. Предельная валентность+5.
92 Уран имеет три самых долгоживущих изотопа 238U(99,2739%) 235U(0,7205%) 234U(0,0056%). Начинается застройка 5f+
протонами второго торца атома урана или двадцатого протонного слоя. Одно
6d+ электронное облака и три 5f+ электронных облака образуют симметричный в
экваториальной плоскости зарядовый четырёхугольник. Предельная
валентность +6.
Все известные изотопы трансурановых элементов имеют период полураспада значительно меньший, чем
возраст Земли. Поэтому известные трансурановые элементы практически
отсутствуют в природе и получаются искусственно.
Элементы
с Z > 92 в естественных условиях не обнаружены. Более тяжелые элементы,
например, плутоний Pu94, могут нарабатываться в
ядерных реакторах, однако элементы тяжелее фермия Fm100 можно получить только на
ускорителях путем бомбардировок мишени тяжелыми ионами.
93 Нептуний. Самый долгоживущий изотоп 237Np имеет период полураспада 2,2х106лет. Одно 6d+
электронное облако и четыре 5f+
электронных облака образуют в экваториальной плоскости зарядовый несимметричный
пятиугольник. Предельная валентность +7.
Химические
элементы от нептуния Np93 до
лоуренсия Lr103.
синтезируют в ядерных реакциях из урана или некоторых других тяжелых элементов.
Поэтому более корректно считать, что эти элементы были получены, а не открыты.
Все трансурановые элементы радиоактивны.
Химические свойства лёгких трансурановых
актиноидов, получаемых в весовых количествах, изучены более или менее полно; трансфермиевые элементы (Md, No, Lr и так далее)
изучены слабо в связи с трудностью получения и коротким временем жизни.
Кристаллографические исследования, изучение спектров поглощения растворов
солей, магнитных свойств ионов и других свойств показали, что элементы с п. н.
93—103 — аналоги лантаноидов.
|
|
|

|

|
|

|
|

|

|

|
|
Актиний227 J = 3/2- валентность +3
|
Торий232 J = 0+ валентность +4
|
Протактиний231 J = 3/2- валентность +5
|
Уран238 J = 0+ валентность +6
|
Нептуний237 J = 5/2+ валентность +7
|
|
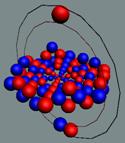
|
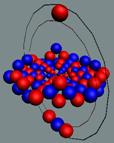
|
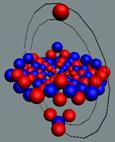
|
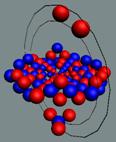
|
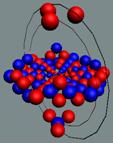
|
|
Электронная оболочка атома актиния валентность+3
|
Электронная оболочка атома тория валентность+4
|
Электронная оболочка атома протактиния валентность+5
|
Электронная оболочка атома урана валентность+6
|
Электронная оболочка атома нептуния валентность+7
|
94 Плутоний, из всех трансурановых
элементов, нашел наибольшее применение. Изотоп плутония 239Pu применяется как взрывчатый компонент
ядерного оружия и как топливо в ядерной энергетике.
Плутоний имеет
валентности +3, +4, +5, +6, редко+2 и +7. Для восьмой валентной электронной
оболочки, не согласованной по спинам, не находится места на полюсе и она
падает на экватор. Где садится на 5d+ электронное облако, наиболее
удобно расположенное. Так появляется симметричный зарядовый шестиугольник на
экваториальной плоскости. Валентность
+7 редкая т. к.
нейтральное ядро получается
несимметричным.
Симметричное строение не валентного ядра обеспечивается при падении на экватор
2, 3, 4 5f+
электронных оболочек. При этом возникают более частые валентные
состояния плутония +6, +5, +4.
Тепло,
производимое благодаря распаду ядер плутония и испусканию ими альфа-частиц,
делает плутоний тёплым на ощупь. Тепловая мощность составляет 1,92 Вт/кг
(теплота обмена веществ у взрослого человека составляет меньшую тепловую
мощность).
Удельное
сопротивление плутония при комнатной температуре очень велико для металла,
150 мкОм·см, и эта особенность усиливается с понижением температуры, что
для металлов не свойственно. Эта тенденция продолжается вплоть до 100о K.
В
отличие от большинства материалов плотность плутония увеличивается при нагревании в диапазоне температур от 310 до 480 °C до температуры плавления на 2,5 %, в то время как у обычных металлов
наблюдается уменьшение плотности при повышении температуры.
Ближе к точке плавления жидкий плутоний имеет очень
высокий показатель поверхностного натяжения и самую высокую вязкость среди других металлов. Температура кипения плутония в пять раз больше температуры
плавления.
95 Америций. Изотоп 241Am с периодом
полураспада 470 лет получается при интенсивной нейтронной бомбардировке
плутония. Америций используют во многих химических исследованиях. В настоящее
время его получают в граммовых количествах. Америций светится в темноте. В спектре америция отсутствует
6d электрон. Почему?
Шесть
электронных оболочек 5f+ рухнули с полюсов на экватор, пристыковавшись
к шести 4f+ электронным оболочкам. В экваториальной
плоскости образовалась очень симметричная шестиугольная зарядовая фигура,
ей 6d
электрон не нужен. Для седьмой 5f+ электронной оболочки не хватило места, и она сиротливо одинокая
прилепилась к 7s-
электронной оболочке, обеспечивая америцию валентность +3. Один боковой нейтрон в последнем
слое-оболочке отсутствует, придавая изотопу америция243 суммарный спин ядра J = 5/2+.
96 Кюрий. 242Cm (период
полураспада 162,5 сут) и 244Cm (период полураспада 17,6 года)
получаются и при нейтронной бомбардировке. В
спектре излучения кюрия опять появляется 6d электрон. Почему?
Потому что в экваториальной плоскости электронной
оболочки только шесть вакантных мест для 5f+
электронов и все они заняты. Седьмой 5f+
электрон прилепился к 7s- электрону.
Новый 6d+ электрон добавляет к стабильной валентности кюрия +3 переменную валентность
+4, а базируется 6d+ электронное облако, как и положено ему, на 5d+ электронном
облаке.
97 Берклий получается при бомбардировке
241Am ионами гелия. Изотоп 249Bk (период полураспада 314 сут) был выделен в
весовых количествах. Элемент может быть получен при длительной бомбардировке
плутония нейтронами.
В
спектре берклия при разных условиях то обнаруживается, то пропадает 6d электрон.
Вновь появляющийся 5f- протон образуют в 5f+ слое первую связанную пару 5f электронов. В случае пропадания 6d+
электрона, появившийся вместо него второй 5f-
электрон, образует вторую связанную пару 5f электронов. Предельная валентность берклия + 4.
Недостающий 6-ой нейтрон в «башенке» придаёт изотопу берклия247 суммарный спин
ядра J = 3/2+.
98 Калифорний впервые получен при
бомбардировке микрограммовых количеств
242Cm
ионами гелия. Калифорний в виде смеси изотопов 249Cf, 250Cf, 251Cf, 252Cf выделен
|
|
|
|

|
|

|
|

|

|

|
|
Плутоний240 J = 0+ валентность +7
|
Америций243 J = 5/2+ валентность +3
|
Кюрий246 J = 0+ валентность +4
|
Берклий247 J = 3/2+ валентность +4
|
Калифорний251 J = 1/2+ валентность +4
|
|
|
|
|
|
|
|
Электронная оболочка атома плутония валентность+7
|
Электронная оболочка атома америция валентность+3
|
Электронная оболочка атома кюрия валентность+4
|
Электронная оболочка атома берклия валентность+4
|
Электронная оболочка атома калифорния валентность+4
|
|
|
|
|
|
|
|
|
Вид с торца
|
|
Вид с торца
|
Вид с торца
|
в
весовых количествах после длительной нейтронной бомбардировки плутония.
В спектре калифорния 6d+ электрона уже нет. Второй 5f- протон
образует вторую в 5f+ слое симметричную
пару протонов с другого торца ядра атома. Нужды в 6d+ электроне уже нет.
Электроны 5f- образуют две связанные пары
5f
электронов в плоскости экватора электронной
оболочки. Два валентных 5f
электронов и два 7s электрона
обеспечивает предельную валентность калифорния +4.
99 Эйнштейний. Наиболее долгоживущий
изотоп 252Es имеет период полураспада 471,7 суток.
На
торцах ядра имеет два не сбалансированных протона каждый со спином J = 5/2+ . Суммарно это придаёт изотопу энштейния252 спин J = 5+. Электронная оболочка
содержит три связанные пары 5f
электронов. Всего в экваториальной оболочке девять инертных 5f электронов. И два 5f электрона валентных,
прилепившихся к двум 7s
электронам, на полюсах атома обеспечивают предельную валентность эйнштейния +4.
Весь
имеющийся запас эйнштейния Es99,
полученный путем облучения в ядерных реакторах к 1995 г., составлял около 10-12 г.
100 Фермий. Долгоживущим изотопом
фермия является 257Fm (период полураспада около 80 суток).
Сразу
два 5f- протона залегают, оставляя только один 5f+ валентный протон,
обеспечивая фермию предельную валентность +3. На одном торце ядра атома
сформировался протонный слой, отделённый от радонового ядра нейтронной
разгрузочной прокладкой. Во внешней электронной оболочке осталась только одна
вакансия для 5f- электрона.
101 Менделевий - 258Md был получен в 1967 при
бомбардировке ничтожных количеств 253Es ионами гелия в 152-сантиметровом
циклотроне в Беркли. Первая идентификация элемента была удивительна, так как в
опытах было получено всего 1 или 2 атома элемента. Оказалось, что он имеет
исключительно большой период полураспада - 2 месяца.
Элементы
до фермия включительно образуются в ядерных реакторах в результате захвата нейтронов и последующего бета-распада.. Трансфермиевые химические элементы,
начиная с менделевия Md101,
образуются только в результате слияния ядер.
В
ядре сформировался второй протонный слой, отделённый от радонового ядра второй
нейтронной разгрузочной прокладкой. Во внешней электронной оболочке не осталось
больше вакансий для 5f- электронов. Она состоит из шести связанных пар 5f электронов. Не связанный
тринадцатый 5f+ электрон и два 7s
электрона обеспечивают предельную валентность менделевия +3.
102 Нобелий получают как в реакции 242Pu + 18O,
так и в реакции 208Pb + 48Ca. В линейном ускорителе тяжелых ионов
(Калифорнийский университет в Беркли) был получен изотоп с массовым числом 254No и периодом полураспада 55
сек.
Аналог иттербия имеет предельную валентность +3. Внешняя
электронная оболочка состоит из шести
связанных пар 5f
электронов и одного двух 5f
электронов, прилепившихся оппозитно на «балконах». В дальнейшем, у Коперниция
они перейдут в разряд 6d электронов.
103 Лоуренсий. Элемент был получен
бомбардировкой калифорния ионами бора в линейном ускорителе тяжелых ионов в
Беркли. Полученный изотоп (либо 258Lr, либо 259Lr) имел
период полураспада 8 с. Это завершающий элемент ряда актиноидов.
Начинается
заполнение двенадцати вакантных
мест десятью 6d
электронами и
|
|
|
|
|
|

|

|

|
|
|
|
Энштейний252 J =(5-) валентность+4
|
Фермий256 J = 0+ валентность+3
|
Менделевий258
J = 0+
валентность+3
|
Нобелий259 J = 2- валентность+3
|
Лоуренсий264 J = 0+ валентность+3
|
|
|
|
|
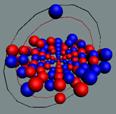
|
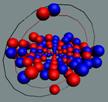
|
|
Электронная оболочка атома валентность+3
|
Электронная оболочка атома валентность+3
|
Электронная оболочка атома валентность+3
|
Электронная оболочка атома валентность+2
|
Электронная оболочка атома валентность+3
|
|
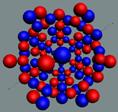
|
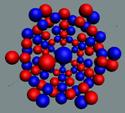
|
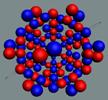
|
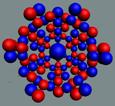
|
|
|
Вид с торца
|
Вид с торца
|
Вид с торца
|
Вид с торца
|
|
двумя
5f
электронами (у Коперниция они перейдут в разряд 6d
электронов). Первый 6d+ протон и связанный с ним электрон располагается со
стороны 7s- протона. Предельная валентность лоуренсия +3.
104 Резерфордий был синтезирован по ядерной реакции
24294Pu + 2210Ne = 259104 Rf + 510n. Период полураспада двух наиболее стабильных из
известных изотопов составляет около 10 и 13 часов (266Rf и 265Rf
соответственно). Синтезировано более 10 нуклидов резерфордия с массовыми
числами 253—262 Резерфордий — первый
трансактиноидный элемент, его предсказанные
химические свойства близки к гафнию.
Появился второй 6d+ протон с той же стороны. Предельная валентность +4.
105 Дубний был синтезирован путём бомбардировки ядер 243Am
ионами 22Ne и в реакции 249Cf+15N→260Db+4n
У дубния появился третий 6d+, больше вакантных мест с
этой стороны торца ядра атома для 6d+
протонов нет. Предельная валентность
дубния +5.
106 Сиборгий
был синтезирован путём бомбардировки ядер 249C ионами 18O. Наиболее устойчивый изотоп 265Sg
имеет период полураспада 21 с.
У
сиборгия появился четвёртый 6d+
протон с другого торца ядра атома.
Предельная валентность сиборгия +6. . Предполагают, что сиборгий
должен быть аналогом вольфрама и моли был
синтезирован путём бомбардировки ядер бдена и его высший фторид
SgF6 будет летуч.
Продвижение
в область элементов тяжелее 106 стало возможным после открытия т.н. реакций «холодного слияния». В этих
реакциях в качестве мишенного материала используются "магические"
ядра стабильных изотопов - 208РЬ (Z=82, N=126) или 209Bi
(Z=83, N=126), которые бомбардируются ионами тяжелее аргона. В процессе слияния высокая энергия связи
нуклонов в "магическом" ядре-мишени приводит к поглощению энергии при
перестройке двух взаимодействующих ядер в тяжёлое ядро суммарной массы, реакция 249Cf+18O→263106+4.
107 Борий был синтезирован в результате реакции «холодного» слияния ядер 209Bi
и 54Cr. Существуют нуклиды бория с массовыми числами. 261Bh (период полураспада Т1/2 11,8 мкс) и 262Bh (период полураспада менее 1 мс). В заметных
количествах Bh не получен, поэтому его свойства не изучены.
У бория появился пятый 6d+ протон. Предельная
валентность бория +7.
108 Хассий был синтезирован в результате бомбардировки свинцовой (208Pb)
мишени пучком ионов железа-58. В результате эксперимента были синтезированы 3
ядра 265Hs. Наиболее
долгоживущий нуклид 265Hs (период полураспада 0,002 с).
У хассия появился шестой 6d- протон, он имеет
противоположный (-) спин. Предельную валентность +8 (как у осмия, рутения,
железа) обеспечивает 6d- протон, он заменяет собой 7s+ протон. Находясь в центре, его окружают два 6d+
протона и один 7s+ протон, в такой позиции они не
тормозят вращение друг друга. Но обычно хассий проявляет валентность +6, потому
что парочка валентных протонов, 6d+ протон и 6d- протон, «залегают на бок» и их
электроны из полярной орбиты опускаются,
залегают на экваторе и становятся химически инертными
|
|
|
|
|
|
|
|

|
|
|
|
Курчатовий265 J = 3/2- валентность+4
|
Дубний268 J = 1/2- валентность+5
|
Сиборгий272 J = 0+
валентность+6
|
Борий273 J=0+ валентность+7
|
Хассий274 J = 0+ валентность+8
|
|
|
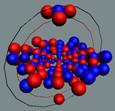
|
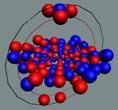
|
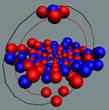
|
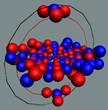
|
|
Электронная оболочка атома
|
Электронная оболочка атома
|
Электронная оболочка атома
|
Электронная оболочка атома
|
Электронная оболочка атома
|
109
Мейтнерий был синтезирован в
результате реакции 209Bi+58Fe → 266Mt+n, при облучении
мишени из 209Bi ускоренными до больших скоростей ионами железа-58:
По продукту a-распада 262Bh идентифицировано три атома мейтнерия.
У мейтнерия появился седьмой 6d- протон и сразу две пары
6d протонов «залегают на бок» и их электроны, упав на экватор электронного
облака, становятся инертными.
Предельную
валентность +5, как у кобальта, мейтнерию обеспечивают оставшиеся на
торцах четыре 6d и два 7s электрона.
110. Дармштадтий был синтезирован в результате ядерных реакций 59Co+209Bi =
267Ds+n, а
также в результате α-распада изотопов коперниция 283Cn и 285Cn. Получено всего
несколько атомов элемента. 267Ds. По оценке, время жизни ядер 267Ds около 1
микросекунды. Немного более устойчивые ядра элемента 269Ds ядер и 273Ds.
У
дармштадтия появился восьмой 6d- протон. И как все благородные металлы в группе
+10 (см. таблицу), у него обнаружены нарушения в строении электронной оболочки,
вместо 6d87s2
мы видим 6d97s1.
Почему? Если взглянуть на рисунок строения ядра
изотопа 278Ds, то мы можем заметить на одном из торцов ядра два
протона с противоположным спином. Это 7s+ протон и 6d-
протон, причём 7s+ протон не занимает центрально
осевую позицию. Это отражается на строении внешней электронной оболочки. У 7s+ и 6d-
электронов облака имеют очень близкие размеры и энергии. Они конкурируют между
собой за центрально осевую позицию. Предельная валентность дармштадтия +6.
111 Рентгений - благородный металл,
химический аналог меди, серебра и золота. Синтезирован в результате реакции 209Bi
+ 64Ni = 272Rg + n - изотоп с периодом
полураспада всего 1,5 мс, по другим ядерным реакциям были получены изотопы 279Rg
(период полураспада 170 мс) и 280Rg (3,6 с). Все изотопы рентгения
распадаются с выделением альфа-частицы. Наиболее долгоживущий изотоп имеет атомную массу 281 и период полураспада ≈20 секунд. Так как
активность благородных металлов снижается с ростом порядкового номера, то
предполагается, что рентгений ещё менее активен, чем золото, и таким образом,
является самым химически инертным металлом. Плотность рентгения может быть
чрезвычайно высокой — он может быть существенно тяжелее, чем осмий.
Появился девятый 6d- протон, и сразу две пары протонов
с противоположным спином «залегают на бок» и перестают быть валентными. Это
понижает предельную валентность рентгения до +3. Последний благородный металл,
и как у всех благородных металлов в группе +1 (см. таблицу), он имеет нарушение
в порядке заполнения электронной оболочки. Вместо 6d87s2 мы видим 6d97s1.
Почему? Если взглянуть на рисунок строения ядра
изотопа рентгения281, то мы можем
заметить на одном из торцов ядра два протона с противоположным спином. Это 7s- протон и 6d+
протон, причём 7s- протон не занимает центрально
осевую позицию. Это отражается на строении внешней электронной оболочки. У 7s- и 6d+
электронов облака имеют очень близкие размеры и энергии. Они конкурируют между
собой за центрально осевую позицию.
112 Коперниций. Два ядра 277Cn
были получены путём реакций ускоренных атомных ядер цинка-70 на мишени из свинца-208 в ускорителе тяжёлых ионов.
У
коперниция появился последний 6d- протон и он в
паре с протоном с противоположным спином
достраивают сразу два протонных слоя. Оставшиеся два 7s протона обеспечивает предельную
валентность коперниция +2. У коперниция, как и у ртути, появляется возможность
разрушения очень устойчивой 6d10 - электронной оболочки, что приводит к
возможности существования соединений коперниция (+4). Внешнему электронному слою недостаёт только
шести 7р электронов.
113 Унунтрий Uut (временное систематическое название).
В результате бомбардировки мишени из америция ионами кальция были синтезированы
изотопы унунпентия Uup: три ядра 288Uup и одно ядро 287Uup.
Все четыре ядра в результате α-распада превратились в изотопы
унунтрия (284Uut и 283Uut). Металл, аналог таллия.
У унунтрия первый 7р+ протон появляется со стороны 7s- протона и добавляет
унунтрию валентность +3.
|
|
|
|
|
|
|
|
|
|

|
|
Мейтнерий273 J = 2/3- валентность+5
|
Дармштадий278 J =
0+ валентность+6
|
Рентгений283 J = 3/2- валентность+3
|
Коперниций284 J =
0+ валентность+2
|
Унунтрий287 J = 1/2+
валентность+3
|
|
|
|
|
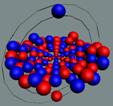
|
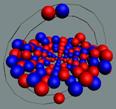
|
|
Электронная оболочка атома
|
Электронная оболочка атома
|
Электронная оболочка атома
|
Электронная оболочка атома
|
Электронная оболочка атома
|
|
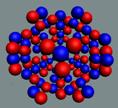
|

|
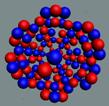
|
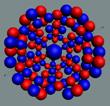
|
|
|
Вид с торца
|
Вид с торца
|
Вид с торца
|
Вид с торца
|
|
114 Флеровий был получен бомбардировкой ядер кюрия Cm ядрами кальция Са, что приводило к
образованию элемента № 116 ливермория Lv,
который в результате быстрого α-распада превращался во флеровий 286Fl.
Флеровий 286Fl также
был получен и
альтернативным
способом - бомбардировкой плутония ядрами кальция. Получено было только около трех атомов флеровия
286Fl
244Pu + 48Ca  289Fl + 3 1n
289Fl + 3 1n
244Pu + 48Ca  288Fl + 4 1n
288Fl + 4 1n
Элемент
распадается, испуская a-частицы, и
превращается в коперниций Cn. Период полураспада составляет около 30 секунд
для 289F и 2-х секунд
для 288F .
Два 7р+
протона и два 7s протона обеспечивает флеровию предельную валентность +4.
115 Унунпентий Uup (временное систематическое название) был получен бомбардировкой мишени из америция Am ионами кальция Ca. Были синтезированы изотопы: три ядра 288Uup
и одно ядро 287Uup.
243Am + 48Ca
=> 288Uup + 3n;
243Am + 48Ca => 287Uup
+ 4n;
Наиболее стабильным является изотоп 288Uup
(период полураспада оценивается в 87 мс).
Третий 7р+ протон унунпентия заполняет все вакантные
места вокруг 7s- протона. Электронные 7р+
облака образуют в экваториальной плоскости равносторонний
треугольник. Предельная валентность унунпентия +5.
116 Ливерморий 292Lv был
получен в результате бомбардировки мишени из кюрия
Cm ионами кальция Са.
Четвёртый 7р- протон с противоположным спином
появляется у ливермория со стороны 7s+ протона. Предельная валентность
ливермория +6.
117 Унунсептий Uus (временное
систематическое название)
был синтезирован бомбардировкой мишени из
берклия 249Bk ионами
кальция 48Са. В результате было зафиксировано шесть ядер нового
элемента — пять 293Uus и одно 294Uus.
Пятый 7р- протон у унунсептия появляется со стороны 7s+ протона.
Последний среди химических элементов галоген. Предельная валентность +7.
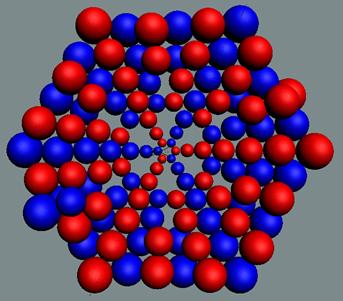
118 Унуноктиум Uuo (временное систематическое название)
- последний в природе формально инертный газ.
Шестой 7р- протон заканчивает строительство замкнутой
7р слоя-оболочки. Этот слой располагается с одного из торцов
ядра атома. Две
нейтронные «гайки» на
торцах
|
|
|
|
|
|
|

|

|

|

|
|
Унунквадиум289 J =
7/2+
|
Унунпентий291 J =
0+
|
Унунгексий293 J =
1-
|
Унунсептий292 J =
0+
|
Унуноктиум294 J = 0+
|
|
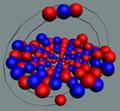
|
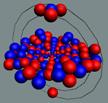
|
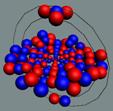
|
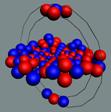
|
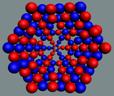
|
|
Электронная оболочка атома
|
Электронная оболочка атома
|
Электронная оболочка атома
|
Электронная оболочка атома
|
Электронная оболочка атома
|
ядра атома уже не могут удержать ядро атома унуноктиума,
в отличии от радона, от немедленного распада. Радиоактивный распад идёт почти
мгновенно. Период полураспада изотопа унуноктиума 294 1,8мс! Миллисекунда
- это одна тысячная секунды.
В последних неполных торцевых нейтронных слоях на
обоих торцах ядра встроены 7s протоны. Торцевые нейтронные слои неполные, так как для
удержания нейтрона нужна позитронная прошивка. Чисто нейтронные слои
нестабильны и не могут долго существовать. Для их стабилизации природа методом стихийной
самоорганизации зарядов в ядре атома включила в каждый нейтронный слой
стабилизационный протон. Во внешней электронной
оболочке идёт полное повторение электронной оболочки радона. Последними падают
с полярной валентной орбиты в инертную экваториальную 7s электроны. Им нет места между 7р, 6d, и 5f
электронными облаками, и
они пристраива-
ются
параллельно рядом с 7р
и 6d
электронными облаками. Надстраивая уже таким
же образом стоящее 6s
облако. Эти 7s электронные облака легко переходят в возбуждённое
состояние и становятся валентными. А за ними подтягиваются ещё две пары 7р
электронов. Предельная
валентность унуноктиума 0, +2, +4, +6.
|
|
n
|
6d
|
5f
|
n
|
n
|
5d
|
4f
|
n
|
4d
|
n
|
3d
|
2p
|
3s
|
3p
|
3d
|
4p
|
4d
|
5p
|
4f
|
5d
|
6p
|
n
|
5f
|
6d
|
7p
|
n
|
|
n
|
7p
|
6d
|
5f
|
n
|
6p
|
5d
|
4f
|
5p
|
4d
|
4p
|
3d
|
3p
|
2s
|
2p
|
3d
|
n
|
4d
|
n
|
4f
|
5d
|
n
|
n
|
5f
|
6d
|
n
|
|
|
7s
|
n
|
6d
|
5f
|
6s
|
n
|
5d
|
4f
|
n
|
5s
|
n
|
4s
|
2p
|
1s
|
3p
|
3d
|
4p
|
4d
|
5p
|
4f
|
4f
|
6p
|
n
|
5f
|
5f
|
7p
|
n
|
|
n
|
7p
|
6d
|
5f
|
n
|
6p
|
5d
|
4f
|
5p
|
4d
|
4p
|
3d
|
3p
|
3s
|
2p
|
3d
|
n
|
4d
|
n
|
4f
|
5d
|
n
|
n
|
5f
|
6d
|
n
|
|
|
|
n
|
6d
|
5f
|
n
|
n
|
5d
|
4f
|
n
|
4d
|
n
|
3d
|
2p
|
2s
|
3p
|
3d
|
4p
|
4d
|
5p
|
4f
|
5d
|
6p
|
n
|
5f
|
6d
|
7p
|
n
|
|
n
|
7p
|
5f
|
5f
|
n
|
6p
|
4f
|
4f
|
5p
|
4d
|
4p
|
3d
|
3p
|
1s
|
2p
|
4s
|
n
|
5s
|
n
|
4f
|
5d
|
n
|
6s
|
5f
|
6d
|
n
|
7s
|
|
Порядок заполнения протонной
оболочки ядра атома унуноктиума 118
Uuo
|
119. Унуне́нниум Uue (временное
систематическое название,
от лат. Ununnenium) или эка-франций
с атомным номером 119, с прогнозированной атомной массой 316 а. е. м. Название «унуненний» используется как временное
в научных статьях о поиске элемента 119. Попытка синтеза элемента 119Uue предпринималась в 1985 году
при помощи бомбардировки мишени из эйнштейния-254 ядрами кальция-48 на ускорителе SuperHILAC в Беркли, Калифорния. Не было идентифицировано ни
одного атома.
 (ни одного атома не было получено)
(ни одного атома не было получено)
Крайне
маловероятно, что эта реакция будет полезной. Для увеличения чувствительности
эксперимента до требуемого уровня необходимо сделать достаточно большую мишень
из 254Es, что является экстремально сложной задачей. В 2013 году
российские учёные из ОИЯИ
планируют начать опыты по синтезу 119-ого элемента.
Предпоследний
химический элемент. Появляется первый 8s+ протон на одном из торцов ядра
атома. Проявляет свойства щелочного металла. Предельная валентность +1.
120 Унбинилий Uub - последний
в периодической таблице химический элемент. Появляется второй 8s- протон на втором торце ядра
атома. Предельная валентность +2. Проявляет свойства щелочноземельного металла. Время полураспада ничтожно мало,
поэтому, до сих пор не синтезирован.
|
|
|
|

|

|
|
Унуне́нниум319 J =
3/2- Валентность+1
|
Унбинилий320 J = 0+ Валентность+2
|
|
|
|
|
Электронная оболочка атома унуне́нниума
|
Электронная оболочка атома унбинилия
|

6. Легенда к периодической системы
протонной структуры
ядер химических элементов
Эволюция
протонной структуры ядер сведена в таблицу, выполненную по типу таблицы периодической системы химических
элементов Менделеева (здесь и далее смотри приложение). Форма таблицы,
обозначение периодов, рядов, групп и подгрупп изменены по прихоти автора (не
стреляйте в пианиста, он играет, как умеет).
Для
наглядности протоны обозначены кружком, цвет кружка обозначает спин протона:
красный (+) плюс, синий (-) минус. Разным цветом выделены s-, p-, d-, f-
элементы.
Стрелками
обозначены валентные протоны, цвет стрелки соответствует спину валентного
протона: красный (+) плюс, синий (-) минус
Нейтроны
обозначены кружком зелёного и белого цвета. Зелёный кружок обозначает нейтрон
наружного слоя. Белый кружок обозначает, либо вакансию нейтрона в наружном
слое, либо торцевое положение нейтрона внутреннего слоя.
Из
таблицы видно, что строение ядер химических элементов с ростом количества
протонов претерпевает несколько качественных изменений.
При
структуре, основным элементом которой является циклическое образование типа
"углеродного кольца", подавляющее большинство ядер имеют либо
эллипсоидную форму, при количестве
протонов до 17, либо цилиндрическую (столбчатую) форму при количестве
протонов от18 до120.
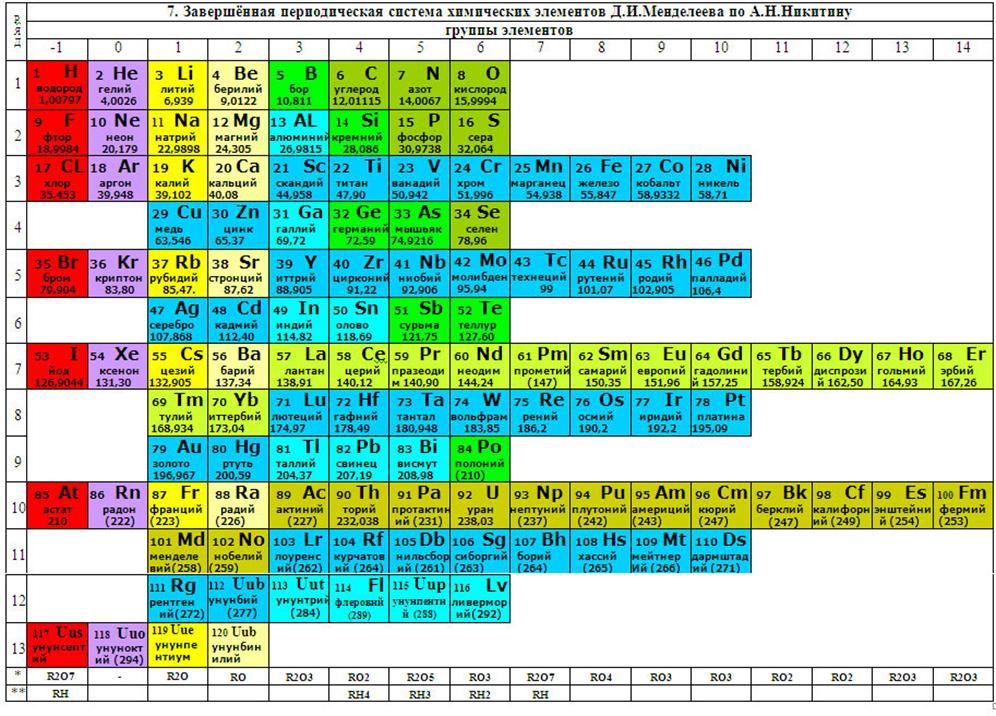
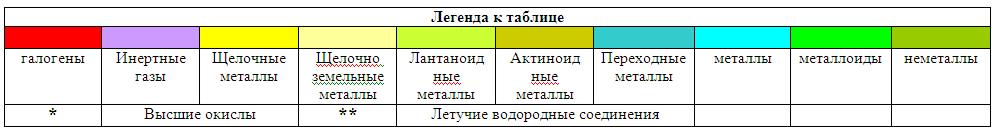
8. Влияние строения атомного ядра
на химические связи
в молекулах
Углеродные
слои, накладываясь последовательно друг
на друга, образуют симметричные фигуры с осью симметрии, совпадающей с осью
вращения ядра атома.
Ядро
атома - практически твердое тело и направление вращения ядра атома
определяет направление вращения всех электронов вокруг ядра атома. Иначе сферы
непроницаемости электронных вихрей при встречных движениях создали бы эффект
взаимного отталкивания.
Ось
вращения ядра атома делит все протоны на инертные и валентные. Валентные
протоны находятся на торцах углеродных колец ядра атома. Валентность ядра атома
определяется тем, сколько протонов ориентировано параллельно оси вращения ядра
атома. К этим валентным протонам примагничиваются валентные электроны.
Инертные
протоны находятся на периферии ядра атома, к ним примагничиваются не валентные
электроны. Химическая инертность этих электронов обеспечивается огромной
угловой скоростью вращения ядра атома и жёстко примагниченными к ним
электронам. На таких огромных скоростях вращения, встретившиеся электроны,
разных атомов неспособны установить надёжное магнитное взаимодействие и
мгновенно погасить инерцию вращение химически реагирующих атомов.
Напротив,
валентные протоны, находящиеся на
торцах ядер атомов и сориентированные
параллельно оси вращения ядра атома, легко устанавливают магнитные связи. Им не
приходится гасить инерцию вращения химически реагирующих атомов. Если спин
валентных протонов у химически
реагирующих атомов совпадает, т.е. совпадает направление вращения валентных
электронов, то синхронизируется их угловая скорость вращения и валентные
электроны прочно примагничиваются друг к другу, образуя цуг. Механический
аналог – два волчка с разнополюсными магнитами на больших скоростях вращения не
примагничиваются друг к другу. В тоже время два волчка с разнополюсными
магнитами на торцах, находясь один над другим, легко примагничиваются, образуя
цуг, им не мешает скорость вращения волчков.
Максимальная
валентность химических элементов ограничивается способностью валентных протонов
разместиться на торце ядра атома. Кулоновские силы отталкивания одноимённых
зарядов протонов минимальны в районе экваторов протонов и максимальны в районе
полюсов.
Максимальное
число валентных протонов, способных разместиться на торце ядра атома, четыре.
Из них одним центральным валентным протоном
должен быть s- протон с отрицательным спином. Окружают его
три d+ протона с положительным
спином. Располагаются d+
протоны под углом 1200 .Вращение s-
протона и d+
протонов,
таким образом, согласованы, они не тормозят друг друга. На втором
торце центрально-осевое место занимает один d- протон с отрицательным спином.
Вокруг него располагаются три валентных протона с положительным спином, из них один
s+ протон и два d+ протона. Вращение протонов, таким образом, согласованы,
они не тормозят друг друга. Такая схема впервые реализуется у ядра атома
железа, затем у рутения, осмия и хассия.
Валентность
+8 - редкая валентность. На двух торцах ядра атома обычно суммарно
размещается от 0 до 7
валентных протонов. Такая схема строения ядер атомов объясняет
разнообразие валентностей у химических элементов и переменную валентность у
одного химического элемента.
Валентность
энергетически не даётся даром. Первые один-два валентных протона, размещённые
по оси вращения ядра атома, у галогенов щелочных и щелочноземельных металлов, а
также у лантаноидов и актиноидов, легко вступают в химические связи. Следующие
3 и особенно 4 валентный протон для активации валентности
требует значи-
тельных
энергетических затрат. Это связано с тем, что необходимо переместить в обычном
состоянии не валентный протон из позиции №1, лежачей боковой, в позицию №2,
осевую валентную. Это возможно только в возбуждённом состоянии.
Особенно стойкие химические элементы,
например углерод, титан, хром, никель, цирконий, кремний, имеют геометрически симметричное строение, их
ядра атомов хорошо сбалансированы, их очень трудно возбудить.
Электроны
в оболочках имеют разные знаки (+1/2 -1/2) спинов, что указывает на различную
ориентацию спинов протонов в ядре атома.
Внешняя электронная структура атома является отражением протонной
структуры его ядра. Периодическое изменение химических свойств элементов хотя и
зависит от строения электронных энергетических уровней, в то же время является
отражением более глубокого периодического изменения протонной структуры ядра
атома.
Нейтроны
незначительно влияют на химические свойства элементов, поэтому их можно смело не
учитывать при построении таблицы. Но нейтроны способны влиять на валентность
химических элементов с большим количеством валентных протонов. Нейтроны создают
площадку, на которой могут развернуться протоны в возбуждённом состоянии. Если
нейтронная площадка у изотопа маленькая, то возбуждённый протон не может
реализовать свои валентные способности. Так, химический элемент со смешанным
изотопным составом будет иметь дробную валентность.
Предназначение
нейтрона другое, он служит шестигранной матрицей-шпилькой, на которой
собираются протоны. В нейтронно-избыточных ядрах нейтроны, группируясь по торцам ядер, подпирают собой
разбегающиеся протоны. Механический эквивалент - это резьбовая шпилька с двумя
стяжными гайками на торцах.
В
этом случае нуклоны сложатся в
столбчатую структуру ядра, состоящую из углеродных колец.
|
9. Строение ядер инертных химических элементов
по Никитину А.Н.
|
|
2гелий
|
|
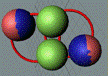
|
|
6 углерод-графит
|
|
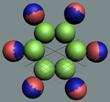
|
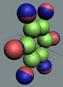
|
|
10неон
|
|
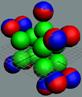
|
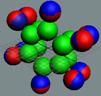
|
|
18аргон
|
|
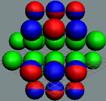
|
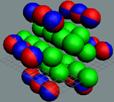
|
|
36криптон
|
|
|
|
|
54ксенон
|
|
|
|
|
86радон
|
|
|
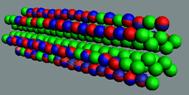
|
|
118унуноктиум
|
|
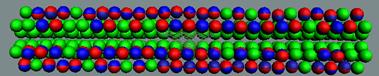
|
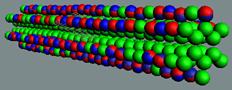
|
|
10.Порядок заполнения -s -p -d -f протонами протонных оболочек 8
инертных ядер химических элементов по Никитину А. Н.
|
|
2
гелий
|
|
|
1s
|
1s
|
|
|
6
углерод-графит
|
|
|
1s
|
|
|
2s
|
|
2p
|
|
1s
|
|
2s
|
|
2p
|
|
10неон
|
|
|
3p
|
1s
|
|
|
2p
|
2s
|
|
1p
|
|
|
3p
|
1s
|
|
2p
|
2s
|
|
1p
|
|
|
18аргон
|
|
|
2p
|
3s
|
3p
|
|
|
3p
|
2s
|
2p
|
|
2p
|
1s
|
3p
|
|
3p
|
3s
|
2p
|
|
2p
|
2s
|
3p
|
|
3p
|
1s
|
2p
|
|
36криптон
|
|
|
n
|
3d
|
2p
|
3s
|
3p
|
3d
|
4p
|
|
|
4p
|
3d
|
3p
|
2s
|
2p
|
3d
|
n
|
|
n
|
4s
|
2p
|
1s
|
3p
|
3d
|
4p
|
|
4p
|
3d
|
3p
|
3s
|
2p
|
3d
|
n
|
|
n
|
3d
|
2p
|
2s
|
3p
|
3d
|
4p
|
|
4p
|
3d
|
3p
|
1s
|
2p
|
4s
|
n
|
|
54ксенон
|
|
|
n
|
4d
|
n
|
3d
|
2p
|
3s
|
3p
|
3d
|
4p
|
4d
|
5p
|
|
|
5p
|
4d
|
4p
|
3d
|
3p
|
2s
|
2p
|
3d
|
n
|
4d
|
n
|
|
n
|
4d
|
n
|
4s
|
2p
|
1s
|
3p
|
3d
|
4p
|
4d
|
5p
|
|
5p
|
4d
|
4p
|
3d
|
3p
|
3s
|
2p
|
3d
|
n
|
4d
|
n
|
|
n
|
5s
|
n
|
3d
|
2p
|
2s
|
3p
|
3d
|
4p
|
4d
|
5p
|
|
5p
|
4d
|
4p
|
3d
|
3p
|
1s
|
2p
|
4s
|
n
|
5s
|
n
|
|
86радон
|
|
|
n
|
n
|
5d
|
4f
|
n
|
4d
|
n
|
3d
|
2p
|
3s
|
3p
|
3d
|
4p
|
4d
|
5p
|
4f
|
5d
|
6p
|
n
|
|
|
n
|
6p
|
5d
|
4f
|
5p
|
4d
|
4p
|
3d
|
3p
|
2s
|
2p
|
3d
|
n
|
4d
|
n
|
4f
|
5d
|
n
|
n
|
|
6s
|
n
|
5d
|
4f
|
n
|
5s
|
n
|
4s
|
2p
|
1s
|
3p
|
3d
|
4p
|
4d
|
5p
|
4f
|
4f
|
6p
|
n
|
|
n
|
6p
|
5d
|
4f
|
5p
|
4d
|
4p
|
3d
|
3p
|
3s
|
2p
|
3d
|
n
|
4d
|
n
|
4f
|
5d
|
n
|
n
|
|
n
|
n
|
5d
|
4f
|
n
|
4d
|
n
|
3d
|
2p
|
2s
|
3p
|
3d
|
4p
|
4d
|
5p
|
4f
|
5d
|
6p
|
n
|
|
n
|
6p
|
4f
|
4f
|
5p
|
4d
|
4p
|
3d
|
3p
|
1s
|
2p
|
4s
|
n
|
5s
|
n
|
4f
|
5d
|
n
|
6s
|
|
118унуноктиум
|
|
n
|
n
|
6d
|
5f
|
n
|
n
|
5d
|
4f
|
n
|
4d
|
n
|
3d
|
2p
|
3s
|
3p
|
3d
|
4p
|
4d
|
5p
|
4f
|
5d
|
6p
|
n
|
5f
|
6d
|
7p
|
n
|
|
n
|
7p
|
6d
|
5f
|
n
|
6p
|
5d
|
4f
|
5p
|
4d
|
4p
|
3d
|
3p
|
2s
|
2p
|
3d
|
n
|
4d
|
n
|
4f
|
5d
|
n
|
n
|
5f
|
6d
|
n
|
n
|
|
7s
|
n
|
6d
|
5f
|
6s
|
n
|
5d
|
4f
|
n
|
5s
|
n
|
4s
|
2p
|
1s
|
3p
|
3d
|
4p
|
4d
|
5p
|
4f
|
4f
|
6p
|
n
|
5f
|
5f
|
7p
|
n
|
|
n
|
7p
|
6d
|
5f
|
n
|
6p
|
5d
|
4f
|
5p
|
4d
|
4p
|
3d
|
3p
|
3s
|
2p
|
3d
|
n
|
4d
|
n
|
4f
|
5d
|
n
|
n
|
5f
|
6d
|
n
|
n
|
|
n
|
n
|
6d
|
5f
|
n
|
n
|
5d
|
4f
|
n
|
4d
|
n
|
3d
|
2p
|
2s
|
3p
|
3d
|
4p
|
4d
|
5p
|
4f
|
5d
|
6p
|
n
|
5f
|
6d
|
7p
|
n
|
|
n
|
7p
|
5f
|
5f
|
n
|
6p
|
4f
|
4f
|
5p
|
4d
|
4p
|
3d
|
3p
|
1s
|
2p
|
4s
|
n
|
5s
|
n
|
4f
|
5d
|
n
|
6s
|
5f
|
6d
|
n
|
7s
|
|
Номер углеродного слоя-оболочки
|
|
27
|
25
|
23
|
21
|
19
|
17
|
15
|
13
|
11
|
9
|
7
|
5
|
3
|
1
|
2
|
4
|
6
|
8
|
10
|
12
|
14
|
16
|
18
|
20
|
22
|
24
|
26
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8s
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3s
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8s
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2s
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7s
|
|
|
|
6s
|
|
|
|
|
5s
|
|
4s
|
|
1s
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3s
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2s
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1s
|
|
4s
|
|
5s
|
|
|
|
|
6s
|
|
|
|
7s
|
|
Порядок заполнения -s протонами, полярностью
+/- , протонных оболочек ядер 120 химических элементов по Никитину А. Н.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2р
|
|
3р
|
|
4р
|
|
5p
|
|
|
6p
|
|
|
|
7p
|
|
|
|
|
7p
|
|
|
|
6p
|
|
|
5p
|
|
4p
|
|
3p
|
|
2p
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2p
|
|
3p
|
|
4p
|
|
5p
|
|
|
6p
|
|
|
|
7p
|
|
|
|
7p
|
|
|
|
6p
|
|
|
5p
|
|
4p
|
|
3p
|
|
2p
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2p
|
|
3p
|
|
4p
|
|
5p
|
|
|
6p
|
|
|
|
7p
|
|
|
|
7p
|
|
|
|
6p
|
|
|
5p
|
|
4р
|
|
3р
|
|
2р
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Порядок заполнения -p протонами, полярностью
+/- , протонных оболочек ядер 120
химических элементов по Никитину А. Н.
|
|
|
|
|
6d
|
|
|
|
5d
|
|
|
4d
|
|
3d
|
|
|
|
3d
|
|
4d
|
|
|
5d
|
|
|
|
6d
|
|
|
|
|
|
|
6d
|
|
|
|
5d
|
|
|
4d
|
|
3d
|
|
|
|
3d
|
|
4d
|
|
|
5d
|
|
|
|
6d
|
|
|
|
|
|
6d
|
|
|
|
5d
|
|
|
5s
|
|
4s
|
|
|
|
3d
|
|
4d
|
|
|
4f
|
|
|
|
5f
|
|
|
|
|
|
6d
|
|
|
|
5d
|
|
|
4d
|
|
3d
|
|
|
|
3d
|
|
4d
|
|
|
5d
|
|
|
|
6d
|
|
|
|
|
|
6d
|
|
|
|
5d
|
|
|
4d
|
|
3d
|
|
|
|
3d
|
|
4d
|
|
|
5d
|
|
|
|
6d
|
|
|
|
|
|
5f
|
|
|
|
4f
|
|
|
4d
|
|
3d
|
|
|
|
4s
|
|
5s
|
|
|
5d
|
|
|
|
6d
|
|
|
|
Порядок заполнения -d протонами, полярностью
+/- , протонных оболочек ядер 120
химических элементов по Никитину А. Н.
|
|
|
|
|
|
5f
|
|
|
|
4f
|
|
|
|
|
|
|
|
|
|
|
|
4f
|
|
|
|
5f
|
|
|
|
|
|
|
|
|
5f
|
|
|
|
4f
|
|
|
|
|
|
|
|
|
|
|
|
4f
|
|
|
|
5f
|
|
|
|
|
|
|
|
5f
|
|
|
|
4f
|
|
|
|
|
|
|
|
|
|
|
|
4f
|
4f
|
|
|
5f
|
5f
|
|
|
|
|
|
|
5f
|
|
|
|
4f
|
|
|
|
|
|
|
|
|
|
|
|
4f
|
|
|
|
5f
|
|
|
|
|
|
|
|
5f
|
|
|
|
4f
|
|
|
|
|
|
|
|
|
|
|
|
4f
|
|
|
|
5f
|
|
|
|
|
|
|
5f
|
5f
|
|
|
4f
|
4f
|
|
|
|
|
|
|
|
|
|
|
|
4f
|
|
|
|
5f
|
|
|
|
|
Порядок заполнения -f протонами, полярностью
+/- , протонных оболочек ядер 120
химических элементов по Никитину А. Н.
|
|
|
-
|
+
|
|
|
-
|
+
|
|
|
-
|
|
-
|
|
|
|
|
|
|
|
|
|
|
|
-
|
|
|
|
-
|
|
|
+
|
|
|
|
+
|
|
|
|
|
|
|
|
|
|
|
|
+
|
|
+
|
|
|
-
|
+
|
|
|
-
|
+
|
|
7s
|
+
|
|
|
6s
|
+
|
|
|
-
|
|
-
|
|
|
|
|
|
|
|
|
|
|
|
-
|
|
|
|
-
|
|
+
|
|
|
|
+
|
|
|
|
|
|
|
|
|
|
|
|
+
|
|
+
|
|
|
-
|
+
|
|
|
-
|
+
|
|
-
|
+
|
|
|
-
|
+
|
|
|
-
|
|
-
|
|
|
|
|
|
|
|
|
|
|
|
-
|
|
|
|
-
|
|
+
|
|
|
|
+
|
|
|
|
|
|
|
|
|
|
|
|
+
|
|
+
|
|
|
-
|
6s
|
|
|
-
|
7s
|
|
Порядок заполнения нейтронами, полярностью +/- , протонных оболочек ядер 120 химических
элементов по Никитину А. Н.
|
|
8s
|
7sn
|
7p
|
6d
|
5f
|
6sn
|
6p
|
4d
|
4f
|
5p
|
4d
|
4p
|
3d
|
23p
|
13s
|
23p
|
3d
|
4p
|
4d
|
5p
|
4f
|
5d
|
6p
|
6sn
|
5f
|
6d
|
7pn
|
7s
|
8s
|
|
Условное название слоя оболочки
|
|
8s
|
-
|
+
|
6d
|
5f
|
-
|
+
|
5d
|
4f
|
-
|
4d
|
-
|
3d
|
2р
|
3s
|
3р
|
3d
|
4р
|
4d
|
5p
|
4f
|
5d
|
6p
|
-
|
5f
|
6d
|
7p
|
-
|
8s
|
|
+
|
7p
|
6d
|
5f
|
+
|
6p
|
5d
|
4f
|
5p
|
4d
|
4p
|
3d
|
3p
|
2s
|
2p
|
3d
|
+
|
4d
|
+
|
4f
|
5d
|
-
|
+
|
5f
|
6d
|
-
|
+
|
|
7s
|
+
|
6d
|
5f
|
6s
|
+
|
5d
|
4f
|
-
|
5s
|
-
|
4s
|
2p
|
1s
|
3p
|
3d
|
4p
|
4d
|
5p
|
4f
|
4f
|
6p
|
-
|
5f
|
5f
|
7p
|
-
|
|
+
|
7p
|
6d
|
5f
|
+
|
6p
|
5d
|
4f
|
5p
|
4d
|
4p
|
3d
|
3p
|
3s
|
2p
|
3d
|
+
|
4d
|
+
|
4f
|
5d
|
-
|
+
|
5f
|
6d
|
-
|
+
|
|
-
|
+
|
6d
|
5f
|
-
|
+
|
5d
|
4f
|
-
|
4d
|
-
|
3d
|
2p
|
2s
|
3p
|
3d
|
4p
|
4d
|
5p
|
4f
|
5d
|
6p
|
-
|
5f
|
6d
|
7p
|
-
|
|
+
|
7p
|
5f
|
5f
|
+
|
6p
|
4f
|
4f
|
5p
|
4d
|
4р
|
3d
|
3р
|
1s
|
2р
|
4s
|
+
|
5s
|
+
|
4f
|
5d
|
-
|
6s
|
5f
|
6d
|
-
|
7s
|
|
Сводная таблица
последовательности заполнения протонами и нейтронами , протонных оболочек ядер 120 химических элементов
по Никитину А. Н.
|
1. Влияние
строения атомного ядра
на виды
радиоактивного распада
Столбчатая модель из углеродных колец
объясняет не только причину существования ядер-изомеров, но и множество тонких
эффектов.
Например,
деление ядер по разным схемам распада или необычный результат эксперимента:
"Если обстреливать ядра атомов частицами с высокой кинетической энергией,
то продукты распада могут иметь и высокую, и низкую кинетическую энергию. Если
же обстреливать ядра частицами с низкой кинетической энергией, то из ядра
вылетают только частицы с высокой кинетической энергией."
Столбчатая
модель наглядно объясняет, что частица с малой кинетической энергией имеет шанс
отколоть только быстро движущийся конец ядра-столбика. При этом выбитая частица
продолжает двигаться с большой кинетической энергией.
У большинства четных ядер нулевой спин. А у других нечётных ядер
спин невысокий. Деление
именно тяжелых ядер вызвано не только их большим электрическим зарядом, но и
большими центробежными силами, возникающими от удара нейтронов.
12. Квантование геометрических размеров
электронных оболочек
120 химических элементов
В
электронной оболочке атома все размеры проквантованы. Бросается в глаза прямая
связь между диаметром электронного облака и радиусом-расстоянием его от ядра
(см. рисунок), это не может быть простым совпадением. Всё здесь имеет
физический смысл.
Физический
смысл главного квантового числа - это отношение расстояния от ядра до
геометрического центра сферы непроницаемости, делённое на радиус сферы
непроницаемости.
Физический
смысл электронного облака - это сфера
непроницаемости электронного вихря. Электронный вихрь имеет несколько
физических параметров. Диаметр вращения и амплитуда колебаний электронного
вихря и образуют эту сферу непроницаемости.
Электронный
вихрь, вращаясь по орбите, создает электрический ток. Известно, что при
движении ток в кольцевом проводнике вызывает магнитное поле. Поэтому
электронный вихрь, вращаясь по орбите, образует маленький прямой магнит,
расположенный вдоль оси вращения.
|
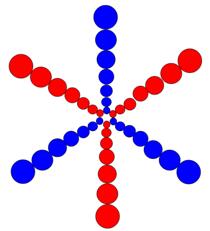
|
Сферы непроницаемости – маленькие прямые магнитики, ориентированные
каждый на свой протон. В каждом углеродном кольце шесть протонов, три с северным
магнитным полюсом наружу и три с южным магнитным полюсом наружу. Эти прямые
электронные магнитики образуют жгуты-цуги электронов. Шесть электронных
вихрей сфер непроницаемости одного диаметра, находящиеся на одном
расстоянии-радиусе, образуют слой-оболочку. Таких слоёв-оболочек может быть
максимум семь. Назовём их исторически традиционно 1р, 2р, 3р, 4р, 5р, 6р, 7р.
Причём 1р оболочка сложена из 1s, 2s,
3s электронов
|
|
Семь 1р, 2р, 3р, 4р, 5р, 6р, 7р слоёв-оболочек
|
|
|
|
Электронная оболочка
первого углеродного кольца
|
Первая
слой-оболочка 1р образуется у углерода в форме графита. Сферы непроницаемости электронных
вихрей вращаются в разные стороны, эта согласованность вращений позволяет им не
притормаживать вращение друг друга. Красный цвет сферы непроницаемости спин +,
синий цвет спин -. Здесь все электроны имеют равную энергию и находятся на
равном удалении от ядра атома. Размеры смотрите в таблице квантования геометрических размеров электронных
оболочек.
Второй
слой-оболочка 2р образуется у инертного
газа неона. Но у неона возможны два способа построения электронной оболочки. По
второму способу все электроны имеют равную энергию и находятся на равном
удалении от ядра атома. У второго способа построения есть один недостаток. При
вращении атома неона вокруг оси симметрии четыре электронных сферы
непроницаемости неизбежно отбрасываются на периферию на экватор атома. Размеры
смотрите в таблице квантования геометрических
размеров электронных оболочек.
|

|

|
|
Первый способ построения электронной оболочки неона
|
Второй способ построения электронной оболочки неона
|
|
|
|
Электронная оболочка
аргона
|
В
атоме возможно построение жгута-цуга не более чем из семи электронных вихрей. Первые три (1р, 2р, 3р) слоя
образуют устойчивую оболочку инертного газа аргона (см. рис.). Если 3р
электронное облако свалится на бок, оно получит мягкий касательный удар от
вращающегося в ту же сторону, с той же скоростью, соседнего электронного
облака. И положение этого электронного облака будет восстановлено. Размеры
смотрите в таблице квантования геометрических
размеров электронных оболочек.
Но уже при строительстве четвёртого (4р) слоя
электронный жгут-цуг из сфер непроницаемостей становится неустойчивым, и
четвёртые слои сфер непроницаемости постоянно сваливаются со своего места в
бок. Эти боковые электронные облака, постоянно сваливающиеся на бок, называются
3d электронами, их
10штук, два вакантных места занимает пара 4s электронов. Эти дополнительные двенадцать электронов, заполняя
широкую щель между 4р электронными облаками, делают конфигурацию из 36+12+6
электронов очень устойчивой. Теперь 4р электронным сферам непроницаемости
некуда сваливаться. Только после того, как фундамент укреплён 3d электронами, появляются
4р электроны.
Последнюю
лепту вносят два 4s
электрона, так появляется очень устойчивое химически инертное электронное
облако криптона. Размеры смотрите в таблице квантования
геометрических размеров электронных оболочек.
Так
образуется устойчивая электронная оболочка инертного газа криптона, в ней нет 4s электронов.
Диаметр 3d электронного
облака равен
|
|
|
Электронная оболочка
криптона
|
(4R + 5R)/2= 4,5R
Оно занимает промежуточное положение между
диаметром 3р электронного облака, равного 4R и диаметром 4р электронного облака, равного 5R. Расстояние-радиус от ядра, на котором
находится 3d
электронное облако, равно его квадрату радиуса
4,5
х 4,5 = 20,25R
Размер
4,5R -
это побочное квантовое число для 3d электронного облака. См. таблицу квантования геометрических размеров электронных оболочек
Следующий
пятый (5р) слой-оболочка начинает строиться
подобно четвёртому (4р) слою-оболочке с заполнения нового бокового 4d слоя. После заполнения
десяти 4d электронов появляются 5р электроны.
Завершают строительство 5р электронного слоя упавшие с полярной орбиты на
экваториальную орбиту два 5s электрона. Диаметр 4d электронного облака равен
(5R + 6R)/2= 5,5R
Оно
занимает промежуточное положение между диаметром 4р электронного облака, равного 5R и
диаметром 5р электронного облака, равного 6R. Расстояние-радиус от ядра, на котором находится 4d электронное облако, равно
его квадрату радиусу. Размер 5,5R - это побочное квантовое число для 4d электронного облака. См. таблицу квантования геометрических размеров электронных
оболочек.
|

|
|
Электронная оболочка
ксенона
|
5,5
х 5,5 = 30,25R
Электронные
облака 3d и 4d образуют побочные
электронные жгуты-цуги. Вращения их хорошо согласованы с соседними сферами
непроницаемости.
Всё,
ещё одна 5р слой-оболочка закончена, так появляется нейтральный газ ксенон с 54
симметричными электронными сферами недоступности (см рис. электронная оболочка
ксенона). Размеры смотрите в таблице квантования геометрических размеров электронных
оболочек.
Но
размера 4d электронных облаков у ксенона, едва хватает,
чтобы между ними не смогло втиснуться ещё одно электронное облако. Посмотрите,
какая щель между 4d электронными облаками
на рисунке электронной оболочки ксенона.
Дальнейшее строительство электронных слоёв
оболочек традиционным способом уже невозможно. Между новыми 5d электронными облаками можно легко
втиснуть ещё одно электронное облако. Зачем расти вверх, если можно расти
вширь. См. рис. Электронная оболочка радона без 12 4f и без двух
6s электронов.
На рисунке хорошо видно, какая огромная потенциальная яма расположена между
двумя 6р электронными сферами непроницаемости. Пока эти шесть ям не заполнятся
до краёв появление 6р сфер непроницаемости невозможно.
|
|
|
|
Электронная оболочка радона без 12 4f и
без двух 6s
электронов
|
Электронная оболочка радона без 4f,
без 5d, и без 6s электронов
|
Новые
4f электронные облака при строительстве шестого
(6р) слоя-оболочки не сразу появляются в
свободных промежутках между 4d
электронными облаками.
Вопрос,
а почему не сразу появляются 4f
электронные облака? Посмотрим на рисунок
«Электронная оболочка радона без 4f, без 5d, и без 6s
электронов». Хорошо видно, что 4f электронному облаку
невозможно сразу скатиться в промежуток между 4d электронными облаками. Мешает
несогласованность вращений этих 4d электронных облаков.
Одно облако имеет спин + (красное),
другое облако имеет спин – (синее).
Для
появления 4f
электронного облака требуется либо сразу пара 4f электронных облаков с
противоположными спинами, либо опора-костыль в виде 5d электронного облака. Только оперившись
на него, 4f
электронное облако может существовать. Такие опоры-костыли появляются у лантана
и церия. Проверим по электронным формулам химических элементов, стоящих после
бария:
57
лантан 6s2 5d1
58 церий 6s2 4f1 5d1 или 6s2 4f2
У
лантана только 5d
электронное облако, так как 4f электронное облако в одиночку появляться не может. Церий может показывать сразу два варианта строения электронной оболочки -
и первый и второй. Следующий элемент празеодим чётко показывает три 4f
электронов и имеет переменную валентность +3, +4, значит, на экваторе
электронной оболочки у него могут находиться один или два не валентных 4f электрона.
59
празеодим 6s2 4f3
Неодим
показывает устойчивую валентность +3, значит, из четырёх 4f
электронов только один валентный, а три электрона симметрично, под углом 1200,
залегли на экваторе электронной оболочки, образовав равносторонний треугольник.
Этой фигуре уже не требуются подпорки, она симметрична. Следующий раз, когда
выскакивает 5d
электрон, у гадолиния должен был, появляется 4f-
электрон с отрицательным спином. При этом образуется не симметричная
фигура из сфер непроницаемости. Но
вместо него появляется 5d-
электрон с отрицательным спином. Тринадцатый и четырнадцатый 4f
электроны замещают места двух 6s электронов, они дополняют число
5d электронов
до
двенадцати. Энергия 5d и 4f электронов практически неразличима.
Электронные
4f облака, как и 3d и 4d облака,
образуют побочные электронные жгуты-цуги. Вращения их хорошо согласованы с
соседними сферами непроницаемости.
Диаметр
4f электронного облака занимает среднее значение
между 5р электронным облаком и 5d
электронным облаком. Диаметр 4f электронного облака равен
|
|
|
Электронная оболочка
атома радона
|
(6R + 6,5R)/2=
6,25R
Расстояние-радиус
от ядра, на котором находится 4f электронное облако, равно его квадрату радиуса.
Размер - 6,25 это побочное квантовое число для
4f электронного облака. См. таблицу квантования геометрических размеров электронных
оболочек.
6,25
х 6,25 = 39,0625R
После
заполнения 5d и 6р
вакантных мест строительство электронной 6р слой-оболочки закончено. Казалось
бы, всё, можно завершать (6р) слой-оболочку новым инертным газом! Но не тут-то
было!
Оказывается,
начиная с ядра висмута (83 протона) невозможно собрать стабильный изотоп. То,
что все изотопы висмута слаборадиоактивные с периодом полураспада основного
природного изотопа висмута 209Bi более 2·1018 лет, было
установлено только в 2004 году.
Дальше
хуже, самый долгоживущий изотоп полония
(84 протона) 209Po имеет период полураспада 102 года. Астат,
имеющий 85 протонов, изотоп 210At - самый стабильный – 8,1 часа!
Всё, таблицу Менделеева можно закрывать!!!
Но
самоорганизация зарядов в ядре нашла выход! Силам кулоновского отталкивания противопоставлены
вихревые стягивающие силы нейтронов. На каждом торце ядер изотопов инертного
газа радона (86 протонов) появляется
слой нейтронов, удерживающий протоны от разбегания. Вместо слоя из 6 протонов
появляется слой из пяти нейтронов и одного протона на каждом торце ядра атома.
Чисто нейтронный слой нестабилен, продолжительность жизни нейтрона примерно 13
минут. А вот в связке с одним протоном он может быть стабильным. Вот к этим
двум стабилизирующим протонам из нейтронного стабилизирующего слоя и крепятся
два 6s электронных
облака. Вся эта хитрая конструкция
прижата с обоих торцов ещё несколькими стабилизационными нейтронами.
Так
появляется новая (6р) слой-оболочка у инертного газа радона. Для её
строительства требуется 30 электронов (14шт. -
4f ,
10шт. - 5d, 6шт. - 6р электронов). Больше не требуется!
После
заполнения 5d и 6р
вакантных мест строительство электронной 6р слой-оболочки закончено. Но куда
девать оставшуюся пару 6s электронов? Они,
оппозитно примостились между 5d и 4f
электронными сферами непроницаемости, образуя (если смотреть в экватор
электронной оболочки) третий ряд электронных облаков (см. рис.).
Их несколько «выдающееся положение» над
экватором делает атом радона химически активным. Радон формально считается
инертным газом, но он легко вступает в химические связи
и имеет валентность
+2, +4, +6.
Валентность +2 обеспечивают
6s
электроны,
а валентность +4, +6 обеспечивают 4f
электроны. Сферы непроницаемости 4f
электронов тоже лежат не в плоскости экватора атома радона, для этого им там не
хватает места
Строительство последнего 7р
слоя-оболочки протекает проторённым радоном путём. Седьмой и последний 7р
слой-оболочка начинает строиться подобно
шестому 6р слою-оболочке с заполнения нового 5f
слоя. После заполнения четырнадцати 5f
электронов появляются десять 6d
электронов. Так, суммарно 24 электрона
(14- 5f и 10-
6d ) подготавливают
фундамент для шести 7р электронных облаков.
Завершают
строительство 7р электронного слоя упавшие с полярной орбиты на экваториальную
орбиту два 7s электрона. Без 7s электронов никак, вся конструкция
мгновенно разваливается. А 7s
протоны входят в состав ещё двух нейтронных торцевых стабилизационных колец. И два 7s электронных облака прилепляются к двум
6s электронным облакам,
образуя новую пару 6s 7s цугов.
Электронные
4f и 5f
облака, как и 3d, 4d и 5d облака, образуют побочные электронные
жгуты-цуги. Вращения их хорошо согласованы с соседними сферами непроницаемости.
Диаметр
5f электронного облака занимает среднее значение
между 6р электронным облаком и 6d
электронным облаком. Диаметр 5f электронного облака равен
(7R + 7,5R)/2=7,25R
Расстояние-радиус
от ядра, на котором находится 5f электронное облако, равно его квадрату радиуса.
Размер 7,25 - это побочное квантовое число для
5f электронного облака. См. таблицу квантования геометрических размеров электронных
оболочек
.
7,25
х 7,25 = 52,5625R
Диаметр
6d электронного облака
занимает среднее значение между 6р и 7р
электронными облаками. Диаметр 6d
электронного облака равен
(7R + 8R)/2=7,5R
Расстояние-радиус
от ядра, на котором находится 6d
электронное облако, равно его квадрату радиуса
7,5R х 7,5R = 56,25R
См.
таблицу квантования геометрических размеров
электронных оболочек.
Для
появления не валентного 5f
электронного облака, расположенного на экваторе, требуется опора в виде 6d электронного облака. Только
оперевшись на него, 5f
электронное облако может существовать. Проверим по электронным формулам
химических элементов, стоящих после радия. Рядом запишем их предельную
валентность.
89
актиний 7s2 6d1
валентность +3
90
торий 7s2 6d2
валентность +4
91
протактиний 7s2 5f2 6d1
валентность +5
92
уран 7s26 5f3 d61
валентность +6
93
нептуний 7s2 5f4 6d1 валентность +7
94
плутоний 7s2 5f5 6d1
или 7s2 5f6 валентность +7
Как мы видим
– все пять 5f
электронов участвуют в
химических связях. Если
химическое
вещество проявляет не предельную валентность, а более низкую, то на
экваториальную плоскость сначала падает 6d электронное облако, а уже к нему цепляются 5f
электроны. Плутоний может иметь разное строение электронной оболочки. При шести
5f электронах
конфигурация электронных облаков получается симметричной и довольно устойчивой
и 6d электрон может и
не появиться.
Так
заканчивается строительство электронной оболочки последнего формально инертного
118 химического элемента.
|
|
|
Электронная оболочка атома унуноктиума
|
У
изотопа 294Uuo период
полураспада 1,8мс
Предпоследний
химический элемент Uue. Появляется первый 8s+ электрон на одном из торцов
ядра атома. Предельная валентность +1. Время полураспада ничтожно мало, поэтому
он до сих пор не синтезирован.
|

|

|
|
Электронная оболочка атома Uue
|
Электронная оболочка атома Uub
|
Последний химический элемент Uub. Появляется
второй 8s- электрон
на втором торце ядра атома. Предельная валентность +2. Проявляет свойства
щелочноземельного металла. Время
полураспада ничтожно мало, поэтому Uub до сих пор не синтезирован. Размеры смотрите в
таблице квантования геометрических размеров электронных
оболочек.
Это
предел таблицы химических элементов.
Количество химических элементов не бесконечно. Начиная со 121 элемента происходит
сворачивание величины заряда ядра атома.
А именно: ядро каждого последующего атома поглощает по паре электронов
из самой внутренней области электронного облака этого атома. Сверхтяжёлые ядра
атомов поглощают электронные оболочки или электронные слои целиком с ядра атома
121 сверхтяжёлой массы. И поиск «острова
стабильности» сверхтяжёлых ядер атомов
абсолютно бесполезен.
Эти
модели будут служить инструментом в понимании структуры реального ядра,
визуально наглядно поясняя понятия квантовой механики. Реальное ядро, без сомнения, должно
существовать на принципах квантовой
механики.
|
13. Квантование
геометрических размеров электронных оболочек 120 химических элементов по
Никитину А.Н.
|
|
Глав
ное
кван
товое
число
п
|
Электр
онная
оболоч ка
|
Число
электронов
шт
|
Перехо-
ды
элек
тронов
с
оболо
чки
на оболоч
ку
|
Радиус
орбиты электронной сферы не
проница
емости
|
Слой-
оболочка
№
|
Радиус
орбиты электрона в
сфере
непроницаемо
|
Диаметр
электрон
ной
сферы не
проницаемости
|
Диаметр
инертной заполненной элект
ронной
об
олочки-
слоя
|
Диаметр
сфе ры неп
роницаемос
ти
атома
|
Длина
орбиты е в облаке
L
|
Частота
вращения
Электрона
Ν
Гц.
|
Длина
волны электрона
λ
м.
|
Период
вращения
электрона
Т
сек.
|
|
1
|
1s
|
2
|
-2(1р)
|
1R
|
1
|
1R
|
2R
|
4R
|
4R
|
2πR
|
ν
|
λ
|
Т
|
|
2
|
2s(1p)
|
2
|
+4(1s,3s)
|
4R
|
1
|
2R
|
4R
|
4R
|
12R
|
4πR
|
ν
/4
|
2λ
|
4Т
|
|
2p
|
6
|
|
9R
|
2
|
3R
|
6R
|
12R
|
24R
|
6πR
|
ν
/9
|
3λ
|
9Т
|
|
3
|
3s
|
2
|
-2(1р)
|
9R
|
1
|
4R
|
8R
|
24R
|
40R
|
8πR
|
ν/16
|
4λ
|
16Т
|
|
3p
|
6
|
|
16R
|
3
|
4R
|
8R
|
24R
|
40R
|
8πR
|
ν/16
|
4λ
|
16Т
|
|
3d
|
10
|
+2(4s)
|
20,25R
|
4
|
4,5R
|
9R
|
|
|
9πR
|
ν/20,25
|
4,5λ
|
20,25Т
|
|
4
|
4s
|
2
|
-2(3d)
|
25R
|
4
|
5R
|
10R
|
40R
|
60R
|
10πR
|
ν/25
|
5λ
|
25Т
|
|
4p
|
6
|
|
25R
|
4
|
5R
|
10R
|
60R
|
60R
|
10πR
|
ν
/25
|
5λ
|
25Т
|
|
4d
|
10
|
+2(5s)
|
30,25R
|
5
|
5,5R
|
11R
|
|
|
11πR
|
ν
/30,25
|
5,5λ
|
30,25Т
|
|
4f
|
14
|
-2(5d)
|
39,0625R
|
6
|
6,25R
|
12,5R
|
|
|
12,5πR
|
ν/39,0625
|
6,25λ
|
39,0625Т
|
|
5
|
5s
|
2
|
-2(4d)
|
36R
|
5
|
6R
|
12R
|
60R
|
84R
|
12πR
|
ν
/36
|
6λ
|
36Т
|
|
5p
|
6
|
|
36R
|
5
|
6R
|
12R
|
84R
|
84R
|
12πR
|
ν
/36
|
6λ
|
36Т
|
|
5d
|
10
|
+2(4f)
|
42,25R
|
6
|
6,5R
|
13R
|
|
|
13πR
|
ν/42,25
|
6,5λ
|
42,25Т
|
|
5f
|
14
|
-2(6d)
|
52,5625R
|
7
|
7,25R
|
14,5R
|
|
|
14,5πR
|
ν/52,5625
|
7,25λ
|
52,5625Т
|
|
6
|
6s
|
2
|
|
49R
|
6
|
7R
|
14R
|
84R
|
112R
|
14πR
|
ν/49
|
7λ
|
49Т
|
|
6p
|
6
|
|
49R
|
6
|
7R
|
14R
|
112R
|
112R
|
14πR
|
ν/49
|
7λ
|
49Т
|
|
6d
|
10
|
+2(5f)
|
56,25R
|
7
|
7,5R
|
15R
|
|
|
15πR
|
ν
/56,25
|
7,5λ
|
56,25Т
|
|
7
|
7s
|
2
|
|
64R
|
7
|
8R
|
16R
|
112R
|
144R
|
16πR
|
ν
/64
|
8λ
|
64Т
|
|
7p
|
6
|
|
64R
|
7
|
8R
|
16R
|
144R
|
144R
|
16πR
|
ν
/64
|
8λ
|
64Т
|
|
8
|
8s
|
2
|
|
81R
|
торец
|
9R
|
18R
|
144R
|
180R
|
18πR
|
ν
/81
|
9λ
|
81Т
|
|
Где R-радиус
в метрах первой Боровской орбиты, для каждого из 120 химических элементов он
имеет своё значение.
|
|
Где Т-период вращения в секундах на первой Боровской
орбите, для каждого из 120 химических элементов он имеет своё значение.
|
|
Где ν-частота
вращения электрона в герцах на первой Боровской орбите, для каждого из 120
химических элементов имеет своё значение.
|
|
Где λ- длина волны электрона в метрах на первой
Боровской орбиты, для каждого из 120 химических элементов имеет своё
значение.
|
14.
Кустарно-механический
аналог поведения электрона
в оболочке
атома водорода
Представим,
что ось вращения механического гироскопа (электронного вихря) подвешена к опоре
(протону) на резиновом жгуте. Прочность этого жгута 13,6Эв. Какие бы удары не
получал механический гироскоп (электрон), он всегда вернётся на своё исходное
место в позицию 1s. В основном 1s энергетическом состоянии электронный вихрь может находиться
сколь угодно долго. Электрон, как
грузик на резиновом жгуте, сколько его не пинай - он всё равно возвращается к
исходному положению.
Но
если удар превысит прочность жгута 13,6Эв, электрон отправится в свободное
плавание по волнам мирового эфира в поисках свободного протона.
Вращаясь
на резиновом жгуте, механический гироскоп (электрон) будет проявлять все
свойства механического астатического гироскопа с тремя степенями свободы.
Первое свойство уравновешенного
гироскопа с тремя степенями свободы состоит в том, что его ось стремится
устойчиво сохранять в мировом пространстве приданное ей первоначальное
направление. Так как эта ось вначале направлена на протон, то при любых
воздействиях на электрон и случайных толчках электрон будет продолжать
указывать на прежнее положение протона.
Излучение
и поглощение энергии атомом происходит при скачкообразном переходе из одного
стационарного состояния в другое, при этом имеют место два варианта развития
событий:
Поглотив
порцию энергии в виде фотона, электронный вихрь начинает совершать амплитудные
колебания. Собственный момент количества движения электрона - величина
постоянная и не меняется с изменением орбиты электрона.
Lе = 1/2 rе mе vе = const
Поэтому
у электрона есть только два способа аккумулировать полученную энергию. Это -
аккумулировать полученную энергию только в виде амплитудных колебаний, что
реализуется на 2s, 2р,
3s, 3р, 4s. 4р, 5s, 5р, 6s, 6р
и т. д. орбитах.
Или, амплитудно колеблющийся электронный вихрь
начинает прецессионно вращаться вокруг s-оси по орбитам p,
d, f, g, h и т.
д. Какой сценарий реализуется, в каждом конкретном случае зависит от
направления удара – импульса фотона и геометрического размера налетевшего
фотона.
15. Строение
электронной
оболочки атома водорода
по Никитину
А. Н.
Электронный
вихрь в атоме водорода может занимать множество
энергетических уровней и положений, см. таблицу «Строение электронной
оболочки атома водорода». Для лучшего понимания таблицы сопроводим её
пояснительными рисунками.
|

|
|
|
Электронный вихрь, как кольцевой магнит, может занимать
относительно протонного вихря, тоже кольцевого магнита, два равноценных
положения для компенсации кулоновского
притяжения одинаковыми магнитными полюсами навстречу. Показан в1s состоянии
|
Электронные вихри 1s 2s 3s , в возбуждённом
состоянии увеличивают амплитуду своих колебаний. Эти амплитудные колебания
или орбиты электрона образуют электронные сферы непроницаемости. В одном
объёме пространства одновременно не может находиться несколько орбит. Спин
+1/2 и -1/2
|
|
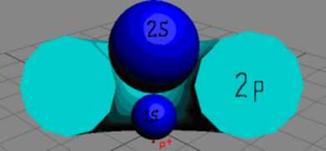
|

|
|
Маленький красный шарик - это протон. Два первых синих
шара орбиты сферы непроницаемости 1s и 2s
электронов
|
Два голубых усечённых тора орбиты 2р и 3р сфер
непроницаемости электронов. Орбита 3d электрона зелёного цвета
|
|

|
|
|
Четыре орбитальные оболочки электрона в атоме водорода.
Орбита электрона в 4f
энергетическом положении жёлтого цвета.
|
Пять орбитальных оболочек электрона водорода. Орбита 5g
электрона сиреневого
цвета.
|
|
|
|
|
|
|
Шесть орбитальных оболочек электрона водорода. Орбита 6h
электрона фиолетового цвета
|
Семь орбитальных оболочек электрона водорода. Орбита 7i
электрона светло-синего цвета
|
|
|
|
|
Восемь орбитальных оболочек электрона водорода. Орбита 8k
электрона бледно-зелёного цвета
|
Девять орбитальных оболочек электрона водорода. Орбита 9l
электрона жёлто-зелёного цвета
|
|
|
|
|
Десять орбитальных оболочек электрона водорода. Орбита 10m
электрона телесного цвета
|
Одиннадцать орбитальных оболочек электрона водорода. Орбита 11n
электрона кремового цвета
|
|

|
|
|
Вид «cверху» одиннадцати
круговых орбит электрона в атоме водорода без рассечения.
|
Вид «cбоку» одиннадцати орбит
электрона в атоме водорода с противоположными + положительным и –
отрицательным спином.
|
В
основном 1s энергетическом состоянии электронный вихрь может находиться
сколь угодно долго (при нормальных
условиях). Во всех остальных
энергетических положениях
(при нормальной температуре) электрон
находится ограниченное время.
В
1s энергетическом
положении электронный вихрь имеет спин ½
т.е. ось его вращения совпадает с
осью вращения протона р+, см. рис.
|
|
|
Спин может быть +1/2 или -1/2 в зависимости от того, какой стороной
магнита протон захватил электрон северной магнитной или южной магнитной
стороной.
|
Если на его ось гироскопа
начинает действовать сила или пара сил, стремящихся привести ось в движение (т.
е. создающие вращающий момент относительно центра подвеса). То под действием
этой силы конец оси гироскопа
будет отклонять не в сторону действия силы, как это было бы при не вращающемся
гироскопе, а в направлении перпендикулярном к этой силе; в результате
электронный вихрь начнёт вращаться вокруг оси, притом не ускоренно, а с
постоянной угловой скоростью.
Это вращение называется
прецессией; оно происходит тем медленнее, чем быстрее вращается вокруг своей
оси сам электрон. Если в какой-то момент
времени действие силы прекратится, то одновременно прекратится прецессия и
ось мгновенно остановится, т. е. прецессионное
движение гироскопа безинерционно.
Ось
прецессионного вращения электронного вихря параллельна оси вращения протона. При кратковременных воздействиях даже очень
больших сил движение гироскопа изменяется незначительно. Гироскоп как бы
сопротивляется попыткам изменить его момент импульса и кажется
"затвердевшим".
Каждому углу наклона оси гироскопа
(электрона) соответствует своё расстояние до протона и своя частота вращения.
Каждая
прецессионная орбита электронного вихря характеризуется спином или моментом
количества движения L.
Lе = rе mе vе
где rе - радиус
электронного вихря
mе - масса покоя электрона
vе – скорость вращения массы электрона
Причем
стационарными являются лишь те орбиты, при движении по которым момент
количества движения Le
электрона равен целому числу постоянной Планка.
Le = rе
mе vе = nh
Один 1s уровень
отличается от (2s, 3s, 4s, 5s ….) уровня только «высотой орбиты», т.
е. расстоянием до протона см. рисунок и таблицу «Строение
электронной оболочки атома водорода».
Расстояния от s оси до осей
вращения электрона p, d, f, g, h, I, k, l, m, n, o, k, r, t, u, v, w, x, y, z и т. д. орбитах строго квантуются. Они отличаются
друг от друга проекцией момента количества движения на выделенную ось. Расстояние между осями вращения
прецессионных орбит равно диаметру ns электронного вихря на
данном энергетическом уровне, см. таблицу «Строение электронной оболочки
атома водорода».
У
электронного вихря собственный момент количества движения равен
Lе = 1/2 rе mе vе
Коэффициент ½ указывает на то, что
электрон имеет форму вращающегося тора-кольца. Кольцо или тор электрона при
столкновении с препятствием передаёт препятствию только половину импульса, так
как у кольца или тора половина массы движется в одну сторону относительно оси
вращения, а другая половина в противоположную.
Собственный момент количества движения
электрона - величина постоянная и не меняется с изменением орбиты электрона.
Lе = 1/2 rе mе vе = const
На других (p, d, f, g, h, I, k, l, m, n, o, k, r, t, u, v, w, x, y, z и т. д.) орбитах орбитальный момент количества движения
изменяется и вычисляется по стандартной формуле.
Lon = rе n mе vе n
где rе n - радиус
центра массы электронного вихря на N орбите
mе - масса покоя электрона
vе n – орбитальная скорость вращения
центра массы электрона относительно оси s на N орбите.
Пользуясь
данными таблицы «Строение
электронной оболочки атома водорода» рассчитаем суммарный момент количества
движения электронного вихря для каждой орбиты.
Момент
количества движения - величина векторная. Вектор перпендикулярен плоскости
вращения и перпендикулярен направлению
вращения. Условились направление вектора вверх, при вращении против часовой
стрелки, считать за + (наблюдатель смотрит с поверхности протона). И наоборот,
вектор считают (–), если вращение по часовой стрелке (наблюдатель смотрит с
поверхности протона).
Векторы
Le и Lon суммируются по
правилу сложения векторов.
Le + Lon = L∑n
Результаты
вычислений сведём в график изменения суммарного спина электрона от радиуса
прецессионной орбиты (s,
p, d, f, g, h, I, k, l, m и т. д.) электронного вихря.
|
|
|
График изменения суммарного спина электрона от радиуса
прецессионной орбиты (-s,
-p, -d, -f, -g, -h,
-i, -k, -l) электронного вихря.
|
16. Лэмбовский сдвиг
Лэмбовский сдвиг — сдвиг энергии связи электрона в атоме
водорода. Сдвиг уровней — это небольшое отклонение тонкой структуры уровней энергии
водородоподобных атомов от предсказаний релятивистской квантовой механики,
основанных на уравнении Дирака.
Лэмбовский сдвиг объясняется
очень просто. Рассмотрим рисунок положение сфер непроницаемости электрона на
двух соседних орбитах 2s1/2 и 2p1/2 и 2р3/2.
Радиусы
центра тяжести электронного тора и сферы непроницаемости электронного вихря в
близком энергетическом состоянии на орбитах 2s1/2 и 2p1/2 и 2р3/2разные.
Сферы непроницаемости электрона на
орбите 2р3/2 больше, чем на орбите 2s1/2
Почему?
Потому что на орбите 2р3/2 электронный вихрь имеет большие
амплитудные колебания, чем на орбите 2s1/2. Вращаясь по прецессионной орбите и
сильно вибрируя, он уменьшает свою энергию связи с протоном.
Из
возбуждённого 2р3/2 состояния электрон может вернуться в 1s1/2состояние
двумя путями: коротким и длинным. Короткий путь - это излучить фотон с длиной
волны λ= 1215.6682х10-10м и сразу упасть на 1s1/2 орбиту.
|
|
|
Объяснение различий в энергии электрона на орбитах 2s1/2 и 2p1/2 и 2р3/2. Радиусы центра тяжести
электронного тора в близком энергетическом состоянии на орбитах 2s1/2 и 2p1/2 и 2р3/2разные.
|
Длинный
путь, когда сначала электрон занимает
центрально осевую позицию, на это указывает его спин 1/2. При этом гасится
прецессионная скорость вращения и излучается фотон с длиной волны λ= 273307600х10-10м, см. таблицу «Уровни энергий электрона в
атоме водорода частоты излучаемых фотонов νf и длины волн λ f фотонов при
различных энергетических переходах».
Но
при этом тор электрона успевает раскрутиться сильнее, чем тор электрона на
орбите 2s1/2 .
При этом диаметр сферы непроницаемости 2p1/2 становится меньше, чем
диаметр сферы непроницаемости на 2s1/2 орбите, и он опускается ближе к протону, см рис.
И
уже с этой орбиты 2p1/2,
не имеющей прецессионного вращения, электрон начинает падение на стабильную
орбиту 1s1/2.
При этом излучается фотон с длиной волны λ= 1215.6736х10-10м
Физическая сущность Лэмбовского сдвига -
уменьшение энергии связи электрона с протоном за счёт энергии прецессионного
вращения электрона на орбитах –p, -d, -f, -g, и так далее.
|
|
|
На первой Боровской орбите тор электрона не имеет
амплитудных колебаний, поэтому магнитный момент максимален. На более высоких
орбитах амплитудные колебания возрастают. Эти колебания тора электрона
образуют сферу непроницаемости.
|
17. Траектории
электронного вихря
на прецессионных орбитах
в атоме водорода
На
любой –s орбите
траектория движения электронного вихря образует круг. На других орбитах (-p, -d, -f, -g, -h, -i, -k, -l, и
т. д.) скорость собственного вращения электронного вихря накладывается на
прецессионную скорость вращения. Поэтому на этих орбитах траектория движения
любой произвольно выбранной точки на поверхности электронного вихря будет
описывать эпитрохоиду, см. рисунок
ниже.
|
|
|
Эпитрохо́ида —
плоская кривая, образуемая точкой, жёстко связанной с окружностью, катящейся по внешней стороне
другой окружности.
|
|
18.Таблица «Строение электронной оболочки атома
водорода по Никитину А. Н.» №1
|
|
R-
радиус
№n
орбиты электрона
|
1R
|
собс
твен
ная
скор
ость
вра
щен
ия
е-
Vвр
|
орби
таль
ная
скор
ость
вра
щен
ия
е-
Vор
|
собс
твен
ная
час
тота
вра
щен
ия
е-
νвр
|
орби
таль
ная
час
тота
вра
щен
ия
е-
νор
|
2R
|
собс
твен
ная
скор
ость
вра
щен
ия
е-
Vвр
|
орби
таль
ная
скор
ость
вра
щен
ия
е-
Vор
|
собс
твен
ная
час
тота
вра
щен
ия
е-
νвр
|
орби
таль
ная
час
тота
вра
щен
ия
е-
νор
|
3R
|
собс
твен
ная
скор
ость
вра
щен
ия
е-
Vвр
|
орби
таль
ная
скор
ость
вра
щен
ия
е-
Vор
|
собс
твен
ная
час
тота
вра
щен
ия
е-
νвр
|
орби
таль
ная
час
тота
вра
щен
ия
е-
νор
|
4R
|
собс
твен
ная
скор
ость
вра
щен
ия
е-
Vвр
|
орби
таль
ная
скор
ость
вра
щен
ия
е-
Vор
|
собс
твен
ная
час
тота
вра
щен
ия
е-
νвр
|
орби
таль
ная
час
тота
вра
щен
ия
е-
νор
|
|
S
- высота
орбиты
электрона
|
1R
|
4R
|
9R
|
16R
|
|
Н - шаг
вылета
орбиты
электрона
|
0
|
4R
|
6R
|
8R
|
|
1/2
|
1
|
1
|
1s
|
V
|
0
|
ν
|
0
|
2s
|
1/2V
|
0
|
1/4ν
|
0
|
3s
|
1/3V
|
0
|
1/9ν
|
0
|
4s
|
1/4V
|
0
|
1/16ν
|
0
|
|
3/2
|
3
|
4
|
|
|
|
|
|
2p
|
1/2V
|
1/4V
|
1/4ν
|
1/16ν
|
3p
|
1/3V
|
1/6V
|
1/9ν
|
1/36ν
|
4p
|
1/4V
|
1/8V
|
1/16ν
|
1/64ν
|
|
5/2
|
5
|
6
|
|
|
|
|
|
|
|
|
|
|
3d
|
1/3V
|
1/6V
|
1/9ν
|
1/72ν
|
4d
|
1/4V
|
1/8V
|
1/16ν
|
1/128ν
|
|
7/2
|
7
|
8
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4f
|
1/4V
|
1/8V
|
1/16ν
|
1/192ν
|
|
Спин
J
элек
трона +/-
|
Цик
лоид
е-
на
орби
те
|
Обо
рот
ов
е-
на
орби
те
|
1
|
2
|
3
|
4
|
|
Главное квантовое число n
|
|
Где – R = 5,2917720859х10-11м радиус первой Боровской
орбиты
|
Где V =
2187299м/сек скорость вращения электронного вихря на первой Боровской
орбите
|
Где ν = 6,5761763х1015 Гц частота
вращения электронного вихря на первой Боровской орбите
|
|
Формула для расчёта длины
волны излучённого фотона λ f = С/ν f
Где С = 299792456,2 м/сек - скорость света
|
Формула для
расчёта частоты излучённого фотона ν f
= (ν1 -
νn)/2
|
|
18. Таблица «Строение
электронной оболочки атома водорода по Никитину А. Н.» №2
|
|
R-
радиус
№n
орбиты электрона
|
5R
|
собс
твен
ная
скор
ость
вра
щен
ия
е-
Vвр
|
орби
таль
ная
скор
ость
вра
щен
ия
е-
Vор
|
собс
твен
ная
час
тота
вра
щен
ия
е-
νвр
|
орби
таль
ная
час
тота
вра
щен
ия
е-
νор
|
6R
|
собс
твен
ная
скор
ость
вра
щен
ия
е-
Vвр
|
орби
таль
ная
скор
ость
вра
щен
ия
е-
Vор
|
собс
твен
ная
час
тота
вра
щен
ия
е-
νвр
|
орби
таль
ная
час
тота
вра
щен
ия
е-
νор
|
7R
|
собс
твен
ная
скор
ость
вра
щен
ия
е-
Vвр
|
орби
таль
ная
скор
ость
вра
щен
ия
е-
Vор
|
собс
твен
ная
час
тота
вра
щен
ия
е-
νвр
|
орби
таль
ная
час
тота
вра
щен
ия
е-
νор
|
8R
|
собс
твен
ная
скор
ость
вра
щен
ия
е-
Vвр
|
орби
таль
ная
скор
ость
вра
щен
ия
е-
Vор
|
собс
твен
ная
час
тота
вра
щен
ия
е-
νвр
|
орби
таль
ная
час
тота
вра
щен
ия
е-
νор
|
|
S
- высота
орбиты
электрона
|
25R
|
36R
|
49R
|
64R
|
|
Н - шаг вылета
орбиты
электрона
|
10R
|
12R
|
14R
|
16R
|
|
1/2
|
1
|
1
|
5s
|
1/5V
|
0
|
1/25ν
|
0
|
6s
|
1/6V
|
0
|
1/36ν
|
0
|
7s
|
1/7V
|
0
|
1/49ν
|
0
|
8s
|
1/8V
|
0
|
1/64ν
|
0
|
|
3/2
|
3
|
4
|
5p
|
1/5V
|
1/10V
|
1/25ν
|
1/100ν
|
6p
|
1/6V
|
1/12V
|
1/36ν
|
1/144ν
|
7p
|
1/7V
|
1/14V
|
1/49ν
|
1/196ν
|
8p
|
1/8V
|
1/16V
|
1/64ν
|
1/256ν
|
|
5/2
|
5
|
6
|
5d
|
1/5V
|
1/10V
|
1/25ν
|
1/200ν
|
6d
|
1/6V
|
1/12V
|
1/36ν
|
1/288ν
|
7d
|
1/7V
|
1/14V
|
1/49ν
|
1/392ν
|
8d
|
1/8V
|
1/16V
|
1/64ν
|
1/512ν
|
|
7/2
|
7
|
8
|
5f
|
1/5V
|
1/10V
|
1/25ν
|
1/300ν
|
6f
|
1/6V
|
1/12V
|
1/36ν
|
1/432ν
|
7f
|
1/7V
|
1/14V
|
1/49ν
|
1/588ν
|
8f
|
1/8V
|
1/16V
|
1/64ν
|
1/768ν
|
|
9/2
|
9
|
10
|
5g
|
1/5V
|
1/10V
|
1/25ν
|
1/400ν
|
6g
|
1/6V
|
1/12V
|
1/36ν
|
1/576ν
|
7g
|
1/7V
|
1/14V
|
1/49ν
|
1/784ν
|
8g
|
1/8V
|
1/16V
|
1/64ν
|
1/1024ν
|
|
11/2
|
11
|
12
|
|
|
|
|
|
6h
|
1/6V
|
1/12V
|
1/36ν
|
1/720ν
|
7h
|
1/7V
|
1/14V
|
1/49ν
|
1/980ν
|
8h
|
1/8V
|
1/16V
|
1/64ν
|
1/1280ν
|
|
13/2
|
13
|
14
|
|
|
|
|
|
|
|
|
|
|
7i
|
1/7V
|
1/14V
|
1/49ν
|
1/1176ν
|
8i
|
1/8V
|
1/16V
|
1/64ν
|
1/1536ν
|
|
15/2
|
15
|
16
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8k
|
1/8V
|
1/16V
|
1/64ν
|
1/1792ν
|
|
Спин
J
элек
трона +/-
|
Цик
лоид
е-
на
орби
те
|
Обо
рот
ов
е-
на
орб
ите
|
5
|
6
|
7
|
8
|
|
Главное квантовое число n
|
|
Где – R = 5,2917720859х10-11м радиус первой Боровской
орбиты
|
Где V =
2187299м/сек скорость вращения электронного вихря на первой Боровской
орбите
|
Где ν = 6,5761763х1015 Гц частота
вращения электронного вихря на первой Боровской орбите
|
|
Формула для расчёта длины
волны излучённого фотона λ f = С/ν f
Где С = 299792456,2 м/сек - скорость света
|
Формула для
расчёта частоты излучённого фотона ν f
= (ν1 -
νn)/2
|
|
18. Таблица «Строение электронной оболочки атома
водорода по Никитину А. Н.» №3
|
|
R-
радиус
№n
орбиты электрона
|
9R
|
собс
твен
ная
скор
ость
вра
щен
ия
е-
Vвр
|
орби
таль
ная
скор
ость
вра
щен
ия
е-
Vор
|
собс
твен
ная
час
тота
вра
щен
ия
е-
νвр
|
орби
таль
ная
час
тота
вра
щен
ия
е-
νор
|
10R
|
собс
твен
ная
скор
ость
вра
щен
ия
е-
Vвр
|
орби
таль
ная
скор
ость
вра
щен
ия
е-
Vор
|
собс
твен
ная
час
тота
вра
щен
ия
е-
νвр
|
орби
таль
ная
час
тота
вра
щен
ия
е-
νор
|
11R
|
собс
твен
ная
скор
ость
вра
щен
ия
е-
Vвр
|
орби
таль
ная
скор
ость
вра
щен
ия
е-
Vор
|
собс
твен
ная
час
тота
вра
щен
ия
е-
νвр
|
орби
таль
ная
час
тота
вра
щен
ия
е-
νор
|
12R
|
собс
твен
ная
скор
ость
вра
щен
ия
е-
Vвр
|
орби
таль
ная
скор
ость
вра
щен
ия
е-
Vор
|
собс
твен
ная
час
тота
вра
щен
ия
е-
νвр
|
орби
таль
ная
час
тота
вра
щен
ия
е-
νор
|
|
S
- высота
орбиты
электрона
|
81R
|
100R
|
121R
|
144R
|
|
Н - шаг вылета
орбиты
электрона
|
18R
|
20R
|
22R
|
24R
|
|
1/2
|
1
|
1
|
9s
|
1/9V
|
0
|
1/81ν
|
0
|
10s
|
1/10V
|
0
|
1/100ν
|
0
|
11s
|
1/11V
|
0
|
1/121ν
|
0
|
12s
|
1/12V
|
0
|
1/144ν
|
0
|
|
3/2
|
3
|
4
|
9p
|
1/9V
|
1/18V
|
1/81ν
|
1/324ν
|
10p
|
1/10V
|
1/20V
|
1/100ν
|
1/400ν
|
11p
|
1/11V
|
1/22V
|
1/121ν
|
1/484ν
|
12p
|
1/12V
|
1/24V
|
1/144ν
|
1/576ν
|
|
5/2
|
5
|
6
|
9d
|
1/9V
|
1/18V
|
1/81ν
|
1/648ν
|
10d
|
1/10V
|
1/20V
|
1/100ν
|
1/800ν
|
11d
|
1/11V
|
1/22V
|
1/121ν
|
1/968ν
|
12d
|
1/12V
|
1/24V
|
1/144ν
|
1/1152ν
|
|
7/2
|
7
|
8
|
9f
|
1/9V
|
1/18V
|
1/81ν
|
1/972ν
|
10f
|
1/10V
|
1/20V
|
1/100ν
|
1/1200ν
|
11f
|
1/11V
|
1/22V
|
1/121ν
|
1/1452ν
|
12f
|
1/12V
|
1/24V
|
1/144ν
|
1/1728ν
|
|
9/2
|
9
|
10
|
9g
|
1/9V
|
1/18V
|
1/81ν
|
1/1296ν
|
10g
|
1/10V
|
1/20V
|
1/100ν
|
1/1600ν
|
11g
|
1/11V
|
1/22V
|
1/121ν
|
1/1936ν
|
12g
|
1/12V
|
1/24V
|
1/144ν
|
1/2304ν
|
|
11/2
|
11
|
12
|
9h
|
1/9V
|
1/18V
|
1/81ν
|
1/1620ν
|
10h
|
1/10V
|
1/20V
|
1/100ν
|
1/2000ν
|
11h
|
1/11V
|
1/22V
|
1/121ν
|
1/2420ν
|
12h
|
1/12V
|
1/24V
|
1/144ν
|
1/2880ν
|
|
13/2
|
13
|
14
|
9i
|
1/9V
|
1/18V
|
1/81ν
|
1/1944ν
|
10i
|
1/10V
|
1/20V
|
1/100ν
|
1/2400ν
|
11i
|
1/11V
|
1/22V
|
1/121ν
|
1/2904ν
|
12i
|
1/12V
|
1/24V
|
1/144ν
|
1/3456ν
|
|
15/2
|
15
|
16
|
9k
|
1/9V
|
1/18V
|
1/81ν
|
1/2268ν
|
10k
|
1/10V
|
1/20V
|
1/100ν
|
1/2800ν
|
11k
|
1/11V
|
1/22V
|
1/121ν
|
1/3388ν
|
12k
|
1/12V
|
1/24V
|
1/144ν
|
1/4032ν
|
|
17/2
|
17
|
18
|
9l
|
1/9V
|
1/18V
|
1/81ν
|
1/2592ν
|
10l
|
1/10V
|
1/20V
|
1/100ν
|
1/3200ν
|
11l
|
1/11V
|
1/22V
|
1/121ν
|
1/3872ν
|
12l
|
1/12V
|
1/24V
|
1/144ν
|
1/4608ν
|
|
19/2
|
19
|
20
|
|
|
|
|
|
10m
|
1/10V
|
1/20V
|
1/100ν
|
1/3600ν
|
11m
|
1/11V
|
1/22V
|
1/121ν
|
1/4356ν
|
12m
|
1/12V
|
1/24V
|
1/144ν
|
1/5184ν
|
|
21/2
|
21
|
22
|
|
|
|
|
|
|
|
|
|
|
11n
|
1/11V
|
1/22V
|
1/121ν
|
1/4840ν
|
12n
|
1/12V
|
1/24V
|
1/144ν
|
1/5760ν
|
|
23/2
|
23
|
24
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12o
|
1/12V
|
1/24V
|
1/144ν
|
1/6336ν
|
|
Спин
J
элект
рона +/-
|
эпит
рохо
ид
на
орби
те
|
Обо
рот
ов
е-
на
орби
те
|
9
|
10
|
11
|
12
|
|
Главное квантовое число n
|
|
Где – R = 5,2917720859х10-11м
радиус первой Боровской орбиты
|
Где V =
2187299м/сек скорость вращения электронного вихря на первой Боровской
орбите
|
Где ν = 6,5761763х1015 Гц частота
вращения электронного вихря на первой Боровской орбите
|
|
Формула для расчёта длины
волны излучённого фотона λ f = С / ν f
Где С = 299792456,2 м/сек - скорость света
|
Формула для
расчёта частоты излучённого фотона ν f = (ν1 -
νn)/2
|
19 Легенда к таблице
Если
вам требуется узнать параметры
электрона, находящегося, например, на орбите 11k - найдите его в таблице.
Цифра, стоящая справа от неё в следующем столбце 1/11V - это собственная скорость вращения
электронного вихря, у всего
одиннадцатого слоя – оболочки она одинакова. Следующая цифра 1/22V - это орбитальная
прецессионная скорость электрона на орбите 11k, у всего одиннадцатого
слоя – оболочки она также одинакова. Прецессионная скорость в два раза ниже, чем собственная скорость вращения электронного
вихря на орбите 11k. Где V= 2187299м/сек -
скорость вращения электронного вихря на первой Боровской орбите.
В следующем столбце той же строки - собственная частота вращения электронного
вихря на одиннадцатых орбитах, она равна 1/121ν. Где ν
= 6,5761763х1015 Гц - частота вращения электронного вихря на
первой Боровской орбите.
Следующая цифра 1/3388ν - это орбитальная частота вращения
электрона на круговой прецессионной орбите. На орбите 11k она в 28 раз меньше собственной частоты вращения
электрона.
Затем
выпишите три первые строчки над ним, это будут:
Первая
строчка 11R - геометрический
радиус 11s электронного вихря. Где R = 5,2917720859х10-11м
- радиус электронного вихря на первой Боровской орбите, т.е. этот
радиус в одиннадцать раз больше первого Боровского радиуса электрона.
Вторая
строчка 121R - высота орбиты (она
же и оболочка №11) т.е. расстояние между
протоном р+ и 11s орбитой. Это расстояние в 121 раз
больше, чем первый Боровский радиус электрона.
Третья
строчка 22R - это шаг вылета орбиты электрона, т.е. расстояние между
радиусами соседних прецессионных орбит электрона в этой 11 оболочке.
Затем
выпишите слева из первых двух столбцов той же строки, это будут:
Первая
цифра 15/2 +/- спин электрона
Вторая
цифра 15
- это отношение суммарно момента количества движения электрона L∑n на данной орбите 11k к
собственному моменту количества движения электрона Lе.
Ранее это соотношение называлось заселённостью орбиты. Эта цифра также
связана с количеством петель эпитрохоиды,
подробности смотреть ниже
Третья
цифра 16 - количество полных собственных
оборотов совершаемых электронным вихрем на прецессионной 11k орбите.
Предпоследняя
строчка таблицы 11 - это главное
квантовое число n электрона в данном энергетическом
состоянии.
|
20. Таблица-схема
«Переходы и длина волны
фотона первых 30
спектральных линий серии
Лаймана по Никитину А. Н.»
|
|
Все спектральные линии, входяшие в серию
Лаймана , могут быть получены двумя способами:
1) при переходе
электрона из положения P1/2
на 1S1/2, без
изменения момента импульса
2) при переходе
электрона из положения P3/2
на 1S1/2, с
изменением момента импульса.
Все спектральные
линии серии Лаймана принципиально являются двойными.
Формула для расчёта длины волны фотона λ f = С/ ν f
Формула для расчёта частоты фотона ν f
= (ν1 -
νn)/2
|
№
|
низ
|
верх
|
λ f
фотона
х 10-10м
|
|
1
|
1S1/2
|
2P1/2
|
1215.6736
|
|
1S1/2
|
2P3/2
|
1215.6682
|
|
|
|
|
|
|
2
|
1S1/2
|
3P1/2
|
1025.7229
|
|
1S1/2
|
3P3/2
|
1025.7218
|
|
|
|
|
|
|
3
|
1S1/2
|
4P1/2
|
972.537
|
|
1S1/2
|
4P3/2
|
972.5366
|
|
|
|
|
|
|
4
|
1S1/2
|
5P1/2
|
949.7431
|
|
1S1/2
|
5P3/2
|
949.7429
|
|
|
|
|
|
|
5
|
1S1/2
|
6P1/2
|
937.8035
|
|
1S1/2
|
6P3/2
|
937.803
|
|
|
|
|
|
|
6
|
1S1/2
|
7P1/2
|
930.748
|
|
1S1/2
|
7P3/2
|
930.748
|
|
|
|
|
|
|
7
|
1S1/2
|
8P1/2
|
926.226
|
|
|
|
|
|
|
8
|
1S1/2
|
9P1/2
|
923.15
|
|
|
|
|
|
|
9
|
1S1/2
|
10P1/2
|
920.963
|
|
|
|
|
|
|
10
|
1S1/2
|
11P1/2
|
919.352
|
|
|
|
|
|
|
11
|
1S1/2
|
12P1/2
|
918.13
|
|
|
|
|
|
|
12
|
1S1/2
|
13P1/2
|
917.18
|
|
|
|
|
|
|
13
|
1S1/2
|
14P1/2
|
916.43
|
|
|
|
|
|
|
14
|
1S1/2
|
15P1/2
|
915.82
|
|
|
|
|
|
|
15
|
1S1/2
|
16P1/2
|
915.33
|
|
|
|
|
|
|
16
|
1S1/2
|
17P1/2
|
914.92
|
|
|
|
|
|
|
17
|
1S1/2
|
18P1/2
|
914.58
|
|
|
|
|
|
|
18
|
1S1/2
|
19P1/2
|
914.29
|
|
|
|
|
|
|
19
|
1S1/2
|
20P1/2
|
914.04
|
|
|
|
|
|
|
20
|
1S1/2
|
21P1/2
|
913.83
|
№
|
низ
|
верх
|
λ f
фотона х 10-10м
|
21.
Таблица-схема «Переходы и длина волны фотона первых 30 спектральных линий серии Бальмера по
Никитину А Н.»
|
№
|
низ
|
верх
|
λ f
фотона х 10-10м
|
|
1
|
2P1/2
|
3d3/2
|
6562.7096
|
10
|
2p1/2
|
11d3/2
|
3770.603
|
|
2S1/2
|
3p3/2
|
6562.7247
|
2p1/2
|
11s1/2
|
3770.6033
|
|
2P1/2
|
3s1/2
|
6562.7517
|
2s1/2
|
11p3/2
|
3770.608
|
|
2S1/2
|
3p1/2
|
6562.7714
|
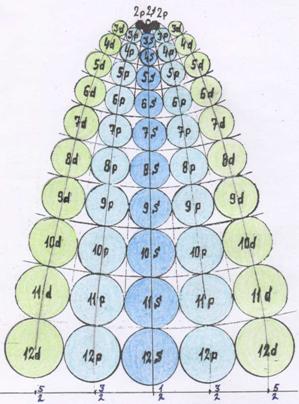
Первые
семь линий Бальмера расщепляются на семь составляющих тонкой структуры.
Восьмая линия Бальмера не расщепляемая! С ней надо разбираться
отдельно. В справочнике НГУ закралась явная ошибка! Если между первой и
восьмой линией идёт плавный спад в разностях длин фотонов, то между девятой и
десятой линией практически нет разницы
в длине фотонов. Далее разница между
десятой и тридцатой линией опять плавно проявляется.
Далее прямые переходы типа S-S с уровня 10s1/2 на 2S1/2 уровень запрещены природой!
Девятая и десятая линия Бальмера расщепляется на восемь составляющих
тонкой структуры.
Одиннадцатая линия Бальмера расщепляется на девять составляющих тонкой
структуры
|
2s1/2
|
11p1/2
|
3770.6083
|
|
2P3/2
|
3d5/2
|
6562.8516
|
2p3/2
|
11d5/2
|
3770.655
|
|
2P3/2
|
3d3/2
|
6562.8672
|
2p3/2
|
11d3/2
|
3770.6551
|
|
2P3/2
|
3s1/2
|
6562.9093
|
2p3/2
|
11s1/2
|
3770.6553
|
|
|
2p1/2
|
11d3/2
|
3770.603
|
|
2
|
2P1/2
|
4d3/2
|
4861.2785
|
|
|
2S1/2
|
4p3/2
|
4861.2869
|
11
|
2р1/2
|
12d3/2
|
3750.1249
|
|
2P1/2
|
4s1/2
|
4861.2883
|
2р1/2
|
12s1/2
|
3750.125
|
|
2S1/2
|
4p1/2
|
4861.2977
|
2s1/2
|
12d5/2
|
3750.1298
|
|
2P3/2
|
4d5/2
|
4861.3614
|
2s1/2
|
12p3/2
|
3750.1299
|
|
2P3/2
|
4d3/2
|
4861.365
|
2s1/2
|
12d3/2
|
3750.12991
|
|
2P3/2
|
4s1/2
|
4861.3748
|
2s1/2
|
12p1/2
|
3750.13
|
|
|
2p3/2
|
12d5/2
|
3750.176
|
|
3
|
2P1/2
|
5d3/2
|
4340.4268
|
2p3/2
|
12d3/2
|
3750.1764
|
|
2S1/2
|
5s1/2
|
4340.4308
|
2p3/2
|
12s1/2
|
3750.1766
|
|
2P1/2
|
5p3/2
|
4340.4335
|
|
|
2S1/2
|
5p1/2
|
4340.4379
|
12
|
2S1/2
|
13s1/2
|
3734,37
|
|
2P3/2
|
5d5/2
|
4340.4943
|
|
|
2P3/2
|
5d3/2
|
4340.4958
|
13
|
2S1/2
|
14s1/2
|
3721,94
|
|
2P3/2
|
5s1/2
|
4340.4998
|
|
|
|
14
|
2S1/2
|
15s1/2
|
3711,97
|
|
4
|
2P1/2
|
6d3/2
|
4101.702
|
|
|
2S1/2
|
6s1/2
|
4101.704
|
15
|
2S1/2
|
16s1/2
|
3703,86
|
|
2P1/2
|
6p3/2
|
4101.7081
|
|
|
2S1/2
|
6p1/2
|
4101.7104
|
15
|
2S1/2
|
17s1/2
|
3697,15
|
|
2P3/2
|
6d5/2
|
4101.763
|
|
|
2P3/2
|
6d3/2
|
4101.7638
|
17
|
2S1/2
|
18s1/2
|
3691,56
|
|
2P3/2
|
6s1/2
|
4101.7658
|
|
|
|
18
|
2S1/2
|
19s1/2
|
3686,83
|
|
5
|
2P1/2
|
7d3/2
|
3970.042
|
|
|
2S1/2
|
7s1/2
|
3970.043
|
19
|
2S1/2
|
20s1/2
|
3682,81
|
|
2P1/2
|
7p3/2
|
3970.047
|
|
|
2S1/2
|
7p1/2
|
3970.049
|
20
|
2S1/2
|
21s1/2
|
3679,35
|
|
2P3/2
|
7d5/2
|
3970.099
|
|
|
2P3/2
|
7d3/2
|
3970.0995
|
21
|
2S1/2
|
22s1/2
|
3676,36
|
|
|
|
|
6
|
2P1/2
|
8d3/2
|
3889.019
|
22
|
2S1/2
|
23s1/2
|
3673,76
|
|
2P1/2
|
8s1/2
|
3889.02
|
|
|
2S1/2
|
8p3/2
|
3889.025
|
23
|
2S1/2
|
24s1/2
|
3671,48
|
|
2S1/2
|
8p1/2
|
3889.026
|
|
|
2P3/2
|
8d5/2
|
3889.075
|
24
|
2S1/2
|
25s1/2
|
3669,47
|
|
2P3/2
|
8d3/2
|
3889.0752
|
|
|
2P3/2
|
8s1/2
|
3889.076
|
25
|
2S1/2
|
26s1/2
|
3667,68
|
|
|
|
|
7
|
2P1/2
|
9d3/2
|
3835.355
|
26
|
2S1/2
|
27s1/2
|
3666,10
|
|
2P1/2
|
9s1/2
|
3835.356
|
|
|
2S1/2
|
9p3/2
|
3835.361
|
27
|
2S1/2
|
28s1/2
|
3664,68
|
|
2S1/2
|
9p1/2
|
3835.362
|
|
|
2P3/2
|
9d5/2
|
3835.4095
|
28
|
2S1/2
|
29s1/2
|
3663,41
|
|
2P3/2
|
9d3/2
|
3835.4097
|
|
|
2P3/2
|
9s1/2
|
3835.41
|
29
|
2S1/2
|
30s1/2
|
3662,26
|
|
|
|
|
8
|
2P1/2
|
10d3/2
|
3797.87
|
30
|
2S1/2
|
31s1/2
|
3661,22
|
|
|
|
|
9
|
2P1/2
|
10s1/2
|
3770.871
|
|
|
|
|
|
2S1/2
|
10d5/2
|
3770.875
|
|
|
2S1/2
|
10p3/2
|
3770.8751
|
|
|
|
|
|
2S1/2
|
10s1/2
|
3770.8755
|
|
|
2S1/2
|
10p1/2
|
3770.8756
|
|
|
|
|
|
2P3/2
|
10d5/2
|
3770.9226
|
|
|
2P3/2
|
10d3/2
|
3770.9228
|
|
|
|
|
|
2P3/2
|
10s1/2
|
3770.923
|
|
|
№
|
низ
|
верх
|
λ f
фотона
х 10-10м
|
22. Таблица-схема
«Переходы и длина волны фотона первых 11 спектральных линий серии Пашена по
Никитину А. Н.»
|
№
|
низ
|
верх
|
λ f
фотона х 10-10м
|
|
1
|
3d3/2
|
4p1/2
|
18751.225
|
|
4
|
3d3/2
|
7f5/2
|
10049.4
|
|
3p3/2
|
4s1/2
|
18751.21
|
|
|
3d5/2
|
4p3/2
|
18751.191
|
5
|
3d3/2
|
8f5/2
|
9546.02
|
|
3d5/2
|
4f5/2
|
18751.138
|
|
|
3d5/2
|
4f7/2
|
18751.111
|
6
|
3d3/2
|
9f5/2
|
9229.02
|
|
3p3/2
|
4d3/2
|
18751.065
|
|
|
3d3/2
|
4p3/2
|
18751.064
|
7
|
3d3/2
|
10f5/2
|
9014.91
|
|
3p3/2
|
4d5/2
|
18751.011
|
|
|
3d3/2
|
4f5/2
|
18751.011
|
9
|
3d3/2
|
11f5/2
|
8862.79
|
|
3s1/2
|
4p1/2
|
18750.881
|
|
|
3p1/2
|
4s1/2
|
18750.829
|
10
|
3d3/2
|
12f5/2
|
8750
|
|
3s1/2
|
4p3/2
|
18750.72
|
|
|
3p1/2
|
4d3/2
|
18750.684
|
11
|
3d3/2
|
13f5/2
|
8665
|
|
|
|
|
2
|
3d5/2
|
5p3/2
|
12818.1627
|
∞
|
3d3/2
|
f5/2
|
8204
|
|
3d5/2
|
5f5/2
|
12818.1499
|
|
|
|
|
|
3d5/2
|
5f7/2
|
12818.1435
|
|
|
|
|
|
3d3/2
|
5p1/2
|
12818.1417
|
|
|
|
|
|
3p3/2
|
5s1/2
|
12818.1383
|
|
|
|
|
|
3p3/2
|
5d3/2
|
12818.1036
|
|
|
|
|
|
3d3/2
|
5p3/2
|
12818.1032
|
|
|
|
|
|
3p3/2
|
5d5/2
|
12818.0908
|
|
|
|
|
|
3d3/2
|
5f5/2
|
12818.0904
|
|
|
|
|
|
3s1/2
|
5p1/2
|
12817.9811
|
|
|
|
|
|
3p1/2
|
5s1/2
|
12817.9601
|
|
|
|
|
|
3s1/2
|
5p3/2
|
12817.9427
|
|
|
|
|
|
3p1/2
|
5d3/2
|
12817.9254
|
|
|
|
|
|
|
|
|
|
|
|
3
|
3d5/2
|
6p3/2
|
10938.1546
|
|
|
|
|
|
3d5/2
|
6f5/2
|
10938.1492
|
|
|
|
|
|
3d5/2
|
6f7/2
|
10938.1465
|
|
|
|
|
|
3d3/2
|
6p1/2
|
10938.1275
|
|
|
|
|
|
3p3/2
|
6s1/2
|
10938.1261
|
|
|
|
|
|
3p3/2
|
6d3/2
|
10938.1115
|
|
|
|
|
|
3d3/2
|
6p3/2
|
10938.1113
|
. Первые три линии Пашена удалось расщепить на тринадцать составляющих
тонкой структуры.
|
|
|
|
|
|
3p3/2
|
6d5/2
|
10938.1062
|
|
|
|
|
|
3d3/2
|
6f5/2
|
10938.1059
|
|
|
|
|
|
3s1/2
|
6p1/2
|
10938.0105
|
|
|
|
|
|
3p1/2
|
6s1/2
|
10937.9964
|
|
|
|
|
|
3s1/2
|
6p3/2
|
10937.9944
|
|
|
|
|
|
3p1/2
|
6d3/2
|
10937.9818
|
|
|
|
|
|
23. Таблица - схема
«Переходы и длина волны фотона первых
7 спектральных линий серии Брекета по Никитину А. Н.»
|
|
|
|
№
|
низ
|
верх
|
λ f фотона
х 10-10м
|
№
|
низ
|
верх
|
λ f фотона
х 10-10м
|
№
|
низ
|
верх
|
λ f фотона х 10-10м
|
|
5
|
4d3/2
|
5p1/2
|
40522.998
|
6
|
4f7/2
|
6d5/2
|
26258.784
|
7
|
4f5/2
|
7g7/2
|
21655
|
|
4p3/2
|
5s1/2
|
40522.962
|
4f7/2
|
6g7/2
|
26258.768
|
|
|
|
|
|
4d5/2
|
5p3/2
|
40522.865
|
4f5/2
|
6d3/2
|
26258.762
|
8
|
4f5/2
|
8g7/2
|
19445.6
|
|
4f5/2
|
5d3/2
|
40522.863
|
4d5/2
|
6p3/2
|
26258.762
|
|
|
|
|
|
4f7/2
|
5d5/2
|
40522.862
|
4f7/2
|
6g9/2
|
26258.759
|
9
|
4f5/2
|
9g7/2
|
18174.1
|
|
4f7/2
|
5g7/2
|
40522.798
|
4d3/2
|
6p1/2
|
26258.75
|
|
|
|
|
|
4f7/2
|
5g9/2
|
40522.76
|
4p3/2
|
6s1/2
|
26258.742
|
10
|
4f5/2
|
10g7/2
|
17362.1
|
|
4d5/2
|
5f5/2
|
40522.737
|
4f5/2
|
6d5/2
|
26258.731
|
|
|
|
|
|
4f5/2
|
5d5/2
|
40522.735
|
4d5/2
|
6f5/2
|
26258.731
|
11
|
4f5/2
|
11g7/2
|
16806.5
|
|
4d5/2
|
5f7/2
|
40522.673
|
4f5/2
|
6g7/2
|
26258.715
|
|
|
|
|
|
4f5/2
|
5g7/2
|
40522.671
|
4d5/2
|
6f7/2
|
26258.715
|
|
|
|
|
|
4p3/2
|
5d3/2
|
40522.615
|
4p3/2
|
6d3/2
|
26258.658
|
|
|
|
|
|
4d3/2
|
5p3/2
|
40522.614
|
4d3/2
|
6p3/2
|
26258.657
|
|
|
|
|
|
4p3/2
|
5d5/2
|
40522.487
|
4p3/2
|
6d5/2
|
26258.627
|
|
|
|
|
|
4d3/2
|
5f5/2
|
40522.486
|
4d3/2
|
6f5/2
|
26258.626
|
|
|
|
|
|
4s1/2
|
5p1/2
|
40522.321
|
4s1/2
|
6p1/2
|
26258.466
|
|
|
|
|
|
4s1/2
|
5p3/2
|
40521.937
|
4p1/2
|
6s1/2
|
26258.427
|
|
|
|
|
|
4p1/2
|
5d3/2
|
40521.865
|
4s1/2
|
6p3/2
|
26258.373
|
|
|
|
|
|
24. Таблица – схема
«Переходы и длина волны фотона первых
6 спектральных линий серии Пфунда по Никитину А. Н.»
|
|
|
|
|
|
№
|
низ
|
верх
|
λ f фотона
х 10-10м
|
№
|
низ
|
верх
|
λ f фотона
х 10-10м
|
|
1
|
5g7/2
|
6h9/2
|
74578
|
2
|
5g7/2
|
7h9/2
|
46525
|
|
5p1/2
|
6d3/2
|
74597.17
|
|
|
5s1/2
|
6p3/2
|
74597.3
|
3
|
5g7/2
|
8h9/2
|
37395
|
|
5p1/2
|
6s1/2
|
74597.85
|
|
|
5s1/2
|
6p1/2
|
74598.05
|
4
|
5g7/2
|
9h9/2
|
32961
|
|
5d3/2
|
6f5/2
|
74598.22
|
|
|
5p3/2
|
6d5/2
|
74598.22
|
5
|
5g7/2
|
10h9/2
|
30384
|
|
5p3/2
|
6d3/2
|
74598.47
|
|
|
5d3/2
|
6p3/2
|
74598.47
|
6
|
5g7/2
|
11h9/2
|
28722
|
|
5d5/2
|
6f7/2
|
74598.53
|
|
|
5f5/2
|
6g7/2
|
74598.53
|
|
|
|
|
|
5d5/2
|
6f5/2
|
74598.66
|
|
|
5f5/2
|
6d5/2
|
74598.66
|
|
|
|
|
|
5f7/2
|
6g9/2
|
74598.67
|
|
|
5f7/2
|
6g7/2
|
74598.75
|
|
|
|
|
|
5g7/2
|
6f7/2
|
74598.75
|
|
|
5f7/2
|
6d5/2
|
74598.87
|
|
|
|
|
|
5g9/2
|
6f7/2
|
74598.87
|
|
|
5g7/2
|
6f5/2
|
74598.87
|
|
|
|
|
|
5d5/2
|
6p3/2
|
74598.91
|
|
|
5f25/2
|
6d3/2
|
74598.91
|
|
|
|
|
|
5p3/2
|
6s1/2
|
74599.15
|
|
|
5d3/2
|
6p1/2
|
74599.22
|
|
|
|
|
|
25. Таблица – схема
«Переходы и длина волны фотона первых
5 спектральных линий серии Хемфри по
Никитину А. Н.»
|
|
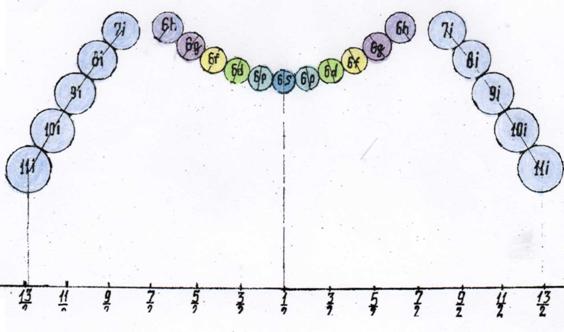
|
|
|
|
№
|
низ
|
верх
|
λ f фотона
х 10-10м
|
|
1
|
6h9/2
|
7i11/2
|
123680
|
|
|
|
2
|
6h9/2
|
8i11/2
|
75005
|
|
|
|
3
|
6h9/2
|
9i13/2
|
59066
|
|
|
|
4
|
6h9/2
|
10i11/2
|
51273
|
|
|
|
5
|
6h9/2
|
11i11/2
|
46712
|
26. Фотон - это спиральная деформация эфира
Фотон имеет спин +/-1, это указывает на его
спиральную форму. Фотон не тор,
тор имеет спин +/-1/2, потому что при ударе о препятствие разные части тора,
вращаясь в разных направлениях, могут передать препятствию только половину
собственного вращательного момента.
Спиральный фотон при ударе о препятствие
передаёт ему весь собственный вращательный момент, поэтому его спин +/-1.
Фотон - не элементарная частица, у фотона
нет массы. Подсчитано, что Солнце за время существования излучило фотонов с
суммарной массой равной своему весу. Абсурд,
астрономы рассчитали, что масса нашего Солнца- с момента рождения изменилась
незначительно.
Фотон - это спиральная деформация эфира,
механический импульс, распространяющийся прямолинейно от одной частицы эфира к
другой со скоростью света в эфире.
Эфир
обладает уникальными свойствами. Эфир - это безбрежный океан первочастиц
материи, из которых рождаются элементарные частицы и рассыпаются обратно при
аннигиляции элементарных частиц.
Эфир - несжимаемая жидкость, обладающая
свойством сверхпроницаемости и сверхтекучести, но всё- таки обладающей
вязкостью. На малых скоростях контакта при прямолинейном не ускоренном движении
эфирная жидкость свободно проникает через материальные тела, оказывая
незначительное сопротивление.
Недавно был обнаружен эффект
«аномального торможения Пионеров», присутствующий у всех
космических аппаратов — «Галилео», «Кассини», «Улисс».
В результате
исследования эффекта «аномалии Пионеров» группой NASA под
руководством В.Г. Турышева
была получена формула.
У всех свободно движущихся в
вакууме тел и элементарных частиц, включая фотоны, происходит «красное
смещение» волн де Бройля по одной и той же формуле
Z = apt/v,
где ap — (8.74±1.33)•1010 м/с2, постоянная вакуумного торможения
t — время
v — скорость (формула
справедлива для малых изменений).
Формула «вязкости физического
вакуума» позволяет рассчитать диссипацию
кинетической энергии за один период колебания волны де Бройля, с помощью
которой рассчитывается космологическое красное смещение и эффект «аномалии
Пионеров».
Wd = H0hс/v
где H0 — постоянная
Хаббла (2.40±0.12)•10-18 1/с,
h — постоянная Планка
c — скорость света
v — скорость частицы (тела)
Казалось
бы, при такой вязкости эфира планеты должны упасть на Солнце! Но, эфир сам
вовлечён в гигантские водовороты галактик. В галактиках существуют свои
звёздные водовороты эфира. Вокруг каждой звезды существуют свои планетарные
водовороты эфира. Частицы эфира
вовлекаются в гигантский вихрь, где скорости эфира и планет выравниваются.
Поэтому все планеты вращаются в одной плоскости. Небесные тела обмениваются
энергией с эфиром, в котором она, хоть и не бесконечна, но грандиозна.
С
одной стороны, они тормозятся об эфир, с другой стороны, они раскручиваются и
увлекаются
эфиром.
Но
это на малых скоростях и при прямолинейном движении без ускорения, т. е. при
ламинарном течении эфира.
Проблемы
с эфиром возникают, при трогании с места и при торможении любого материального
тела. При движении с ускорением
проявляется свойство «турбулентной» вязкости эфирной жидкости. Это первичное
«турбулентное» сопротивление вязкой эфирной жидкости мы воспринимаем как силу
инерции. Как только материальное тело преодолевает «турбулентную» силу вязкости
эфира, дальше оно будет двигаться равномерно и прямолинейно, почти бесконечно
долго.
Это как лодка на воде - толкнул посильнее,
а дальше она сама поплыла. При прямолинейном движении, теоретически, можно
набрать любую скорость, вплоть до скорости света. Главное, чтобы ускорение не
было слишком большим.
Но
практика показывает, что если прямолинейно движущиеся тела легко двигаются со
скоростями в десятки километров в секунду, то вращающиеся тела легко
разлетаются на осколки на линейных скоростях, едва превышающих сотни метров в
секунду!
Почему?
Потому
что на них действует «турбулентное» вязкостное сопротивление - трение эфира.
Эфирная
жидкость имеет свойство легко проникать через материальные тела по прямой
линии. Это свойство придаёт эфирной жидкости свойство кристалла.
Эфир - кристаллическая жидкость!
Клейнерт
(ученик Фейнмана) представлял
пространство в виде кристаллической решетки. С помощью такого подхода посчитаны
скорость света и постоянная Планка.
Можно
ли найти аналог эфира в природе?
Да,
можно - это вода! На ускоренной киносъёмке видно, когда по струйке воды бьют
линейкой, то на струйке воды появляются
трещины, как на ледяной сосульке! Эти трещины растут, а кусочки разлетающейся воды имеют острые,
как у кристаллов, грани! Вода имеет несколько режимов течения: ламинарный, с низким трением и турбулентный, с высоким трением.
При
прямолинейном равномерном движении микрочастицы эфира, как вода при ламинарном
течении, успевают занять правильную позицию и плавно обтекают электроны,
протоны и нейтроны материального тела. Эфирные частицы проникают через пустоты в торах элементарных частиц.
При быстрой смене направления движения тела микрочастицы эфира не успевают
занять правильную ориентацию и происходят жёсткие столкновения, как при
турбулентном течении воды. Протекание
эфирной жидкости через вращающиеся материальные тела из ламинарного
превращается в турбулентное. При вращении трение об эфир, его вязкость
практически из нулевого возрастает до предельных значений предела прочности
материальных тел. И материальные тела рассыпаются в прах.
При
прямолинейном движении, теоретически, можно набрать любую скорость, вплоть до
скорости света. Главное, чтобы ускорение не было слишком большим.
При
большом ускорении вязкость или трение об эфир резко возрастает. Материальные
тела начинают греться и разваливаться на составные части. При дальнейшем ускорении тела от трения об эфир начинают
раскаляться и распадаться на ионизированные атомы. Атомы при огромных
ускорениях распадаются на элементарные частицы. Высокоэнергетические
элементарные частицы сталкиваются с
частицами эфира и порождают лавину новых электрон-позитронных пар в различных
сочетаниях.
Какой
из этого можно сделать вывод?
Звездолёты,
летающие со скоростью близко к скорости света - детские сказки!
С
какой реальной скоростью летают твёрдые космические тела в нашей Галактике?
Скорости
движения планет относительно их звёзд до 50 км/сек.
Звезды
в нашей Галактике перемещаются относительно друг друга со скоростью 20 –
70км/сек.
Скорости
движения звёзд относительно центров масс их галактик до 300 км/сек.
Самые
большие скорости у галактик. Максимальные скорости движения галактик
относительно центров масс скоплений составляют до 600 км/сек.
Вот
график реальных скоростей во вселенной, приводимый Хайдаровым К. А.
Рис. Структура гравитационных ям во Вселенной.
1 - гравитационная яма Великого
Аттрактора, 2 - гравитационная яма Галактики,
3 - гравитационная яма Солнца, 4 - Земли, 5 - Луны, 6 - уровень нулевой
гравитации
У
дальних галактик лучевые составляющие скорости не измерить. Они алгебраически
складываются с космологическим красным смещением. Смещения линий спектра от
космологического красного смещения во много раз больше, чем от лучевой
составляющей скорости галактик. Ввиду большой неточности определения расстояний
до удалённых объектов и неточного значения постоянной Хаббла, получить значение
суммарной составляющей лучевых скоростей этих объектов и наблюдателя
невозможно. Тем более не измерить собственное значение скорости удалённых
галактик.
Несколько сотен километров в секунду, 1 --
2% от скорости света - это и есть физический предел скорости для твёрдых
космических тел и космических аппаратов!
Физическое
тело, разогнанное до более высоких скоростей, раскалится от трения об эфир и
испарится, превратившись в ионизированную плазму.
Эфир,
в первую очередь, сдует с маленьких
компактных и прочных атомных ядер электроны, обладающих огромной парусностью.
При более высоких скоростях, близких к скорости света, эфирный ветер начнёт
сдувать нуклоны с атомных ядер.
Вам
нужны доказательства?
Их
есть у меня!
Температурные
парадоксы
Температура
астероидов, замеренная О. Хансеном, оказалась одинаковой и приблизительно
на 100о K выше, чем должна бы быть при их нагреве от Солнца.
Именно равенство температур весьма различных по массе астероидов говорит, что
количество тепла, ими полученное, строго пропорционально их массе.
На одном и том же удалении от Солнца тела
любой массы нагреты одинаково! Астероиды и планеты нагреваются движущимся
внутри них эфиром! Количество тепла,
ими полученное, строго пропорционально их массе!
На
удалении астероидов их температура на 100оK выше расчетной.
На
удалении Плутона эта тепловая постоянная равна 50...60оK.
Юпитер
излучает в 2,9 раза больше тепла, чем получает от Солнца.
Ещё
один аргумент - работоспособность радиоаппаратуры Пионеров, нагретой трением об
эфир. Их проектировали для работы вблизи
планет с температурой выше 50 K. Сейчас они на расстояниях от Солнца, где
температура не превышает температуру реликтового излучения (2,7 K). Для
работы p-n-переходов нужно тепло (вблизи нуля полупроводники становятся
изоляторами).
27. Механизм образования фотонов
Энергия
электронов на орбите атома строго квантуется. Радиус вращения, расстояние до
ядра атома и угловая скорость вращения электронного вихря на каждой орбите
строго заданы. Тогда каким образом электронный вихрь накапливает энергию для
излучения фотона?
Электронный
вихрь накапливает энергию в виде амплитудного колебания. Амплитудные колебания
электронного вихря образуют сферу непроницаемости. Внутри этой сферы
непроницаемости электронного вихря образуется изолированная поляризованная
эфирная сфера.
Электронный
вихрь находится в динамическом равновесии со своим протоном. Силы кулоновского
притяжения разноимённых зарядов уравновешиваются силами взаимного отталкивания
магнитных полей, создаваемых вращательным движением этих зарядов. Магнитное
поле у электронного вихря возникает при
вращении электронного заряда. Если угловая скорость электронного вихря растёт,
пропорционально возрастает и сила магнитного поля.
Амплитудные
колебания электронного вихря вызывают сильное колебание вектора действия
магнитного поля. В результате падает уравновешивающаяся сила отталкивания
магнитного поля. Электронный вихрь начинает стремительно падать на свой протон. Падение вызывает увеличение
угловой скорости вращения электронного вихря. Увеличение угловой скорости
вращения вызывает уменьшение радиуса вращения электронного вихря. Уменьшение
радиуса вращения вызывает уменьшение объёма изолированной поляризованной
вакуумной сферы в третьей степени.
При падении со второй квантовой орбиты на
первую квантовую орбиту радиус вращения электронного вихря уменьшается в два
раза, а объём сферы непроницаемости уменьшается в восемь раз! Плотность эфира
должна возрасти тоже в восемь раз!
Но
эфир практически несжимаем!
Уменьшение
радиуса вращения и одновременное падение тора электрона на протон образует
спиральную траекторию электронного вихря. Спиральная траектория электронного
вихря похожа на кумулятивную воронку кумулятивного заряда.
Кумулятивная
воронка направлена в противоположную от ядра сторону. Поэтому импульс фотона
распространяется строго от центра ядра атома.
Как только электрон, падая, уменьшает свой
радиус вращения, он подрезает очередной спиральный слой эфира. Каждая
подрезанная частица спирального слоя эфира получает удар - импульс от тора
электрона.
Со
стороны этот процесс напоминает вращение лопасти винта моторной лодки в воде.
Лопасть тора электрона подрезает спиральную порцию эфира и откидывает её от
себя. Струя частиц эфира уносит с собой избыточную энергию электрона.
Не
вся поверхность тора электрона передаёт импульс частицам эфира, а только высшая
амплитудная точка.
|
|
Тор электрона, вращаясь против часовой стрелки, в
возбуждённом состоянии имеет амплитудные колебания. При каждом обороте тор электрона сокращает свой радиус вращения.
Как острой лопастью винта самолёта, он
подрезает каждый раз новый цилиндрический тонкостенный слой эфира. Край тора
электрона, находящийся в нижней точке
амплитуды, подрезает новую частицу эфира, а набегающее в амплитудном движении
тело тора начинает её, разгоняя, толкать. Разгон частицы эфира продолжается
до высшей точки амплитуды тора. Получившая импульс частица эфира летит только
вперёд и, ударяя в соседнюю частицу эфира, передаёт ей свой импульс. На таких
колоссальных скоростях удар получается абсолютно жёстким. Получив
импульс, частица эфира передаёт свой импульс соседней частице и возвращается
в исходное положение. И так до бесконечности. Скорость распространения
импульса ограничена и равна скорости деформации эфира. Скорость деформации
эфира равна скорости света в эфире С= 299792456,2 м/сек
|
|

|
|
|
Спиральная
деформация эфира прямолинейно со скоростью света перемещается по эфиру.
|
Тор электрона спускается по винтовой конусной орбите.
|
28.
Геометрические размеры фотона
Центр тяжести электронного вихря
совершает вокруг центральной оси
вращения атома водорода правильный круг
на любой прецессионной орбите.
За
один прецессионный оборот вокруг
центральной оси вращения атома водорода электронный вихрь на любой -р орбите успевает четыре
раза обернуться вокруг собственной оси вращения.
При этом, если на электронном
вихре отметить точку, то можно заметить, что она совершит три полных оборота во
круг центральной оси вращения атома
водорода на любой -р орбите. Такая петлеобразная траектория движения
называется трохоида.
Таким
образом, на любой -р орбите электронный
вихрь за один оборот вокруг центральной
оси вращения атома водорода совершит четыре собственных оборота вокруг
собственной оси вращения и три трохоиды.
Электронный
вихрь, при этом, совершает ещё и амплитудные колебания, и высшая точка
амплитуды имеет собственную орбиту, не совпадающую с орбитой трохоиды.
Скорость этой точки в два раза меньше
собственной скорости вращения электронного вихря. Орбита этой точки задаёт
начальную форму фронта излучаемого фотона. Заканчивается излучение фотона на
орбите 1s простой круговой формой. Траектория спуска с любой -р3/2 орбиты
на 1s1/2 орбиту будет иметь
воронкообразную спираль.
Фронт излучаемого фотона имеет не круговую
форму. Если рассматривать фронт любого фотона падающего с – р3/2 орбиты
на 1s1/2 орбиту - то фотон будет иметь такую сердечкообразную форму.
Почему
амплитудная скорость вращения отстаёт от скорости вращения электронного вихря?
Рассмотрим
диаграмму движения выделенной точки на поверхности вращающегося тора,
совершающего амплитудные колебания. Из диаграммы движения точки видно, что
точка возвращается в исходное положение ровно через два полных оборота тора.
В этом кроется секрет, почему частота
излучаемого фотона ровно в два раза меньше собственной частоты вращения
электрона.
|
29.
Таблица «Геометрические размеры
фотонных импульсов в атоме водорода по Никитину А. Н.»
|
|
Переход
(первая линия
в
серии)
|
Время перехода
сек
|
Число оборотов электрона при переходе
|
Числ
квантов в
фотоне
шт.
|
Геометри
ческая длина фотона
м
|
Частота фотона начальная
Х1015Гц
|
Частота фотона конечная
Х1015Гц
|
Частота фотона средняя
Х1015Гц
|
Длина волны фотона начальная λ f
х 10-10м
|
Длина волны фотона
конечная λ f
х 10-10м
|
Длина волны фотона
средняя λ f
х 10-10м
|
Диаметр фотона
начальный
х
10-10м
|
Диаметр фотона
конечный
х 10-10м
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1s1/2p+ переход электрона ядро
|
1,55х10–11
|
3,072х105
|
|
464х10-5
|
3,288
|
|
|
|
|
|
|
|
|
2p1/21s1/2 серии
Лаймана
|
0,98х10–9
|
4 833
370
|
2 416 685
|
0,29379
|
0,822
|
3,288
|
2,3649
|
|
|
1215.6736
|
|
|
|
3d3/22p1/2 Бальмера
|
1,04х10– 8
|
9 501
576
|
4 750 788
|
3,1178
|
0,3653
|
0,822
|
0,4568
|
|
|
6562.7096
|
|
|
|
4р3/23d3/2 Пашена
|
5,24х10– 8
|
16
755278
|
8 377 639
|
15,7091
|
|
|
|
|
|
18751.225
|
|
|
|
5p1/24d3/2 Брэкета
|
1,8х10– 7
|
26 633
024
|
13 316 512
|
53,9625
|
|
|
|
|
|
40522.998
|
|
|
|
6h9/25g7/2 Пфунда
|
4,83х10– 7
|
38 831
558
|
19 415
779
|
144,799
|
|
|
|
|
|
74578
|
|
|
|
7i11/26h9/2
Хемфри
|
|
|
|
|
|
|
|
|
|
123680
|
|
|
|
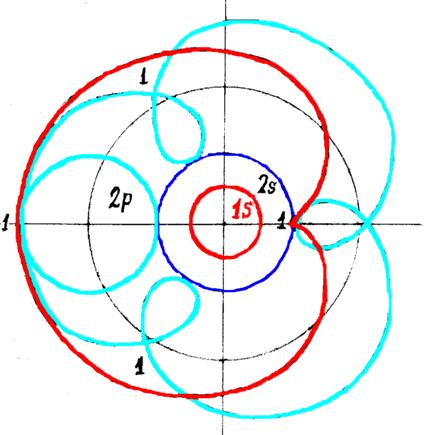
|
|
Красное сердечко - это форма фронта фотона, излучаемого при
переходе с любой –р2/3 орбиты на 1s1/2 орбиту.
Центральный красный круг - это тыл излучённого фотона.
Голубая эпитрохоида
-траектория любой точки электронного вихря на любой –р2/3 орбите.
|
|
|
|
Красная траектория, напоминающая двойное вздутие - это форма фронта фотона, излучаемого при
переходе с любой –d5/2 орбиты на
любую другую орбиту. Зелёная
эпитрохоида - траектория любой точки электронного вихря на любой –d5/2 орбите.
|
|
|
|
Красная траектория,
напоминающая тройной лепесток - это форма
фронта фотона, излучаемого при переходе с любой –f7/2 орбиты
на любую другую орбиту. Жёлтая
семи- петлевая эпитрохоида - траектория любой точки электронного вихря на
любой – f7/2 орбите.
|
|
|
|
Красная четырёхлепестковая траектория - это форма
фронта фотона, излучаемого при переходе с любой –g 9/2 орбиты на любую другую орбиту.
Сиреневая восьмипетлевая эпитрохоида - траектория любой точки электронного
вихря на любой – g 9/2 орбите.
|
30. Механизм возникновения
элементарного заряда
В
научной литературе часто используются такие термины, как электрический заряд,
электрическое поле, магнитное поле, кулоновские силы, магнитные силы, но никто
не разъясняет, что такое заряд и из чего состоят эти поля и механизм действия
этих сил.
Начнём
с электрического заряда.
Линевич
Э.И. в 2010 г.
преобразовал все электрические и магнитные единицы в механические. После
преобразований электромагнитных единиц в механические появилась возможность
свести электромагнитные понятия к наглядным, представимым сущностям.
Например,
электрический заряд можно представить в
виде вихревой прецессии материи, закольцованной в торе.
Давление
окружающего нас эфира в обычных условиях себя не проявляет. Эфир начинает
проявлять анизотропию давления только по отношению к любому току материи. Токи материи - это любые перемещения
материи относительно эфира. Будь то просто ускоренное движение или течение
электронов по проводам.
Линевичем
Э.И. в своей работе «Перевод размерностей электромагнитных величин в
механические» рассматривал, как давление эфира уравновешивает давление
элементарного закольцованного электрического тока. Он пришел к выводу, что если магнитная напряжённость электрического
тока Н равна магнитной напряжённости вакуума Н0, то в этом случае
должно возникать устойчивое состояние в виде токового кольца.
Линевич
Э.И., вероятно, не знаком с последними работами другого исследователя -
Шпенькова Георгия Петровича, в работе которого «Спин электрона» рассмотрена
очень грубая ошибка, допущенная теоретиками, при объяснении результатов
эксперимента Эйнштейна и де Хааса по определению магнитомеханического
(гиромагнитного) отношения.
Экспериментальный
результат превысил ожидаемое (следующее из теории) значение в два раза. Нужно
было искать ошибку в теории.
Никто из теоретиков не догадался мысленно
расплющить орбиту электрона и рассматривать орбиту как два параллельных
провода, по которому за один оборот заряд электрона дважды проходит мимо
центрального провода, в котором наводится ток.
Следуя
механической модели определения тока, используемой в электротехнике, как потока
электрического заряда («электронной жидкости») в проводнике, вычисление средней
величины силы электрического тока, создаваемой вращающимся электроном,
осуществлялось (как выясняется здесь, непродуманно и ошибочно) по формуле
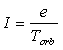
Где
I – сила тока,
создаваемая вращающимся электроном
Тоrb— период обращения
электрона, имеющего заряд е, по орбите
е
– заряд электрона
В формуле должно стоять 2е.
Линевич
Э.И., пользуясь ошибочными данными, получает заниженные в четыре раза значения
частоты вращения электрона на первой Боровской орбите, не согласующиеся с
имеющимися данными.
Отсюда
проистекает ошибка и в формуле определения электрического заряда электрона. Линевич
Э.И. берёт удвоенную массу электрона. Исправим эту ошибку и приведём правильную
формулу:
е =.Ώmе
где
е - заряд электрона
Ώ – Ларморовская угловая частота
прецессии электрона
mе – масса электрона
Численно заряд равен секундному расходу
суммарной массы материи, вращающейся в торе электрона.
Носителем
элементарного электрического заряда является электрон и его зеркальное
отражение - позитрон. Заряд измеряется в кулонах. Заряд электрона
равен 1,6х10-19кулон. Один кулон равен заряду 6,29х1018 электронов. Масса
электрона равна 9,1х10-31кг. Масса электронов в одном кулоне равна
5,7х10-12кг.
Заряд
в один кулон очень велик. Если бы два носителя заряда (q1 =
q2
= 1 Кл) расположили в вакууме на расстоянии 1м, то они взаимодействовали бы с силой
9·108кг!
31. Механизм возникновения
электрического поля
Заряд
возникает у атомов только при появлении лишних электронов, до их появления атом
был в целом электронейтрален или зарядово нейтрален. С появлением лишних
электронов меняется ситуация в окружающем атом эфире.
Вращающийся тор электрона, механически
контактируя с эфирными частицами -
амерами, закручивает их в попутном направлении. Эфирные частицы - амеры,
контактируя между собой, механически передают направление своего вращения
соседним частицам. Так образуются струны из эфирных частиц - амеров, уходящие в
бесконечность. Внутренняя и наружная поверхность тора электрона закручивает
эфирные струны амеров в разном направлении. Струны, вращающиеся в разных
направлениях, объединяются в эфирные трубки.
|
|

|
|
Эфирные частицы
состоят из неуловимых нейтрино или электрон – позитронных пар. Историческое
название «амеры», по древнегречески
«неизмеримые», впервые ввёл Демокрит.
Амеры постоянно находятся в хаотическом, броуновском движении и не имеют
ориентации. Эти амеры чисто механически закручиваются внутренней и наружной
поверхностью тора электрона в разном направлении. Закрученные амеры
закручивают соседние частицы, так выстраиваются соосно закрученные струны из
амеров.
|
Этими струнами,
уходящими в бесконечность, заряды «чувствуют» друг друга. У электрона и
протона эти струны объединяются в две эфирные трубки. Наружная и внутренняя
трубка имеет струны с разным направлением вращения. Условно красные струны
внутренние, синие струны наружные.
Каждый свободный
электрон и протон имеет такие
зарядовые трубки
Сколько свободных
электронов, столько зарядовых эфирных
трубок.
|
На
рисунке видно, что из всех возможных направлений струн выживают только струны
перпендикулярно направленные к плоскости вращения тора электрона. Все остальные
направления струн взаимно гасятся или рассеиваются в глубине атома.
Сколько лишних электронов у заряженного
тела, столько появляется зарядовых эфирных трубок в окружающем пространстве.
Этими струнами, объединёнными в эфирные трубки, заряды «чувствуют»
друг друга.
Если струны двух
разных зарядов вращаются сонаправленно (их спины сонаправлены) - две струны
сливаются в одну. Затем сливаются все струны одной трубки за другой.
Вращение
струн вызывает местное разрыхление эфира и понижение давления в эфирных
трубках. Пониженное давление во всех слившихся эфирных трубках вызывает
взаимное притяжение заряженных тел.
Статический заряд может быть либо
положительным, либо отрицательным. Всё зависит от того, какая полярность
электронов на поверхности заряженных тел.
Если электроны у
заряженных тел имеют разнонаправленные спины вращения, то струны тормозятся и
чисто механически отталкиваются, отклоняются друг от друга.
При плотном
расположении лишних электронов на одной из пластин, а, следовательно,
ориентированных струн и трубок, в пространстве между пластинами возникает
однородное электрическое поле, у которого линии напряженности параллельны.
|
|

|
|
На сферической
поверхности эфирные трубки равномерно уходят в бесконечность, где амеры
полностью рассеивают свою энергию вращения.
|
При плотном расположении лишних электронов на одной
из пластин конденсатора в пространстве между пластинами возникает однородное
электрическое поле, у которого линии напряженности параллельны.
|
Основная часть
энергии принадлежит лишним электронам заряда. А энергия электрического поля
является энергией упорядоченного расположения струн и трубок.
Возьмем
минимально возможный вакуумированный конденсатор, пластины которого состоят из
нескольких молекул проводника на каждой пластине.
Пока
не подали напряжения, на этих пластинах нет лишних электронов и нет заряда на
пластинах. Между пластинами конденсатора эфирные частицы находятся в
беспорядочном вращении и не имеют строгой ориентации.
Когда
подаётся напряжение на пластины конденсатора, на каждой пластине будет
накапливаться заряд противоположного знака. Носителями этого заряда будут
электроны, ориентированные соответствующим образом. (Смотрите работу Канарёва
Ф. М. «Электростатика»).
На
положительной пластине лишние электроны образуют электронный цуг, направленный
южным магнитным полюсом в сторону противоположно заряженной пластины
конденсатора.
На
отрицательно заряженной пластине конденсатора лишние электроны образуют
встречный электронный цуг, направленный северным магнитным полюсом в сторону
противоположно заряженной пластины конденсатора.
С
ростом расстояния от ядра атома стремительно растёт диаметр сферы
непроницаемости электрона. При достижении некоторой длины цуга, электронные
сферы непроницаемости начинают тесниться и сталкиваться друг с другом. Дело в
том, что направление вращения электронных торов, образующих сферы
непроницаемости, однонаправлено. Сферы непроницаемости трутся и тормозят друг
друга. Наступает физический предел насыщения электронами пластины конденсатора.
Происходит пробой конденсатора.
Оторвавшийся
электрон, столкнутый с последнего слоя, устремляется навстречу противоположно
заряженной пластины конденсатора. Так как связь с ядром атома лишних электронов
слабая, за оторвавшимся электроном цугом устремляются ближайшие электроны. В
стремительном полёте одинаково сориентированные электроны, стянутые магнитными
силами, выстраиваются цугом (Смотрите работу Канарёва Ф. М.). Так образуется
искра пробоя конденсатора.
А
что происходит с эфирными частицами между заряженных пластин конденсатора?
Так
как все электроны на обеих пластинах конденсатора вращаются в одну сторону, то
и оси вращения эфирных частиц разворачиваются соответствующим образом. Между
торами электронов пластин конденсатора образуются трубки из эфирных частиц. Эти
частицы неподвижны, но все они вращаются попутно вращению электронов. Диаметр
трубок ограничен размерами электронов, находящихся в последнем электронном
слое.
Диаметр трубок ограничен трением о соседние
трубки, так как в соседних трубках эфирные частицы тоже вращаются в эту же
сторону.
32. Механизм возникновения
магнитного поля
В
нейтральном атоме нет лишних электронов. Все электроны находятся в различной
степени связанном состоянии. Эфирные струны и трубки связанных электронов
замкнуты на эфирные трубки протонов.
Рассмотрим
простейший атом водорода, как у него возникает магнитное поле из эфирных трубок
электрона и протона. До захвата свободного электрона протоном, они имели прямые
уходящие в бесконечность эфирные струны, объединённые в эфирные трубки.
При
встрече в эфирном пространстве сонаправленно вращающихся струн они сливаются в
одну более прочную струну. Слившиеся струны объединяются в одну эфирную трубку.
Из-за вращения струн в эфирной трубке эфир разрыхляется и становится менее плотным.
Внешним давлением эфира торы электрона и протона придавливаются друг к другу.
|

|
|
|
Эфирные трубки электрона и протона соприкоснувшись,
замыкаются друг на друга, так как направление вращения струн у их эфирных
трубок сонаправленное.
|
|
|
|
|
Условное изображение четырёх замкнутых струн простейшего
атома водорода. Красный малый тор - протон. Синий большой тор - электрон.
Внутренние струны, состоящие из сонаправленно вращающихся амеров, охватывают
наружные струны. Наружные струны тоже замкнуты. Прямые, уходящие в бесконечность, зарядовые эфирные трубки
превратились в замкнутые магнитные эфирные трубки.
|
33. Распад
амера и
образование
электрон –
позитронной пары
из фотона
Экспериментально установлена возможность
образования электрон – позитронных пар в двух случаях:
1. Одиночный фотон с энергии более
1.022 МэВ сталкивается с ядром атома
2.
Столкновение двух фотонов с суммарной энергией более 1.022 МэВ
1. Одиночный фотон достаточной
энергии, с порогом рождения пар (2meс2  1.022
МэВ), не может в вакууме превратиться
в электрон-позитронную пару, так как при этом ему не с кем столкнуться и
закрутить электронный вихрь.
1.022
МэВ), не может в вакууме превратиться
в электрон-позитронную пару, так как при этом ему не с кем столкнуться и
закрутить электронный вихрь.
Процесс
образования пар происходит лишь при столкновении с нуклоном, протоном или
нейтроном ядра атома. При образовании электрон-позитронной пары передовые
частицы эфира, передающие импульс фотона, сталкиваются со сферой непроницаемости
кольца нуклона и импульс жёстко отражается от кольца нуклона.
Рассмотрим,
как поведёт себя один фотон гамма излучения с энергией, достаточной для
рождения одной электрон-позитронной пары, столкнувшейся со сферой
непроницаемости атомного ядра.
|

|

|
|
|

|

|
|
|
Вид сбоку и вид
«сверху» цепочки амеров одного кванта g фотона
|
В момент столкновения первый амер сталкивается со сферой непроницаемости
ядра и «расплющивается». Его энергия импульса переходит во вращательную
энергию амера
|
Второй амер тоже не может передать свой импульс
препятствию и тоже «расплющивается». Первый амер тратит энергию на
расталкивание окружающих амеров эфира.
|
Для
простоты возьмем только один виток - квант g фотона. Виток состоит из цепочки
импульсов, передающихся через эфир. Эфир состоит из неуловимых амеров –
электрон-позитронных пар. Поэтому в каждый момент времени носителем цепочки
импульсов является цепочка амеров. В следующий момент времени
эта цепочка импульсов
прямоли-
нейно
передаётся соседним амерам.
Избыток
импульса фотона передаётся вновь образовавшейся электрон – позитронной паре и
уносится ими в противоположные стороны.
|

|

|

|
|

|

|

|
|
Амеры, находящиеся «внутри» системы колец, расширяются
быстрее, чем первый амер – «ледокол эфира»
|
«Догоняющие амеры» передают свой вращательный импульс
первому «амеру- ледоколу», тормозятся, уменьшаются и сливаются с эфиром
|
После некоторого числа «расплющенных» амеров длина
окружности первого «амера-ледокола» достигает Комптоновской длины волны
электрона
|
2. При столкновении двух фотонов,
имеющих одинаковую закрутку, левостороннюю или правостороннюю, и имеющих
одинаковую или близкую частоту, происходит жёсткое столкновение с
преобразованием энергии импульса амеров фотона во вращательное движение одной
пары амеров.
Если
у фотонов различная закрутка - фотоны проходят друг через друга почти без
взаимодействия. Если частота фотонов значительно различается - они так же не
взаимодействуют.
Два
передовых встречных импульса фотонов сталкиваются в одной точке пространства.
Встреча импульсов может состояться двумя способами: на одном амере или
столкнутся сразу два амера.
Рассмотрим
случай с одним амером. Получив одновременный двойной двухсторонний
удар-импульс, амер ориентирует ось своего вращения с осью вращения ударяющих
амеров и расплющивается. Поглотив двойной импульс, амер, состоящий из
электрон
– позитронной пары, увеличивает скорость своего кругового и тороидального
вращения. При этом увеличивается диаметр амера, а в центре его двойного кольца
-абсолютная пустота.
В
это время подлетает второй двойной встречный удар-импульс, он попадает на
расчищенную полянку, в абсолютную пустоту в кольце первого расплющенного амера.
Второй
расплющенный амер имеет скорость вращения выше, чем у первого, успевшего
увеличить свой диаметр амера. Зажатый со всех сторон, второй амер передаёт свой
двойной вращательный импульс первому амеру. Передав импульс, второй амер
уменьшается до нормальных размеров и сливается с окружающими амерами.
Третий
подлетевший двойной встречный удар-импульс попадает на расчищенную полянку, в
абсолютную пустоту в кольце первого расплющенного амера, и повторяет судьбу
второго амера.
Так
продолжается одновременное увеличение диаметра первого «затравочного» амера и
столкновение встречных импульсов. Как только количество поглощённых
«затравочным» амером встречных импульсов перейдёт энергетическую границу в
1022кЭв, рождается две самостоятельные элементарные частицы - электрон и
позитрон.
34.
Взаимодействие
электрона с
фотонами
эффект
Комптона
Электрон
взаимодействует только с фотонами определённых энергий, почему?
Потому что у
фотонов-импульсов разной энергии разные геометрические размеры.
Фотон с большой энергией имеет маленький диаметр, и
он проскакивает через большое кольцо-тор электрона без взаимодействия.
Фотон с малой энергией имеет огромный диаметр, и
маленький электронный вихрь на первой Боровской орбите проскакивает через фотон
без взаимодействия. Поэтому налетающие импульсы - фотоны должны иметь
геометрические размеры близкие с размерами электрона.
Если
фотон имеет слишком большую воронку, то
электрон может оторвать и поглотить импульс только у части фотона. Обрывок,
импульс неусвоенного фотона, улетает дальше. Это так называемый эффект Комптона.
Обратный эффект Комптона
Эффектом,
обратным эффекту Комптона, является увеличение частоты света, претерпевающего
рассеяние на релятивистских электронах, имеющих энергию выше, чем энергия
фотонов. То есть в процессе такого взаимодействия происходит отрыв
длинноволновой низкочастотной части фотона. Улетевший обрывок фотона имеет
более высокую частоту, и он более коротковолновый, чем поглощённый участок
импульса фотона.
Электрон
может получить удар-импульс фотона с любого направления из окружающего
пространства.
Рассмотрим
возможные варианты ударов-импульсов фотонов:
Случай
№1 удар – импульс «снизу» от ядра атома
Случай
№2 удар – импульс «сверху» к ядру атома
Случай
№3 удар – импульс сбоку, поперёк оси вращения электронного вихря
Случай
№4 удар – импульс «снизу» ядра атома вбок
Случай
№5 удар – импульс «сверху» к ядру атома вбок
Случай
№6 удар – импульс по касательной по вращению или против вращения электронного
вихря
Случай
№1
удар
«снизу» от ядра атома
Электронный
вихрь, поглотив импульс фотона, удалится от ядра атома и в зависимости от силы
удара займёт энную ns орбиту (2s.
3s, 4s, и т. д.). Время жизни электрона на
верхних орбитах при нормальных температурах и давлении ограничено, см. таблицу.
Неизбежно наступает релаксация электрона, т.е. возвращение на 1s орбиту. Релаксация
электрона из положения 2р3/2
в исходное 1s1/2
положение сопровождается излучением фотона с длиной волны, равной 1216,6684А
ангстрема серии Лаймана, см. таблицу «Уровни энергий электрона…»
Случай №2
удар
«сверху» к ядру атома
Электронный
вихрь, поглотив импульс фотона, проскочит ядро атома, как обруч халахуп по
центру пропускает мячик от пинг-понга. И, в зависимости от силы удара, электрон
займёт энную ns орбиту (2s.
3s, 4s, и т. д.) с противоположной
стороны ядра протона. Релаксация
электрона из положения
ns в
исходное 1s положение,
но уже с
противоположной
стороны протона и противоположным знаком спина, сопровождается излучением
фотона с длиной волны =1216,6684А ангстрема серии Лаймана.
Случай
№3
удар
сбоку
поперёк
оси вращения электронного вихря
Электронный
вихрь, поглотив импульс фотона, сместится относительно протона и в зависимости от силы удара может занять
следующие орбиты 2p, 3d, 4f,
5g, 6h, 7i, 8k, 9l, 10m, 11n, 12o,
13q, 14r, 15t, 16u, 17v,
18w, 19x, и так далее.
Если
удар-импульс пришелся под небольшим углом, то электронный вихрь, поглотив
импульс фотона, удалится от ядра атома и в зависимости от силы удара может
занять энную np орбиту (2р,
3р, 4р, 5р, и т. д.).
Релаксация
электрона из положения np может произойти двумя способами. Либо
напрямую, например из 2р3/2 в 2s1/2 положение. При этом будет излучён фотон с длиной
волны =1216,6684А ангстрема серии Лаймана. См. таблицу «Уровни энергий электрона…»
Либо
электрон сначала из 2р3/2 положения со спином 3/2 перейдёт в положение
2р1/2 на ось s,
сохраняя свой прежний радиус и частоту вращения, излучив фотон с длиной волны
=273307600А. И только после этого с уровня 2р1/2 упадёт и займёт 1s1/2 уровень,
увеличив свою частоту вращения и уменьшив свой радиус, при этом излучив фотон
=1215,6736А ангстрема серии Лаймана.
Если
удар пришелся под небольшим углом сбоку, поперёк оси вращения электронного
вихря,. то это уже случай №4 или №5
Случай
№4
удар «снизу» от ядра атома вбок
Как
на бильярдном столе, в зависимости от угла удара и силы удара фотона,
электронный вихрь может занять всю палитру орбит от оси вращения ядра атома
вбок вплоть до экваториальной плоскости вращения протона.
Если
удар-импульс пришелся под небольшим углом, то электронный вихрь, поглотив
импульс фотона, займёт энную p орбиту с противоположной стороны ядра протона, то есть поменяв свой спин на
противоположный знак.
Случай
№5
удар
«сверху» к ядру атома вбок
Как
и в случае №4, в зависимости от угла удара и силы удара фотона, электронный
вихрь может занять всю палитру орбит от оси вращения протона вбок вплоть до
экваториальной плоскости вращения протона.
.
Случай
№6
удар
по касательной по вращению
или
против вращения электронного вихря
В
этом случае нет передачи импульса фотона. Фотон просто скользит по поверхности
электронного вихря без передачи энергии.
.
35. Анализ
таблицы амплитудных,
вращательных и прецессионных частот электрона
и
скоростей вращения на разных орбитах
в атоме водорода
Анализ
таблицы амплитудных частот электрона показывает, что, как и в любых волновых
процессах, энергию электрон накапливает
только в амплитудных колебаниях!
Ни
собственная частота вращения тора электрона, ни орбитальная частота вращения
электрона не влияет на орбитальную энергию электрона.
1 Орбитальная энергия электрона атома
водорода, выраженная в Ридбергах, зависит только от амплитудной частоты
колебаний электронного вихря.
2 Амплитудная частота νАе электрона с ростом
квантового числа стремится к значению 0,5 от частоты вращения электрона на
первой Боровской орбите, или к постоянной Ридберга.
3 Постоянная Ридберга, выраженная в герцах,
равна 3,29х1015гц - это частота амплитудных колебаний тора
электрона, при которых электрон покидает атом водорода.
4.Электрон в свободном неподвижном
состоянии, в отсутствии магнитного или электрического поля, не имеет
направленной ориентации вращения. (Электрон, в независимом состоянии, похож на
гироскоп, свалившийся на бок и вращающейся с частотой Ридберга. При этом
собственная частота вращения тора, спин электрона, падает в тысячи раз).
5.Таким образом, амплитудные колебания тора
электрона, нарастающие с ростом квантового числа, вырождаются у свободного
электрона во вращательное движение тора электрона, перпендикулярное плоскости
вращения его спина, с частотой Ридберга.
Где эксперименты по определению величины
спина на свободных, неподвижных,
находящихся вне действия магнитных и электрических полей, а не связанных с
атомами электронах?
Их нет!
Подозреваю, что они были, но спина у
свободного электрона не обнаружили, что противоречит современной теории.
Поэтому эксперименты положили под сукно.
|
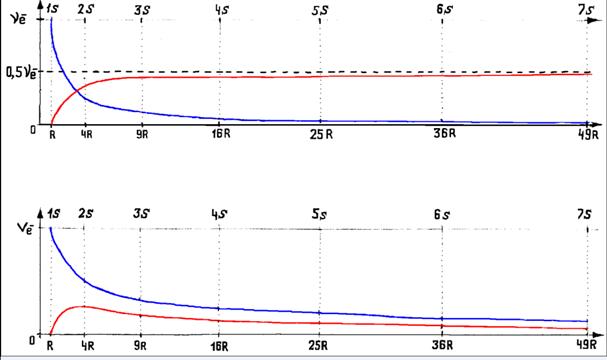
|
|
Синяя кривая - собственная частота вращения электрона в
атоме водорода
Красная кривая - амплитудная частота биений электрона
Чёрная пунктирная линия - постоянная Ридберга 3,29х1015гц,
|
|
|
|
Синяя кривая - собственная скорость вращения электронного
вихря в атоме водорода
Красная кривая - орбитальная прецессионная скорость
вращения
|
|
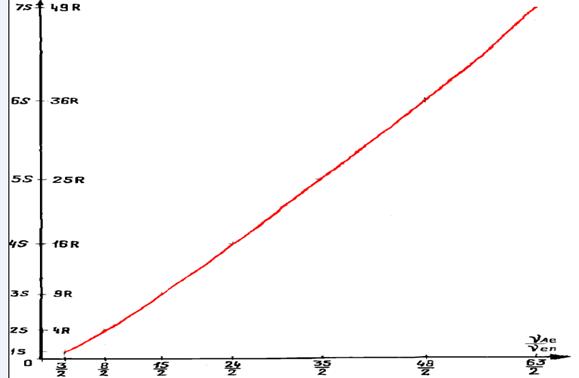
|
|
Красная кривая показывает, как изменяется отношение
амплитудной частоты к собственной частоте вращения электронного вихря в
зависимости от расстояния до ядра атома водорода.
|
|
36. Таблица
«Амплитудные, вращательные, прецессионные частоты электрона
и скорости
вращения на разных орбитах
в атоме
водорода по Никитину А. Н.»
|
|
Ор
би
та
|
Спин
элект
рона
J
|
Энергия
электрона
на
орбите
(см-1)
|
Амплитудная
частота
электрона (биение)
νАе
х1015Гц
|
Собственная
частота
вращения
электрона е-
νеn
х1015Гц
|
Орбиталь
ная прецес
сионная
частота вращения е
νоре
х1015Гц
|
Отношение частот
вращения е на разных орбитах
νеn/νе
|
Отношение ампли
тудной частоты к собственной
νАе/νеn
|
Отношение ампли
тудной к
Боровск
ой часто
те
νАе/νе
|
Орбиталь
ная скорость вращения электрона
Vе=2187299
м/сек
|
Собствен
ная скорость
вращения
электрона
Vе=2187299
м/сек
|
|
1s
|
1/2
|
0
|
0
|
6,5761763
|
0
|
1
|
0
|
0
|
0
|
1V
|
|
2p
|
1/2
|
82258.919
|
2,364902576
|
|
0
|
|
|
|
0
|
1/2V
|
|
2s
|
1/2
|
82258.954
|
2,46606138641
|
1.644044075
|
0
|
1/4
|
3/2
|
0.3596
|
0
|
1/2V
|
|
2p
|
3/2
|
82259.285
|
2,466071385
|
|
1/16ν
|
|
|
|
1/4V
|
1/2V
|
|
3p
|
1/2
|
97492.211
|
2,922743133
|
|
0
|
|
|
|
0
|
1/3V
|
|
3s
|
1/2
|
97492.222
|
2,92274326937
|
0.730686255
|
0
|
1/9
|
8/2
|
0.4444
|
0
|
1/3V
|
|
3d
|
3/2
|
97492.319
|
2,92274617736
|
|
1/36ν
|
|
|
|
1/6V
|
1/3V
|
|
3p
|
3/2
|
97492.321
|
2,922746267
|
|
1/36ν
|
|
|
|
1/6V
|
1/3V
|
|
3d
|
5/2
|
97492.357
|
2,92274731657
|
|
1/72ν
|
|
|
|
1/6V
|
1/3V
|
|
4p
|
1/2
|
102823.849
|
3,082581498
|
|
0
|
|
|
|
0
|
1/4V
|
|
4s
|
1/2
|
102823.853
|
3,08258154468
|
0.41101101875
|
0
|
1/16
|
15/2
|
0.4687
|
0
|
1/4V
|
|
4p
|
3/2
|
102823.894
|
3,082582766
|
|
1/64ν
|
|
|
|
1/8V
|
1/4V
|
|
4d
|
3/2
|
102823.8942
|
3,08258277982
|
|
1/64ν
|
|
|
|
1/8V
|
1/4V
|
|
4d
|
5/2
|
102823.909
|
3,08258322351
|
|
1/128ν
|
|
|
|
1/8V
|
1/4V
|
|
4f
|
5/2
|
102823.9113
|
3,08258329247
|
|
1/128ν
|
|
|
|
1/8V
|
1/4V
|
|
4f
|
7/2
|
102823.919
|
3,08258352331
|
|
1/192ν
|
|
|
|
1/8V
|
1/4V
|
|
5p
|
1/2
|
105291.629
|
3,156563667
|
|
0
|
|
|
|
0
|
1/5
|
|
5s
|
1/2
|
105291.631
|
3,15656366747
|
0.263047052
|
0
|
1/25
|
24/2
|
0.4799
|
0
|
1/5
|
|
5d
|
3/2
|
105291.652
|
3,15656429704
|
|
1/100ν
|
|
|
|
1/10
|
1/5
|
|
5p
|
3/2
|
105291.652
|
3,156564331
|
|
1/100ν
|
|
|
|
1/10
|
1/5
|
|
5d
|
5/2
|
105291.6598
|
3,15656453088
|
|
1/200ν
|
|
|
|
1/10
|
1/5
|
|
5f
|
5/2
|
105291.6618
|
3,15656459084
|
|
1/200ν
|
|
|
|
1/10
|
1/5
|
|
5f
|
7/2
|
105291.6657
|
3,156564707759
|
|
1/300ν
|
|
|
|
1/10
|
1/5
|
|
5g
|
7/2
|
105291.6657
|
3,156564707759
|
|
1/300ν
|
|
|
|
1/10
|
1/5
|
|
5g
|
9/2
|
105291.668
|
3,156564776711
|
|
1/400ν
|
|
|
|
1/10
|
1/5
|
|
6p
|
1/2
|
106632.1485
|
3,196751305
|
|
0
|
|
|
|
0
|
1/6
|
|
6s
|
1/2
|
106632.151
|
3,196751445817
|
0.18267156388
|
0
|
1/36
|
35/2
|
0.4861
|
0
|
1/6
|
|
6d
|
3/2
|
106632.162
|
3,196751775589
|
|
1/144
|
|
|
|
1/12
|
1/6
|
|
6p
|
3/2
|
106632.162
|
3,196753009
|
|
1/144
|
|
|
|
1/12
|
1/6
|
|
6d
|
5/2
|
106632.167
|
3,196751925485
|
|
1/288
|
|
|
|
1/12
|
1/6
|
|
6f
|
5/2
|
106632.1685
|
3,196751970454
|
|
1/288
|
|
|
|
1/12
|
1/6
|
|
6f
|
7/2
|
106632.1708
|
3,196752039406
|
|
1/432
|
|
|
|
1/12
|
1/6
|
|
6g
|
7/2
|
106632.1708
|
3,196752039406
|
|
1/432
|
|
|
|
1/12
|
1/6
|
|
6g
|
9/2
|
106632.1721
|
3,196752078380
|
|
1/576
|
|
|
|
1/12
|
1/6
|
|
6h
|
9/2
|
106632.1721
|
3,196752078380
|
|
1/576
|
|
|
|
1/12
|
1/6
|
|
6h
|
11/2
|
106632.173
|
3,196752105361
|
|
1/720
|
|
|
|
1/12
|
1/6
|
|
7p
|
1/2
|
107440.4385
|
3,220984157
|
|
0
|
|
|
|
0
|
1/7V
|
|
7s
|
1/2
|
107440.439
|
3,220983310301
|
0.13420767959
|
0
|
1/49
|
48/2
|
0.4897
|
0
|
1/7V
|
|
7d
|
3/2
|
107440.447
|
3,220983550135
|
|
1/196ν
|
|
|
|
1/14
|
1/7V
|
|
7p
|
3/2
|
107440.447
|
3,220983550135
|
|
1/196ν
|
|
|
|
1/14
|
1/7V
|
|
7d
|
5/2
|
107440.4498
|
3,220983634077
|
|
1/392ν
|
|
|
|
1/14
|
1/7V
|
|
7f
|
5/2
|
107440.4518
|
3,220983694035
|
|
1/392ν
|
|
|
|
1/14
|
1/7V
|
|
7f
|
7/2
|
107440.4532
|
3,220983736006
|
|
1/588ν
|
|
|
|
1/14
|
1/7V
|
|
7g
|
7/2
|
107440.4532
|
3,220983736006
|
|
1/588ν
|
|
|
|
1/14
|
1/7V
|
|
7g
|
9/2
|
107440.4541
|
3,220983762988
|
|
1/784ν
|
|
|
|
1/14
|
1/7V
|
|
7h
|
9/2
|
107440.4541
|
3,220983762988
|
|
1/784ν
|
|
|
|
1/14
|
1/7V
|
|
7h
|
11/2
|
107440.4547
|
3,220983780975
|
|
1/980ν
|
|
|
|
1/14
|
1/7V
|
|
7i
|
11/2
|
107440.4547
|
3,220983780975
|
|
1/980ν
|
|
|
|
1/14
|
1/7V
|
|
7i
|
13/2
|
107440.4551
|
3,220983792967
|
|
1/1176ν
|
|
|
|
1/14
|
1/7V
|
|
8p
|
1/2
|
107965.0491
|
3,236709574
|
|
0
|
|
|
|
0
|
1/8V
|
|
8s
|
1/2
|
107965.0497
|
3,236710743331
|
0.10275275468
|
0
|
1/64
|
63/2
|
0.4921
|
0
|
1/8V
|
|
8d
|
3/2
|
107965.0548
|
3,236710896225
|
|
1/256ν
|
|
|
|
1/16V
|
1/8V
|
|
8p
|
3/2
|
107965.0548
|
3,236710896225
|
|
1/256ν
|
|
|
|
1/16V
|
1/8V
|
|
8d
|
5/2
|
107965.0567
|
3,236710953186
|
|
1/512ν
|
|
|
|
1/16V
|
1/8V
|
|
8f
|
5/2
|
107965.0587
|
3,236711013145
|
|
1/512ν
|
|
|
|
1/16V
|
1/8V
|
|
8f
|
7/2
|
107965.0597
|
3,236711043124
|
|
1/768ν
|
|
|
|
1/16V
|
1/8V
|
|
8g
|
7/2
|
107965.0597
|
3,236711043124
|
|
1/768ν
|
|
|
|
1/16V
|
1/8V
|
|
8g
|
9/2
|
107965.0603
|
3,236711061111
|
|
1/1024ν
|
|
|
|
1/16V
|
1/8V
|
|
8h
|
9/2
|
107965.0603
|
3,236711061111
|
|
1/1024ν
|
|
|
|
1/16V
|
1/8V
|
|
8h
|
11/2
|
107965.0606
|
3,236711070105
|
|
1/1280ν
|
|
|
|
1/16V
|
1/8V
|
|
8i
|
11/2
|
107965.0606
|
3,236711070105
|
|
1/1280ν
|
|
|
|
1/16V
|
1/8V
|
|
8i
|
13/2
|
107965.0609
|
3,236711079099
|
|
1/1536ν
|
|
|
|
1/16V
|
1/8V
|
|
8k
|
13/2
|
107965.0609
|
3,236711079099
|
|
1/1536ν
|
|
|
|
1/16V
|
1/8V
|
|
8k
|
15/2
|
107965.0611
|
3,236711085095
|
|
1/1792ν
|
|
|
|
1/16V
|
1/8V
|
|
9p
|
1/2
|
108324.7221
|
3,247494516
|
|
0
|
|
|
|
0
|
1/9V
|
|
9s
|
1/2
|
108324.7225
|
3,247493462545
|
0.08118736172
|
0
|
1/81
|
80/2
|
0.4938
|
0
|
1/9V
|
|
9d
|
3/2
|
108324.7261
|
3,247493570471
|
|
1/324ν
|
|
|
|
1/18V
|
1/9V
|
|
9p
|
3/2
|
108324.7262
|
3,247493573469
|
|
1/324ν
|
|
|
|
1/18V
|
1/9V
|
|
9d
|
5/2
|
108324.7275
|
3,247493612442
|
|
1/648ν
|
|
|
|
1/18V
|
1/9V
|
|
9f
|
5/2
|
108324.7275
|
3,247493612442
|
|
1/648ν
|
|
|
|
1/18V
|
1/9V
|
|
9f
|
7/2
|
108324.7282
|
3,247493633427
|
|
1/972ν
|
|
|
|
1/18V
|
1/9V
|
|
9g
|
7/2
|
108324.7282
|
3,247493633427
|
|
1/972ν
|
|
|
|
1/18V
|
1/9V
|
|
9g
|
9/2
|
108324.7286
|
3,247493645419
|
|
1/1296ν
|
|
|
|
1/18V
|
1/9V
|
|
9h
|
9/2
|
108324.7286
|
3,247493645419
|
|
1/1296ν
|
|
|
|
1/18V
|
1/9V
|
|
9h
|
11/2
|
108324.7288
|
3,247493651415
|
|
1/1620ν
|
|
|
|
1/18V
|
1/9V
|
|
9i
|
11/2
|
108324.7288
|
3,247493651415
|
|
1/1620ν
|
|
|
|
1/18V
|
1/9V
|
|
9i
|
13/2
|
108324.729
|
3,247493657410
|
|
1/1944ν
|
|
|
|
1/18V
|
1/9V
|
|
9k
|
13/2
|
108324.729
|
3,247493657410
|
|
1/1944ν
|
|
|
|
1/18V
|
1/9V
|
|
9k
|
15/2
|
108324.7292
|
3,247493663406
|
|
1/2268ν
|
|
|
|
1/18V
|
1/9V
|
|
9l
|
15/2
|
108324.7292
|
3,247493663406
|
|
1/2268ν
|
|
|
|
1/18V
|
1/9V
|
|
9l
|
17/2
|
108324.7293
|
3,247493666404
|
|
1/2592ν
|
|
|
|
1/18V
|
1/9V
|
|
10p
|
1/2
|
108581.9925
|
3,255206303
|
|
0
|
|
|
|
0
|
1/10V
|
|
10s
|
1/2
|
108581.9928
|
3,255206232060
|
0,065761763
|
0
|
1/100
|
99/2
|
0.4949
|
0
|
1/10V
|
|
10d
|
3/2
|
108581.9954
|
3,255206310006
|
|
1/400ν
|
|
|
|
1/20V
|
1/10V
|
|
10p
|
3/2
|
108581.9954
|
3,255206310006
|
|
1/400ν
|
|
|
|
1/20V
|
1/10V
|
|
10d
|
5/2
|
108581.9964
|
3,255206339985
|
|
1/800ν
|
|
|
|
1/20V
|
1/10V
|
|
10f
|
5/2
|
108581.9964
|
3,255206339985
|
|
1/800ν
|
|
|
|
1/20V
|
1/10V
|
|
10f
|
7/2
|
108581.9969
|
3,255206354975
|
|
1/1200ν
|
|
|
|
1/20V
|
1/10V
|
|
10g
|
7/2
|
108581.9969
|
3,255206354975
|
|
1/1200ν
|
|
|
|
1/20V
|
1/10V
|
|
10g
|
9/2
|
108581.9972
|
3,255206363968
|
|
1/1600ν
|
|
|
|
1/20V
|
1/10V
|
|
10h
|
9/2
|
108581.9972
|
3,255206363968
|
|
1/1600ν
|
|
|
|
1/20V
|
1/10V
|
|
10h
|
11/2
|
108581.9974
|
3,255206369964
|
|
1/2000ν
|
|
|
|
1/20V
|
1/10V
|
|
10i
|
11/2
|
108581.9974
|
3,255206369964
|
|
1/2000ν
|
|
|
|
1/20V
|
1/10V
|
|
10i
|
13/2
|
108581.9975
|
3,255206372962
|
|
1/2400ν
|
|
|
|
1/20V
|
1/10V
|
|
10k
|
13/2
|
108581.9975
|
3,255206372962
|
|
1/2400ν
|
|
|
|
1/20V
|
1/10V
|
|
10k
|
15/2
|
108581.9976
|
3,255206375960
|
|
1/2800ν
|
|
|
|
1/20V
|
1/10V
|
|
10l
|
15/2
|
108581.9976
|
3,255206375960
|
|
1/2800ν
|
|
|
|
1/20V
|
1/10V
|
|
10l
|
17/2
|
108581.9977
|
3,255206378958
|
|
1/3200ν
|
|
|
|
1/20V
|
1/10V
|
|
10m
|
17/2
|
108581.9977
|
3,255206378958
|
|
1/3200ν
|
|
|
|
1/20V
|
1/10V
|
|
10m
|
19/2
|
108581.9978
|
3,255206381956
|
|
1/3600ν
|
|
|
|
1/20V
|
1/10V
|
|
11p
|
1/2
|
108772.3433
|
3,260910470
|
|
0
|
|
|
|
0
|
1/11V
|
|
11s
|
1/2
|
108772.3435
|
3,260912802449
|
0.05434856446
|
0
|
1/121
|
120/2
|
0.4958
|
0
|
1/11V
|
|
11d
|
3/2
|
108772.3455
|
3,260912862408
|
|
1/484ν
|
|
|
|
1/22V
|
1/11V
|
|
11p
|
3/2
|
108772.3455
|
3,260912862408
|
|
1/484ν
|
|
|
|
1/22V
|
1/11V
|
|
11d
|
5/2
|
108772.3463
|
3,260912886391
|
|
1/968ν
|
|
|
|
1/22V
|
1/11V
|
|
11f
|
5/2
|
108772.3463
|
3,260912886391
|
|
1/968ν
|
|
|
|
1/22V
|
1/11V
|
|
11f
|
7/2
|
108772.3466
|
3,260912895385
|
|
1/1452ν
|
|
|
|
1/22V
|
1/11V
|
|
11g
|
7/2
|
108772.3466
|
3,260912895385
|
|
1/1452ν
|
|
|
|
1/22V
|
1/11V
|
|
11g
|
9/2
|
108772.3468
|
3,260912901381
|
|
1/1936ν
|
|
|
|
1/22V
|
1/11V
|
|
11h
|
9/2
|
108772.3468
|
3,260912901381
|
|
1/1936ν
|
|
|
|
1/22V
|
1/11V
|
|
11h
|
11/2
|
108772.347
|
3,260912907376
|
|
1/2420ν
|
|
|
|
1/22V
|
1/11V
|
|
11i
|
11/2
|
108772.347
|
3,260912907376
|
|
1/2420ν
|
|
|
|
1/22V
|
1/11V
|
|
11i
|
13/2
|
108772.3471
|
3,260912910374
|
|
1/2904ν
|
|
|
|
1/22V
|
1/11V
|
|
11k
|
13/2
|
108772.3471
|
3,260912910374
|
|
1/2904ν
|
|
|
|
1/22V
|
1/11V
|
|
11k
|
15/2
|
108772.3472
|
3,260912913372
|
|
1/3388ν
|
|
|
|
1/22V
|
1/11V
|
|
11l
|
15/2
|
108772.3472
|
3,260912913372
|
|
1/3388ν
|
|
|
|
1/22V
|
1/11V
|
|
11l
|
17/2
|
108772.3472
|
3,260912913372
|
|
1/3872ν
|
|
|
|
1/22V
|
1/11V
|
|
11m
|
17/2
|
108772.3472
|
3,260912913372
|
|
1/3872ν
|
|
|
|
1/22V
|
1/11V
|
|
11m
|
19/2
|
108772.3473
|
3,260912916370
|
|
1/4356ν
|
|
|
|
1/22V
|
1/11V
|
|
11n
|
19/2
|
108772.3473
|
3,260912916370
|
|
1/4356ν
|
|
|
|
1/22V
|
1/11V
|
|
11n
|
21/2
|
108772.3473
|
3,260912916370
|
|
1/4840ν
|
|
|
|
1/22V
|
1/11V
|
|
12d
|
3/2
|
108917.12
|
3,265253092703
|
|
1/ν
|
|
|
|
1/22V
|
1/12V
|
|
12p
|
1/2
|
108917.1207
|
3,265250631
|
|
0
|
|
|
|
0
|
1/12V
|
|
12s
|
1/2
|
108917.1208
|
3,265253116686
|
0.04566789097
|
0
|
1/144
|
143/2
|
0.4965
|
0
|
1/12V
|
|
12d
|
5/2
|
108917.121
|
3,265253122682
|
|
1/ν
|
|
|
|
1/24V
|
1/12V
|
|
12o
|
21/2
|
108917.1238
|
3,265253206624
|
|
1/ν
|
|
|
|
1/24V
|
1/12V
|
|
12o
|
23/2
|
108917.1238
|
3,265253206624
|
|
1/ν
|
|
|
|
1/24V
|
1/12V
|
|
12p
|
3/2
|
108917.1238
|
3,265253206624
|
|
1/ν
|
|
|
|
1/24V
|
1/12V
|
|
13p
|
1/2
|
109029.7914
|
3,268632724
|
|
0
|
|
|
|
0
|
1/13V
|
|
13s
|
1/2
|
109029.7916
|
3,268630902273
|
0.038912285
|
0
|
1/169
|
168/2
|
0.4970
|
0
|
1/13V
|
|
13q
|
23/2
|
109029.7939
|
3,268630971226
|
|
1/ν
|
|
|
|
1/26V
|
1/13V
|
|
13q
|
25/2
|
109029.7939
|
3,268630971226
|
|
1/ν
|
|
|
|
1/26V
|
1/13V
|
|
13p
|
3/2
|
109029.7939
|
3,268630971226
|
|
1/ν
|
|
|
|
1/26V
|
1/13V
|
|
14p
|
1/2
|
109119.1922
|
3,271307751
|
|
0
|
|
|
|
0
|
1/14V
|
|
14s
|
1/2
|
109119.1923
|
3,271311067817
|
|
0
|
|
|
|
0
|
1/14V
|
|
14r
|
25/2
|
109119.1942
|
3,271311124778
|
|
1/ν
|
|
|
|
1/28V
|
1/14V
|
|
14r
|
27/2
|
109119.1942
|
3,271311124778
|
|
1/ν
|
|
|
|
1/28V
|
1/14V
|
|
14p
|
3/2
|
109119.1942
|
3,271311124778
|
|
1/ν
|
|
|
|
1/28V
|
1/14V
|
|
15p
|
1/2
|
109191.3162
|
3,273486670
|
|
0
|
|
|
|
0
|
1/15V
|
|
15s
|
1/2
|
109191.3163
|
3,273473290928
|
0.02922745
|
0
|
1/225
|
224/2
|
0.4977
|
0
|
1/15V
|
|
15t
|
27/2
|
109191.3178
|
3,273473335897
|
|
1/ν
|
|
|
|
1/30V
|
1/15V
|
|
15t
|
29/2
|
109191.3178
|
3,273473335897
|
|
1/ν
|
|
|
|
1/30V
|
1/15V
|
|
15p
|
3/2
|
109191.3178
|
3,273473335897
|
|
1/ν
|
|
|
|
1/30V
|
1/15V
|
|
16p
|
1/2
|
109250.3443
|
3,275239053
|
|
0
|
|
|
|
0
|
1/16V
|
|
16s
|
1/2
|
109250.3444
|
3,275242908837
|
|
0
|
1/256
|
255/2
|
0.4980
|
0
|
1/16V
|
|
16u
|
29/2
|
109250.3457
|
3,275242947810
|
|
1/ν
|
|
|
|
1/32V
|
1/16V
|
|
16u
|
31/2
|
109250.3457
|
3,275242947810
|
|
1/ν
|
|
|
|
1/32V
|
1/16V
|
|
16p
|
3/2
|
109250.3457
|
3,275242947810
|
|
1/ν
|
|
|
|
1/32V
|
1/16V
|
|
17p
|
1/2
|
109299.2654
|
3,276706774
|
|
0
|
|
|
|
0
|
1/17V
|
|
17s
|
1/2
|
109299.2655
|
3,276709526510
|
0.022754935
|
0
|
1/289
|
288/2
|
0.4982
|
0
|
1/17V
|
|
17v
|
31/2
|
109299.2665
|
3,276709556489
|
|
1/ν
|
|
|
|
1/34V
|
1/17V
|
|
17v
|
33/2
|
109299.2665
|
3,276709556489
|
|
1/ν
|
|
|
|
1/34V
|
1/17V
|
|
17p
|
3/2
|
109299.2665
|
3,276709556489
|
|
1/ν
|
|
|
|
1/34V
|
1/17V
|
|
18p
|
1/2
|
109340.2617
|
3,277924908
|
|
0
|
|
|
|
0
|
1/18V
|
|
18s
|
1/2
|
109340.2618
|
3,277938564657
|
0.02029684
|
0
|
1/324
|
323/2
|
0.4984
|
0
|
1/18V
|
|
18w
|
33/2
|
109340.2627
|
3,277938591638
|
|
1/ν
|
|
|
|
1/36V
|
1/18V
|
|
18w
|
35/2
|
109340.2627
|
3,277938591638
|
|
1/ν
|
|
|
|
1/36V
|
1/18V
|
|
18p
|
3/2
|
109340.2627
|
3,277938591638
|
|
1/ν
|
|
|
|
1/36V
|
1/18V
|
|
19s
|
1/2
|
109374.9569
|
3,278978697582
|
0.0182165548
|
0
|
1/361
|
360/2
|
0.4986
|
0
|
1/19V
|
|
19p
|
1/2
|
109374.9569
|
3,278964620
|
|
0
|
|
|
|
0
|
1/19V
|
|
19p
|
3/2
|
109374.9569
|
3,278964620
|
|
1/ν
|
|
|
|
1/38V
|
1/19V
|
|
19x
|
35/2
|
109374.9577
|
3,278978721565
|
|
1/ν
|
|
|
|
1/38V
|
1/19V
|
|
19x
|
37/2
|
109374.9577
|
3,278978721565
|
|
1/ν
|
|
|
|
1/38V
|
1/19V
|
|
20s
|
1/2
|
109404.5791
|
3,279861452
|
0.01644044075
|
0
|
1/400
|
399/2
|
0.4987
|
0
|
1/20V
|
|
20p
|
1/2
|
109404.5791
|
3,279861452
|
|
0
|
|
|
|
0
|
1/20V
|
|
20p
|
3/2
|
109404.5798
|
3,279866769777
|
|
1/ν
|
|
|
|
1/40V
|
1/20V
|
|
20y
|
37/2
|
109404.5798
|
3,279866769777
|
|
1/ν
|
|
|
|
1/40V
|
1/20V
|
|
20y
|
39/2
|
109404.5798
|
3,279866769777
|
|
1/ν
|
|
|
|
1/40V
|
1/20V
|
|
21p
|
1/2
|
109430.0616
|
3,280615171
|
|
0
|
|
|
|
0
|
1/21V
|
|
21s
|
1/2
|
109430.06164
|
3,280630696117
|
0.01491196439
|
0
|
1/441
|
440/2
|
0.4988
|
0
|
1/21V
|
|
21z
|
41/2
|
109430.0622
|
3,280630712905
|
|
1/ν
|
|
|
|
1/42V
|
1/21V
|
|
22p
|
1/2
|
109452.1571
|
3,281293101339
|
|
0
|
|
|
|
0
|
1/22V
|
|
22s
|
1/2
|
109452.15714
|
3,281293102538
|
0.01358714111
|
0
|
1/484
|
483/2
|
0.4989
|
0
|
1/22V
|
|
(?)
|
43/2
|
109452.1576
|
3,281293116329
|
|
1/ν
|
|
|
|
1/44V
|
1/22V
|
|
23p
|
1/2
|
109471.4337
|
3,281870999265
|
|
0
|
|
|
|
0
|
1/23V
|
|
23s
|
1/2
|
109471.43375
|
3,281871000764
|
0.01243133516
|
0
|
1/529
|
528/2
|
0.4990
|
0
|
1/23V
|
|
(?)
|
45/2
|
109471.4342
|
3,281871014255
|
|
1/ν
|
|
|
|
1/46V
|
1/23V
|
|
24p
|
1/2
|
109488.3513
|
3,282378176151
|
|
0
|
|
|
|
0
|
1/24V
|
|
24s
|
1/2
|
109488.3514
|
3,282378179149
|
0.01141697274
|
0
|
1/576
|
575/2
|
0.4991
|
0
|
1/24V
|
|
(?)
|
47/2
|
109488.3517
|
3,282378188143
|
|
1/ν
|
|
|
|
1/48V
|
1/24V
|
|
25p
|
1/2
|
109503.2797
|
3,282825718321
|
|
0
|
|
|
|
0
|
1/25V
|
|
25s
|
1/2
|
109503.27974
|
3,282825719521
|
0.01052188208
|
0
|
1/625
|
624/2
|
0.499199
|
0
|
1/25V
|
|
(?)
|
49/2
|
109503.2801
|
3,282825730313
|
|
1/ν
|
|
|
|
1/50V
|
1/25V
|
|
26p
|
1/2
|
109516.5189
|
3,283222619550
|
|
0
|
|
|
|
0
|
1/26V
|
|
26s
|
1/2
|
109516.519
|
3,283222622548
|
0.00972807144
|
0
|
1/676
|
675/2
|
0.499260
|
0
|
1/26V
|
|
27s
|
1/2
|
109528.3146
|
3,283576245738
|
0.00902081796
|
0
|
1/729
|
728/2
|
0.499313
|
0
|
1/27V
|
|
27p
|
1/2
|
109528.3146
|
3,283576245738
|
|
0
|
|
|
|
0
|
1/27V
|
|
28p
|
1/2
|
109538.869
|
3,283892658688
|
|
0
|
|
|
|
0
|
1/28V
|
|
28s
|
1/2
|
109538.8691
|
3,283892661685
|
0.00838797997
|
0
|
1/784
|
783/2
|
0.499362
|
0
|
1/28V
|
|
29s
|
1/2
|
109548.3507
|
3,2841769129
|
0.00781947241
|
0
|
1/841
|
840/2
|
0.499405
|
0
|
1/29V
|
|
29p
|
1/2
|
109548.3507
|
3,2841769129
|
|
0
|
|
|
|
0
|
1/29V
|
|
30p
|
1/2
|
109556.9
|
3,28443321447
|
|
0
|
|
|
|
0
|
1/30V
|
|
30s
|
1/2
|
109556.9
|
3.28443321447
|
0.00730686255
|
0
|
1/900
|
899/2
|
0.499444
|
0
|
1/30V
|
|
31s
|
1/2
|
109564.635
|
3,28466510393
|
0.00684305546
|
0
|
1/961
|
960/2
|
0.499479
|
0
|
1/31V
|
|
31p
|
1/2
|
109564.6354
|
3,28466511592
|
|
0
|
|
|
|
0
|
1/31V
|
|
32p
|
1/2
|
109571.657
|
3,28487561819
|
|
0
|
|
|
|
0
|
1/32V
|
|
32s
|
1/2
|
109571.657
|
3,28487561819
|
0.00642204716
|
0
|
1/1024
|
1023/2
|
0.499511
|
0
|
1/32V
|
|
33s
|
1/2
|
109578.05
|
3,28506727551
|
0.00603872938
|
0
|
1/1089
|
1088/2
|
0.499540
|
0
|
1/33V
|
|
33p
|
1/2
|
109578.05
|
3,28506727551
|
|
0
|
|
|
|
0
|
1/33V
|
|
34p
|
1/2
|
109583.887
|
3,28524226437
|
|
0
|
|
|
|
0
|
1/34V
|
|
34s
|
1/2
|
109583.887
|
3,28524226437
|
0.00568873382
|
0
|
1/1156
|
1155/2
|
0.499567
|
0
|
1/34V
|
|
35s
|
1/2
|
109589.2314
|
3,28540248545
|
0.00536830718
|
0
|
1/1225
|
1224/2
|
0.499591
|
0
|
1/35V
|
|
35p
|
1/2
|
109589.2314
|
3,28540248545
|
|
0
|
|
|
|
0
|
1/35V
|
|
36p
|
1/2
|
109594.1363
|
3,28554953065
|
|
0
|
|
|
|
0
|
1/36V
|
|
36s
|
1/2
|
109594.1363
|
3,28554953065
|
0.00507421010
|
0
|
1/1296
|
1295/2
|
0.499613
|
0
|
1/36V
|
|
37s
|
1/2
|
109598.649
|
3,28568481799
|
0.00480363498
|
0
|
1/1369
|
1368/2
|
0.499634
|
0
|
1/37V
|
|
37p
|
1/2
|
109598.649
|
3,28568481799
|
|
0
|
|
|
|
0
|
1/37V
|
|
38p
|
1/2
|
109602.81
|
3,28580956163
|
|
0
|
|
|
|
0
|
1/38V
|
|
38s
|
1/2
|
109602.81
|
3,28580956163
|
0.00455413871
|
0
|
1/1444
|
1443/2
|
0.499653
|
0
|
1/38V
|
|
39s
|
1/2
|
109606.655
|
3,28592483183
|
0.00432358731
|
0
|
1/1521
|
1520/2
|
0.499671
|
0
|
1/39V
|
|
39p
|
1/2
|
109606.655
|
3,28592483183
|
|
0
|
|
|
|
0
|
1/39V
|
|
40p
|
1/2
|
109610.2156
|
3,28603157593
|
|
0
|
|
|
|
0
|
1/40V
|
|
40s
|
1/2
|
109610.2156
|
3,28603157593
|
0.00411011018
|
0
|
1/1600
|
1599/2
|
0.499687
|
0
|
1/40V
|
|
41p
|
1/2
|
109613.5187
|
3,28613060038
|
|
0
|
|
|
|
0
|
1/41V
|
|
41s
|
1/2
|
109613.5187
|
3,28613060038
|
0.00391206204
|
0
|
1/1681
|
1680/2
|
0.499702
|
0
|
1/41V
|
|
42s
|
1/2
|
109616.5886
|
3,28622263367
|
0.00372799109
|
0
|
1/1764
|
1763/2
|
0.499716
|
0
|
1/42V
|
|
42p
|
1/2
|
109616.5886
|
3,28622263367
|
|
0
|
|
|
|
0
|
1/42V
|
|
43p
|
1/2
|
109619.4469
|
3,28630832334
|
|
0
|
|
|
|
0
|
1/43V
|
|
43s
|
1/2
|
109619.4469
|
3,28630832334
|
0.00355661238
|
0
|
1/1849
|
1848/2
|
0.499729
|
0
|
1/43V
|
|
44s
|
1/2
|
109622.1125
|
3,28638823602
|
|
0
|
|
|
|
0
|
1/44V
|
|
44p
|
1/2
|
109622.1125
|
3,28638823602
|
|
0
|
|
|
|
0
|
1/44V
|
|
45p
|
1/2
|
109624.6024
|
3,28646288134
|
|
0
|
|
|
|
0
|
1/45V
|
|
45s
|
1/2
|
109624.6024
|
3,28646288134
|
0.00324749446
|
0
|
1/2025
|
2024/2
|
0.499752
|
0
|
1/45V
|
|
46s
|
1/2
|
109626.9316
|
3,286532709
|
0.00310783379
|
0
|
1/2116
|
2115/2
|
0.499763
|
0
|
1/46V
|
|
46p
|
1/2
|
109626.9316
|
3,286532709
|
|
0
|
|
|
|
0
|
1/46V
|
|
47p
|
1/2
|
109629.1138
|
3,28659812971
|
|
0
|
|
|
|
0
|
1/47V
|
|
47s
|
1/2
|
109629.1138
|
3.28659812971
|
0.00297699244
|
0
|
1/2209
|
2208/2
|
0.499773
|
0
|
1/47V
|
|
48s
|
1/2
|
109631.161
|
3,28665950322
|
0.00285424318
|
0
|
1/2304
|
2303/2
|
0.499782
|
0
|
1/48V
|
|
48p
|
1/2
|
109631.161
|
3,28665950322
|
|
0
|
|
|
|
0
|
1/48V
|
|
49p
|
1/2
|
109633.0842
|
3,28671715931
|
|
0
|
|
|
|
0
|
1/49V
|
|
49s
|
1/2
|
109633.0842
|
3,28671715931
|
0.00273893223
|
0
|
1/2401
|
2400/2
|
0.499791
|
0
|
1/49V
|
|
50s
|
1/2
|
109634.8931
|
3,28677138877
|
0.00263047052
|
0
|
1/2500
|
2499/2
|
0.499799
|
0
|
1/50V
|
|
50p
|
1/2
|
109634.8931
|
3,28677138877
|
|
0
|
|
|
|
0
|
1/50V
|
|
37. Таблица «Уровни
энергий электрона
в
атоме водорода
частоты излучаемых фотонов νf
и длины волн
λ f фотонов
при различных энергетических
переходах»
|
|
Ниж
няя
орби
та
x
|
Нижний
уровень
энергии
Ex
см-1
|
Верх
няя
орби
та
y
|
Верхний
уровень
энергии
Ey
см-1
|
Разница
в уровнях
энергии
ΔE
см-1
|
Частота излучаемого фотона
νf = ΔE х С
1010Гц
|
Длина волны
фотона
λ f = С/ νf
х 10-10м
|
|
1s1/2
|
0
|
21р1/2
|
109430.0616
|
109430.0616
|
328061,5171
|
913.83
|
|
1s1/2
|
0
|
20р1/2
|
109404.5791
|
109404.5791
|
327986,1452
|
914.04
|
|
1s1/2
|
0
|
19р1/2
|
109374.9569
|
109374.9569
|
327896,4620
|
914.29
|
|
1s1/2
|
0
|
18р1/2
|
109340.2617
|
109340.2617
|
327792,4908
|
914.58
|
|
1s1/2
|
0
|
17р1/2
|
109299.2654
|
109299.2654
|
327670,6774
|
914.92
|
|
1s1/2
|
0
|
16р1/2
|
109250.3443
|
109250.3443
|
327523,9053
|
915.33
|
|
1s1/2
|
0
|
15р1/2
|
109191.3162
|
109191.3162
|
327348,6670
|
915.82
|
|
1s1/2
|
0
|
14р1/2
|
109119.1922
|
109119.1922
|
327130,7751
|
916.43
|
|
1s1/2
|
0
|
13р1/2
|
109029.7914
|
109029.7914
|
326863,2724
|
917.18
|
|
1s1/2
|
0
|
12р1/2
|
108917.1207
|
108917.1207
|
326525,0631
|
918.13
|
|
1s1/2
|
0
|
11р1/2
|
108772.3433
|
108772.3433
|
326091,0470
|
919.352
|
|
1s1/2
|
0
|
10р1/2
|
108581.9925
|
108581.9925
|
325520,6303
|
920.963
|
|
1s1/2
|
0
|
9р1/2
|
108324.7221
|
108324.7221
|
324749,4516
|
923.15
|
|
1s1/2
|
0
|
8р1/2
|
107965.0491
|
107965.0491
|
323670,9574
|
926.226
|
|
1s1/2
|
0
|
7р3/2
|
107440.447
|
107440.447
|
322098,4157
|
930.748
|
|
1s1/2
|
0
|
7р1/2
|
107440.4385
|
107440.4385
|
322098,4157
|
930.748
|
|
1s1/2
|
0
|
6р3/2
|
106632.162
|
106632.162
|
319675,3009
|
937.803
|
|
1s1/2
|
0
|
6р1/2
|
106632.1485
|
106632.1485
|
319675,1305
|
937.8035
|
|
1s1/2
|
0
|
5р3/2
|
105291.652
|
105291.652
|
315656,4331
|
949.7429
|
|
1s1/2
|
0
|
5р1/2
|
105291.629
|
105291.629
|
315656,3667
|
949.7431
|
|
1s1/2
|
0
|
4р3/2
|
102823.894
|
102823.894
|
308258,2766
|
972.5366
|
|
1s1/2
|
0
|
4р1/2
|
102823.849
|
102823.849
|
308258,1498
|
972.537
|
|
1s1/2
|
0
|
3р3/2
|
97492.321
|
97492.321
|
292274,6267
|
1025.7218
|
|
1s1/2
|
0
|
3р1/2
|
97492.211
|
97492.211
|
292274,3133
|
1025.7229
|
|
1s1/2
|
0
|
2р3/2
|
82259.285
|
82259.285
|
246607,1385
|
1215.6682
|
|
1s1/2
|
0
|
2р1/2
|
82258.919
|
82258.919
|
236490,2576
|
1215.6736
|
|
2р1/2
|
82258.919
|
12d3/2
|
108917.12
|
26658,201
|
79919,42052
|
3750.1249
|
|
2р1/2
|
82258.919
|
12s1/2
|
108917.1208
|
26658,2018
|
79919,42292
|
3750.125
|
|
2s1/2
|
82258.954
|
12d5/2
|
108917.121
|
26658,201
|
79919,27604
|
3750.1298
|
|
2s1/2
|
82258.954
|
12p3/2
|
108917.1238
|
26658,2018
|
79919,27843
|
3750.1299
|
|
2s1/2
|
82258.954
|
12d3/2
|
108917.12
|
26658,201
|
|
3750.12991
|
|
2s1/2
|
82258.954
|
12p1/2
|
108917.1207
|
26658,2018
|
|
3750.13
|
|
2p3/2
|
82259.285
|
12d5/2
|
108917.121
|
26658,201
|
|
3750.176
|
|
2p3/2
|
82259.285
|
12d3/2
|
108917.12
|
26658,2018
|
|
3750.1764
|
|
2p3/2
|
82259.285
|
12s1/2
|
108917.1208
|
26658,201
|
|
3750.1766
|
|
2p1/2
|
82258.919
|
11d3/2
|
108772.3455
|
26513,4265
|
|
3770.603
|
|
2p1/2
|
82258.919
|
11s1/2
|
108772.3435
|
26513,4245
|
|
3770.6033
|
|
2s1/2
|
82258.954
|
11p3/2
|
108772.3455
|
26513.3913
|
|
3770.608
|
|
2s1/2
|
82258.954
|
11p1/2
|
108772.3433
|
26513.3893
|
|
3770.6083
|
|
2p3/2
|
82259.285
|
11d5/2
|
108772.3463
|
26513.061299
|
|
3770.655
|
|
2p3/2
|
82259.285
|
11d3/2
|
108772.3455
|
26513,0585
|
|
3770.6551
|
|
2p3/2
|
82259.285
|
11s1/2
|
108772.3435
|
26513,0585
|
|
3770.6553
|
|
2p1/2
|
82258.919
|
10s1/2
|
108581.9928
|
26323.0423
|
|
3770.871
|
|
2s1/2
|
82258.954
|
10d5/2
|
108581.9964
|
26323.0424
|
|
3770.875
|
|
2s1/2
|
82258.954
|
10p3/2
|
108581.9954
|
26323.0414
|
|
3770.8751
|
|
2s1/2
|
82258.954
|
10s1/2
|
108581.9928
|
26323.0388
|
|
3770.8755
|
|
2s1/2
|
82258.954
|
10p1/2
|
108581.9925
|
26323.038499
|
|
3770.8756
|
|
2p3/2
|
82259.285
|
10d5/2
|
108581.9964
|
26322.7114
|
|
3770.9226
|
|
2p3/2
|
82259.285
|
10d3/2
|
108581.9954
|
26322.710399
|
|
3770.9228
|
|
2p3/2
|
82259.285
|
10s1/2
|
108581.9928
|
26322.7078
|
|
3770.923
|
|
2p1/2
|
82258.919
|
10d3/2
|
108581.9954
|
26323.0449
|
|
3797.87
|
|
2p1/2
|
82258.919
|
9d3/2
|
108324.7261
|
26065.8071
|
|
3835.355
|
|
2p1/2
|
82258.919
|
9s1/2
|
108324.7225
|
26065.8035
|
|
3835.356
|
|
2s1/2
|
82258.954
|
9p3/2
|
108324.7262
|
26065.7722
|
|
3835.361
|
|
2s1/2
|
82258.954
|
9p1/2
|
108324.7221
|
26065.7681
|
|
3835.362
|
|
2p3/2
|
82259.285
|
9d5/2
|
108324.7275
|
26065.442499
|
|
3835.4095
|
|
2p3/2
|
82259.285
|
9d3/2
|
108324.7261
|
26065.441099
|
|
3835.4097
|
|
2p3/2
|
82259.285
|
9s1/2
|
108324.7225
|
26065.4375
|
|
3835.41
|
|
2p1/2
|
82258.919
|
8d3/2
|
107965.0548
|
25706.1358
|
|
3889.019
|
|
2p1/2
|
82258.919
|
8s1/2
|
107965.0497
|
25706.1307
|
|
3889.02
|
|
2s1/2
|
82258.954
|
8p3/2
|
107965.0548
|
25706.1008
|
|
3889.025
|
|
2s1/2
|
82258.954
|
8p1/2
|
107965.0491
|
25706.0951
|
|
3889.026
|
|
2p3/2
|
82259.285
|
8d5/2
|
107965.0567
|
25705.771699
|
|
3889.075
|
|
2p3/2
|
82259.285
|
8d3/2
|
107965.0548
|
25705.769799
|
|
3889.0752
|
|
2p3/2
|
82259.285
|
8s1/2
|
107965.0497
|
25705.7647
|
|
3889.076
|
|
2p1/2
|
82258.919
|
7d3/2
|
107440.447
|
25181.528
|
|
3970.042
|
|
2p1/2
|
82258.919
|
7s1/2
|
107440.439
|
25181.520
|
|
3970.043
|
|
2s1/2
|
82258.954
|
7p3/2
|
107440.447
|
25181.4930
|
|
3970.047
|
|
2s1/2
|
82258.954
|
7p1/2
|
107440.4385
|
25181.4845
|
|
3970.049
|
|
2p3/2
|
82259.285
|
7d5/2
|
107440.4498
|
25181.1648
|
|
3970.099
|
|
2p3/2
|
82259.285
|
7d3/2
|
107440.447
|
25181.161999
|
|
3970.0995
|
|
2p3/2
|
82259.285
|
7s1/2
|
107440.439
|
25181.153999
|
|
3970.1
|
|
2p1/2
|
82258.919
|
6d3/2
|
106632.162
|
24373.243
|
|
4101.702
|
|
2p1/2
|
82258.919
|
6s1/2
|
106632.151
|
24373.232
|
|
4101.704
|
|
2s1/2
|
82258.954
|
6p3/2
|
106632.162
|
24373.208
|
|
4101.7081
|
|
2s1/2
|
82258.954
|
6p1/2
|
106632.1485
|
24373.194499
|
|
4101.7104
|
|
2p3/2
|
82259.285
|
6d5/2
|
106632.167
|
24372.881999
|
|
4101.763
|
|
2p3/2
|
82259.285
|
6d3/2
|
106632.162
|
24372.876999
|
|
4101.7638
|
|
2p3/2
|
82259.285
|
6s1/2
|
106632.151
|
24372.865999
|
|
4101.7658
|
|
2p1/2
|
82258.919
|
5d3/2
|
105291.652
|
23032.735
|
|
4340.4268
|
|
2p1/2
|
82258.919
|
5s1/2
|
105291.631
|
23032.712
|
|
4340.4308
|
|
2s1/2
|
82258.954
|
5p3/2
|
105291.652
|
23032.6980
|
|
4340.4335
|
|
2s1/2
|
82258.954
|
5p1/2
|
105291.629
|
23032.6750
|
|
4340.4379
|
|
2p3/2
|
82259.285
|
5d5/2
|
105291.6598
|
23032.374799
|
|
4340.4943
|
|
2p3/2
|
82259.285
|
5d3/2
|
105291.652
|
23032.367
|
|
4340.4958
|
|
2p3/2
|
82259.285
|
5s1/2
|
105291.631
|
23032.345999
|
|
4340.4998
|
|
2p1/2
|
82258.919
|
4d3/2
|
102823.8942
|
20564.975199
|
|
4861.2785
|
|
2s1/2
|
82258.954
|
4p3/2
|
102823.894
|
20564.9400
|
|
4861.2869
|
|
2p1/2
|
82258.919
|
4s1/2
|
102823.853
|
20564.934
|
|
4861.2883
|
|
2s1/2
|
82258.954
|
4p1/2
|
102823.849
|
20564.8950
|
|
4861.2977
|
|
2p3/2
|
82259.285
|
4d5/2
|
102823.909
|
20564.623999
|
|
4861.3614
|
|
2p3/2
|
82259.285
|
4d3/2
|
102823.8942
|
20564.609199
|
|
4861.365
|
|
2p3/2
|
82259.285
|
4s1/2
|
102823.853
|
20564.568
|
|
4861.3748
|
|
2p1/2
|
82258.919
|
3d3/2
|
97492.319
|
15233.400
|
|
6562.7096
|
|
2s1/2
|
82258.954
|
3p3/2
|
97492.321
|
15233.366999
|
|
6562.7247
|
|
2p1/2
|
82258.919
|
3s1/2
|
97492.222
|
15233.303
|
|
6562.7517
|
|
2s1/2
|
82258.954
|
3p1/2
|
97492.211
|
15233.256999
|
|
6562.7714
|
|
2p3/2
|
82259.285
|
3d5/2
|
97492.357
|
15233.072000
|
|
6562.8516
|
|
2p3/2
|
82259.285
|
3d3/2
|
97492.319
|
15233.034
|
|
6562.8672
|
|
2p3/2
|
82259.285
|
3s1/2
|
97492.222
|
15232.936999
|
|
6562.9093
|
|
3d3/2
|
97492.319
|
11f5/2
|
108772.3463
|
11280.0273
|
|
8862.79
|
|
3d3/2
|
97492.319
|
10f5/2
|
108581.9964
|
11089.6774
|
|
9014.91
|
|
3d3/2
|
97492.319
|
9f5/2
|
108324.7275
|
10832.408499
|
|
9229.02
|
|
3d3/2
|
97492.319
|
8f5/2
|
107965.0587
|
10472.739699
|
|
9546.02
|
|
3d3/2
|
97492.319
|
7f5/2
|
107440.4518
|
9948.132799
|
|
10049.4
|
|
3p1/2
|
97492.211
|
6d3/2
|
106632.162
|
9139.9510
|
|
10937.9818
|
|
3s1/2
|
97492.222
|
6p3/2
|
106632.162
|
9139.94000
|
|
10937.9944
|
|
3p1/2
|
97492.211
|
6s1/2
|
106632.151
|
9139.9400
|
|
10937.9964
|
|
3s1/2
|
97492.222
|
6p1/2
|
106632.1485
|
9139.9265
|
|
10938.0105
|
|
3d3/2
|
97492.319
|
6f5/2
|
106632.1685
|
9139.849499
|
|
10938.1059
|
|
3p3/2
|
97492.321
|
6d5/2
|
106632.167
|
9139.8460
|
|
10938.1062
|
|
3d3/2
|
97492.319
|
6p3/2
|
106632.162
|
9139.842999
|
|
10938.1113
|
|
3p3/2
|
97492.321
|
6d3/2
|
106632.162
|
9139.841
|
|
10938.1115
|
|
3p3/2
|
97492.321
|
6s1/2
|
106632.151
|
9139.8300
|
|
10938.1261
|
|
3d3/2
|
97492.319
|
6p1/2
|
106632.1485
|
9139.829499
|
|
10938.1275
|
|
3d5/2
|
97492.357
|
6f7/2
|
106632.1708
|
9139.8138
|
|
10938.1465
|
|
3d5/2
|
97492.357
|
6f5/2
|
106632.1685
|
9139.811499
|
|
10938.1492
|
|
3d5/2
|
97492.357
|
6p3/2
|
106632.162
|
9139.804999
|
|
10938.1546
|
|
3p1/2
|
97492.211
|
5d3/2
|
105291.652
|
7799.4410
|
|
12817.9254
|
|
3s1/2
|
97492.222
|
5p3/2
|
105291.652
|
7799.4300
|
|
12817.9427
|
|
3p1/2
|
97492.211
|
5s1/2
|
105291.631
|
7799.419999
|
|
12817.9601
|
|
3s1/2
|
97492.222
|
5p1/2
|
105291.629
|
7799.4070
|
|
12817.9811
|
|
3d3/2
|
97492.319
|
5f5/2
|
105291.6618
|
7799.342799
|
|
12818.0904
|
|
3p3/2
|
97492.321
|
5d5/2
|
105291.6598
|
7799.338799
|
|
12818.0908
|
|
3d3/2
|
97492.319
|
5p3/2
|
105291.652
|
7799.332999
|
|
12818.1032
|
|
3p3/2
|
97492.321
|
5d3/2
|
105291.652
|
7799.3310
|
|
12818.1036
|
|
3p3/2
|
97492.321
|
5s1/2
|
105291.631
|
7799.309999
|
|
12818.1383
|
|
3d3/2
|
97492.319
|
5p1/2
|
105291.629
|
7799.309999
|
|
12818.1417
|
|
3d5/2
|
97492.357
|
5f7/2
|
105291.6657
|
7799.308699
|
|
12818.1435
|
|
3d5/2
|
97492.357
|
5f5/2
|
105291.6618
|
7799.304799
|
|
12818.1499
|
|
3d5/2
|
97492.357
|
5p3/2
|
105291.652
|
7799.294999
|
|
12818.1627
|
|
4f5/2
|
102823.9113
|
11g7/2
|
108772.3466
|
5948.435299
|
|
16806.5
|
|
4f5/2
|
102823.9113
|
10g7/2
|
108581.9969
|
5758.085599
|
|
17362.1
|
|
4f5/2
|
102823.9113
|
9g7/2
|
108324.7282
|
5500.816899
|
|
18174.1
|
|
3p1/2
|
97492.211
|
4d3/2
|
102823.8942
|
5331.683199
|
|
18750.684
|
|
3s1/2
|
97492.222
|
4p3/2
|
102823.894
|
5331.6720
|
|
18750.72
|
|
3p1/2
|
97492.211
|
4s1/2
|
102823.853
|
5331.6420
|
|
18750.829
|
|
3s1/2
|
97492.222
|
4p1/2
|
102823.849
|
5331.6270
|
|
18750.881
|
|
3d3/2
|
97492.319
|
4f5/2
|
102823.9113
|
5331.5923
|
|
18751.011
|
|
3p3/2
|
97492.321
|
4d5/2
|
102823.909
|
5331.5880
|
|
18751.011
|
|
3d3/2
|
97492.319
|
4p3/2
|
102823.894
|
5331.574999
|
|
18751.064
|
|
3p3/2
|
97492.321
|
4d3/2
|
102823.8942
|
5331.573199
|
|
18751.065
|
|
3d5/2
|
97492.357
|
4f7/2
|
102823.919
|
5331.561999
|
|
18751.111
|
|
3d5/2
|
97492.357
|
4f5/2
|
102823.9113
|
5331.5543
|
|
18751.138
|
|
3d5/2
|
97492.357
|
4p3/2
|
102823.894
|
5331.536999
|
|
18751.191
|
|
3p3/2
|
97492.321
|
4s1/2
|
102823.853
|
5331.5320
|
|
18751.21
|
|
3d3/2
|
97492.319
|
4p1/2
|
102823.849
|
5331.529999
|
|
18751.225
|
|
4f5/2
|
102823.9113
|
8g7/2
|
107965.0597
|
5141.148399
|
|
19445.6
|
|
4f5/2
|
102823.9113
|
7g7/2
|
107440.4532
|
4616.541899
|
|
21655
|
|
4p1/2
|
102823.849
|
6d3/2
|
106632.162
|
3808.312999
|
|
26258.342
|
|
4s1/2
|
102823.853
|
6p3/2
|
106632.162
|
3808.308999
|
|
26258.373
|
|
4p1/2
|
102823.849
|
6s1/2
|
106632.151
|
3808.301999
|
|
26258.427
|
|
4s1/2
|
102823.853
|
6p1/2
|
106632.1485
|
3808.295499
|
|
26258.466
|
|
4d3/2
|
102823.8942
|
6f5/2
|
106632.1685
|
3808.2743
|
|
26258.626
|
|
4p3/2
|
102823.894
|
6d5/2
|
106632.167
|
3808.273
|
|
26258.627
|
|
4d3/2
|
102823.8942
|
6p3/2
|
106632.162
|
3808.2678
|
|
26258.657
|
|
4p3/2
|
102823.894
|
6d3/2
|
106632.162
|
3808.267999
|
|
26258.658
|
|
4d5/2
|
102823.909
|
6f7/2
|
106632.1708
|
3808.2618
|
|
26258.715
|
|
4f5/2
|
102823.9113
|
6g7/2
|
106632.1708
|
3808.2595
|
|
26258.715
|
|
4d5/2
|
102823.909
|
6f5/2
|
106632.1685
|
3808.2595
|
|
26258.731
|
|
4f5/2
|
102823.9113
|
6d5/2
|
106632.167
|
3808.255699
|
|
26258.731
|
|
4p3/2
|
102823.894
|
6s1/2
|
106632.151
|
3808.256999
|
|
26258.742
|
|
4d3/2
|
102823.8942
|
6p1/2
|
106632.1485
|
3808.2543
|
|
26258.75
|
|
4f7/2
|
102823.919
|
6g9/2
|
106632.1721
|
3808.2531
|
|
26258.759
|
|
4d5/2
|
102823.909
|
6p3/2
|
106632.162
|
3808.252999
|
|
26258.762
|
|
4f5/2
|
102823.9113
|
6d3/2
|
106632.162
|
3808.250699
|
|
26258.762
|
|
4f7/2
|
102823.919
|
6g7/2
|
106632.1708
|
3808.2518
|
|
26258.768
|
|
4f7/2
|
102823.919
|
6d5/2
|
106632.167
|
3808.2480
|
|
26258.784
|
|
5g7/2
|
105291.6657
|
11h9/2
|
108772.3468
|
3480.6811
|
|
28722
|
|
5g7/2
|
105291.6657
|
10h9/2
|
108581.9972
|
3290.3315
|
|
30384
|
|
5g7/2
|
105291.6657
|
9h9/2
|
108324.7286
|
3033.0629
|
|
32961
|
|
5g7/2
|
105291.6657
|
8h9/2
|
107965.0603
|
2673.394599
|
|
37395
|
|
4p1/2
|
102823.849
|
5d3/2
|
105291.652
|
2467.803
|
|
40521.865
|
|
4s1/2
|
102823.853
|
5p3/2
|
105291.652
|
2467.798999
|
|
40521.937
|
|
4s1/2
|
102823.853
|
5p1/2
|
105291.629
|
2467.775999
|
|
40522.321
|
|
4d3/2
|
102823.8942
|
5f5/2
|
105291.6618
|
2467.7676
|
|
40522.486
|
|
4p3/2
|
102823.894
|
5d5/2
|
105291.6598
|
2467.765799
|
|
40522.487
|
|
4d3/2
|
102823.8942
|
5p3/2
|
105291.652
|
2467.7578
|
|
40522.614
|
|
4p3/2
|
102823.894
|
5d3/2
|
105291.652
|
2467.7580
|
|
40522.615
|
|
4f5/2
|
102823.9113
|
5g7/2
|
105291.6657
|
2467.754399
|
|
40522.671
|
|
4d5/2
|
102823.909
|
5f7/2
|
105291.6657
|
2467.756699
|
|
40522.673
|
|
4f5/2
|
102823.9113
|
5d5/2
|
105291.6598
|
2467.748499
|
|
40522.735
|
|
4d5/2
|
102823.909
|
5f5/2
|
105291.6618
|
2467.7528
|
|
40522.737
|
|
4f7/2
|
102823.919
|
5g9/2
|
105291.668
|
2467.7490
|
|
40522.76
|
|
4f7/2
|
102823.919
|
5g7/2
|
105291.6657
|
2467.7467
|
|
40522.798
|
|
4f7/2
|
102823.919
|
5d5/2
|
105291.6598
|
2467.740799
|
|
40522.862
|
|
4f5/2
|
102823.9113
|
5d3/2
|
105291.652
|
2467.740699
|
|
40522.863
|
|
4d5/2
|
102823.909
|
5p3/2
|
105291.652
|
2467.7430
|
|
40522.865
|
|
4p3/2
|
102823.894
|
5s1/2
|
105291.631
|
2467.736999
|
|
40522.962
|
|
4d3/2
|
102823.8942
|
5p1/2
|
105291.629
|
2467.7348
|
|
40522.998
|
|
5g7/2
|
105291.6657
|
7h9/2
|
107440.4541
|
2148.7884
|
|
46525
|
|
6h9/2
|
106632.1721
|
11i11/2
|
108772.347
|
2140.174899
|
|
46712
|
|
6h9/2
|
106632.1721
|
10i11/2
|
108581.9974
|
1949.825299
|
|
51273
|
|
6h9/2
|
106632.1721
|
9i13/2
|
108324.729
|
1692.5569
|
|
59066
|
|
5g7/2
|
105291.6657
|
6h9/2
|
106632.1721
|
1340.506399
|
|
74578
|
|
5p1/2
|
105291.629
|
6d3/2
|
106632.162
|
1340.532999
|
|
74597.17
|
|
5s1/2
|
105291.631
|
6p3/2
|
106632.162
|
1340.5310
|
|
74597.3
|
|
5p1/2
|
105291.629
|
6s1/2
|
106632.151
|
1340.521999
|
|
74597.85
|
|
5s1/2
|
105291.631
|
6p1/2
|
106632.1485
|
1340.5175
|
|
74598.05
|
|
5d3/2
|
105291.652
|
6f5/2
|
106632.1685
|
1340.516499
|
|
74598.22
|
|
5p3/2
|
105291.652
|
6d5/2
|
106632.167
|
1340.514999
|
|
74598.22
|
|
5p3/2
|
105291.652
|
6d3/2
|
106632.162
|
1340.5099
|
|
74598.47
|
|
5d3/2
|
105291.652
|
6p3/2
|
106632.162
|
1340.5099
|
|
74598.47
|
|
5d5/2
|
105291.6598
|
6f7/2
|
106632.1708
|
1340.5110
|
|
74598.53
|
|
5f5/2
|
105291.6618
|
6g7/2
|
106632.1708
|
1340.5090
|
|
74598.53
|
|
5d5/2
|
105291.6598
|
6f5/2
|
106632.1685
|
1340.5087
|
|
74598.66
|
|
5f5/2
|
105291.6618
|
6d5/2
|
106632.167
|
1340.505199
|
|
74598.66
|
|
5f7/2
|
105291.6657
|
6g9/2
|
106632.1721
|
1340.506399
|
|
74598.67
|
|
5f7/2
|
105291.6657
|
6g7/2
|
106632.1708
|
1340.5051
|
|
74598.75
|
|
5g7/2
|
105291.6657
|
6f7/2
|
106632.1708
|
1340.5051
|
|
74598.75
|
|
5f7/2
|
105291.6657
|
6d5/2
|
106632.167
|
1340.5013
|
|
74598.87
|
|
5g9/2
|
105291.668
|
6f7/2
|
106632.1708
|
1340.5028
|
|
74598.87
|
|
5g7/2
|
105291.6657
|
6f5/2
|
106632.1685
|
1340.5028
|
|
74598.87
|
|
5d5/2
|
105291.6598
|
6p3/2
|
106632.162
|
1340.5022
|
|
74598.91
|
|
5f5/2
|
105291.6618
|
6d3/2
|
106632.162
|
1340.500199
|
|
74598.91
|
|
5p3/2
|
105291.652
|
6s1/2
|
106632.151
|
1340.4989
|
|
74599.15
|
|
5d3/2
|
105291.652
|
6p1/2
|
106632.1485
|
1340.496499
|
|
74599.22
|
|
6h9/2
|
106632.1721
|
8i11/2
|
107965.0606
|
1332.8885
|
|
75005
|
|
6h9/2
|
106632.1721
|
7i11/2
|
107440.4547
|
808.2826
|
|
123680
|
|
2p1/2
|
82258.919
|
2p3/2
|
82259.285
|
0.36600
|
|
273307600
|
|
2s1/2
|
82258.954
|
2p3/2
|
82259.285
|
0.3310
|
|
302478400
|
|
3s1/2
|
97492.222
|
3d5/2
|
97492.319
|
0.0970
|
|
747023000
|
|
3p1/2
|
97492.211
|
3p3/2
|
97492.321
|
0.110
|
|
922413000
|
|
3p1/2
|
97492.211
|
3d3/2
|
97492.319
|
0.1080
|
|
923920000
|
|
3s1/2
|
97492.222
|
3p3/2
|
97492.321
|
0.0990
|
|
1021345000
|
|
3s1/2
|
97492.222
|
3d3/2
|
97492.319
|
0.0970
|
|
1023220000
|
|
4s1/2
|
102823.853
|
4d5/2
|
102823.909
|
0.055999
|
|
1770980000
|
|
4p1/2
|
102823.849
|
4p3/2
|
102823.894
|
0.044999
|
|
2186510000
|
|
4d3/2
|
102823.8942
|
4d5/2
|
102823.909
|
0.01480
|
|
2189700000
|
|
4s1/2
|
102823.853
|
4p3/2
|
102823.894
|
0.040999
|
|
2421520000
|
|
4s1/2
|
102823.853
|
4d3/2
|
102823.8942
|
0.041199
|
|
2425500000
|
|
3d3/2
|
97492.319
|
3d5/2
|
97492.357
|
0.0380
|
|
2767700000
|
|
3p3/2
|
97492.321
|
3d5/2
|
97492.357
|
0.0360
|
|
2781290000
|
|
2p1/2
|
82258.919
|
2s1/2
|
82258.954
|
0.0350
|
|
2833984000
|
|
5p1/2
|
105291.629
|
5p3/2
|
105291.652
|
0.0230
|
|
4270430000
|
|
5p1/2
|
105291.629
|
5d3/2
|
105291.652
|
0.0230
|
|
4288000000
|
|
5s1/2
|
105291.631
|
5p3/2
|
105291.652
|
0.0210
|
|
4729950000
|
|
4d3/2
|
102823.8942
|
4f5/2
|
102823.9113
|
0.0171
|
|
6563000000
|
|
4p3/2
|
102823.894
|
4d5/2
|
102823.909
|
0.014999
|
|
6592200000
|
|
6p1/2
|
106632.1485
|
6p3/2
|
106632.162
|
0.0135
|
|
7379310000
|
|
3p1/2
|
97492.211
|
3s1/2
|
97492.222
|
0.010999
|
|
9522700000
|
|
7p1/2
|
107440.4385
|
7p3/2
|
107440.447
|
0.008499
|
|
11718060000
|
|
5d3/2
|
105291.652
|
5d5/2
|
105291.6598
|
0.007799
|
|
12816000000
|
|
5p3/2
|
105291.652
|
5d5/2
|
105291.6598
|
0.007799
|
|
12970000000
|
|
4d5/2
|
102823.909
|
4f7/2
|
102823.919
|
0.009999
|
|
13149000000
|
|
8p1/2
|
107965.0491
|
8p3/2
|
107965.0548
|
0.005699
|
|
17491000000
|
|
6d3/2
|
106632.162
|
6d5/2
|
106632.167
|
0.0050
|
|
22143000000
|
|
4p1/2
|
102823.849
|
4s1/2
|
102823.853
|
0.0040
|
|
22529000000
|
|
9p1/2
|
108324.7221
|
9p3/2
|
108324.7262
|
0.0041
|
|
24905100000
|
|
5d3/2
|
105291.652
|
5f7/2
|
105291.6657
|
0.013699
|
|
25600000000
|
|
10p1/2
|
108581.9925
|
10p3/2
|
108581.9954
|
0.0029
|
|
34163400000
|
|
7d3/2
|
107440.447
|
7d5/2
|
107440.4498
|
0.0028
|
|
35158000000
|
|
5s1/2
|
105291.631
|
5p3/2
|
105291.652
|
0.021
|
|
43957000000
|
|
11p1/2
|
108772.3433
|
11p3/2
|
108772.3455
|
0.0022
|
|
45471500000
|
|
8d3/2
|
107965.0548
|
8d5/2
|
107965.0567
|
0.0019
|
|
52472000000
|
|
12p1/2
|
108917.1207
|
12p3/2
|
108917.1238
|
0.0031
|
|
59034500000
|
|
9d3/2
|
108324.7261
|
9d5/2
|
108324.7275
|
0.001399
|
|
74703000000
|
|
6p1/2
|
106632.1485
|
6s1/2
|
106632.151
|
0.0025
|
|
75910000000
|
|
Где С =299792456,2 м/сек или 29979245620+/-120Гц
|
|
По
материалам информационной системы
«Электронная структура атомов»
© Новосибирский
Государственный Университет
© Институт автоматики и электрометрии СО РАН
Программная и техническая поддержка - Мультимедиа центр НГУ E-mail:grotrian@nsu.ru . Свидетельство о
государственной регистрации базы данных #2009620361
Всего 233 записи
|
38. Литература
При
написании этого труда автор опирался на разработки и развил идеи следующих
авторов:
1. Канарёв Филипп Михайлович «Ядра атомов», «Электростатика».
2.
Зураб Каикацишвили «Живое наследие Менделеева»
3.
Ацюковский В.А. «Эфиродинамические основы электромагнетизма»
4.
Гришаев А.А. «Феномен сфер
непроницаемости в атомах»
5. Хайдаров К.А. «Вечная
Вселенная», «Гравитирующий эфир», «Эфир
светоносный. Дыхание эфира», «Термодинамика
эфира», «Быстрая гравитация», «Эфирный
атом», «Эфирный электрон»,
«Природа света как совместных колебаний фазового и корпускулярного эфиров».
6.
Яковлев В.В. «Логика явлений»
7.
Шипов Г.И. «Теория
физического вакуума. Торсионные поля»
8. Горбацевич Ф.Ф. «Эфирная среда и
универсум»
9. Пакулин В. Н.«Вихревая модель микромира»
10. ЛиневичЭ.И. «Перевод размерностей
электромагнитных величин в механические»
11. Шпеньков Г.П. «О
фундаментальных проблемах физики.»
12. Егоров
В. А. «Кинетическая модель взаимодействия частиц.»
13. Шидловский А. И. «Aтом водорода – самый простой из
атомов.»
14.
Диков О С. «Реальная структура нуклонов»
Перейти на главную
страницу
Перейти к Части 2
![]() ) начинают играть существенную роль, определяют
величину и характер сил, действующих между поляризованными частицами.
) начинают играть существенную роль, определяют
величину и характер сил, действующих между поляризованными частицами.
![]() =0,385*10-6 Ом*м),
близка к металлической, в перпендикулярном в сотни раз меньше, чем у металлов
(52,0*10-6 Ом*м). Высокая анизотропия
свойств монокристаллов
графита обусловлена строением его кристаллической решетки. В направлении
базисных плоскостей тепловое расширение графита до 427 °С отрицательно (т.е. графит сжимается).
=0,385*10-6 Ом*м),
близка к металлической, в перпендикулярном в сотни раз меньше, чем у металлов
(52,0*10-6 Ом*м). Высокая анизотропия
свойств монокристаллов
графита обусловлена строением его кристаллической решетки. В направлении
базисных плоскостей тепловое расширение графита до 427 °С отрицательно (т.е. графит сжимается).