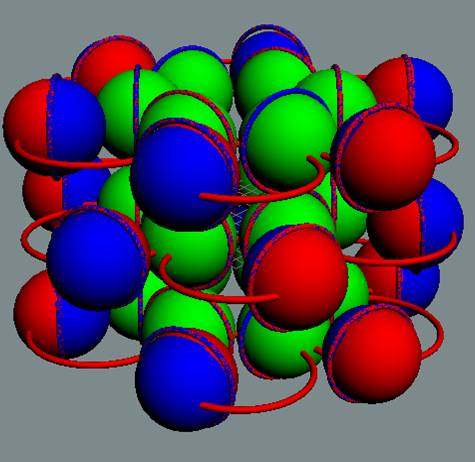
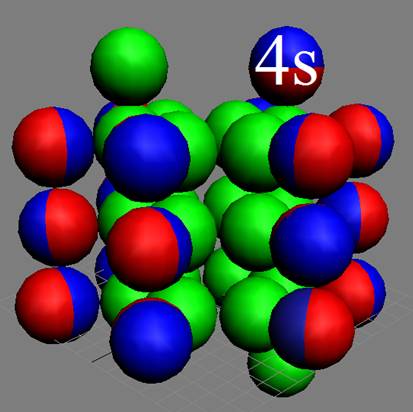
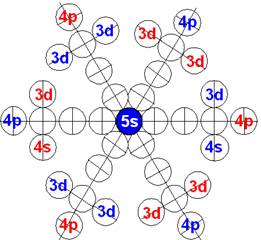
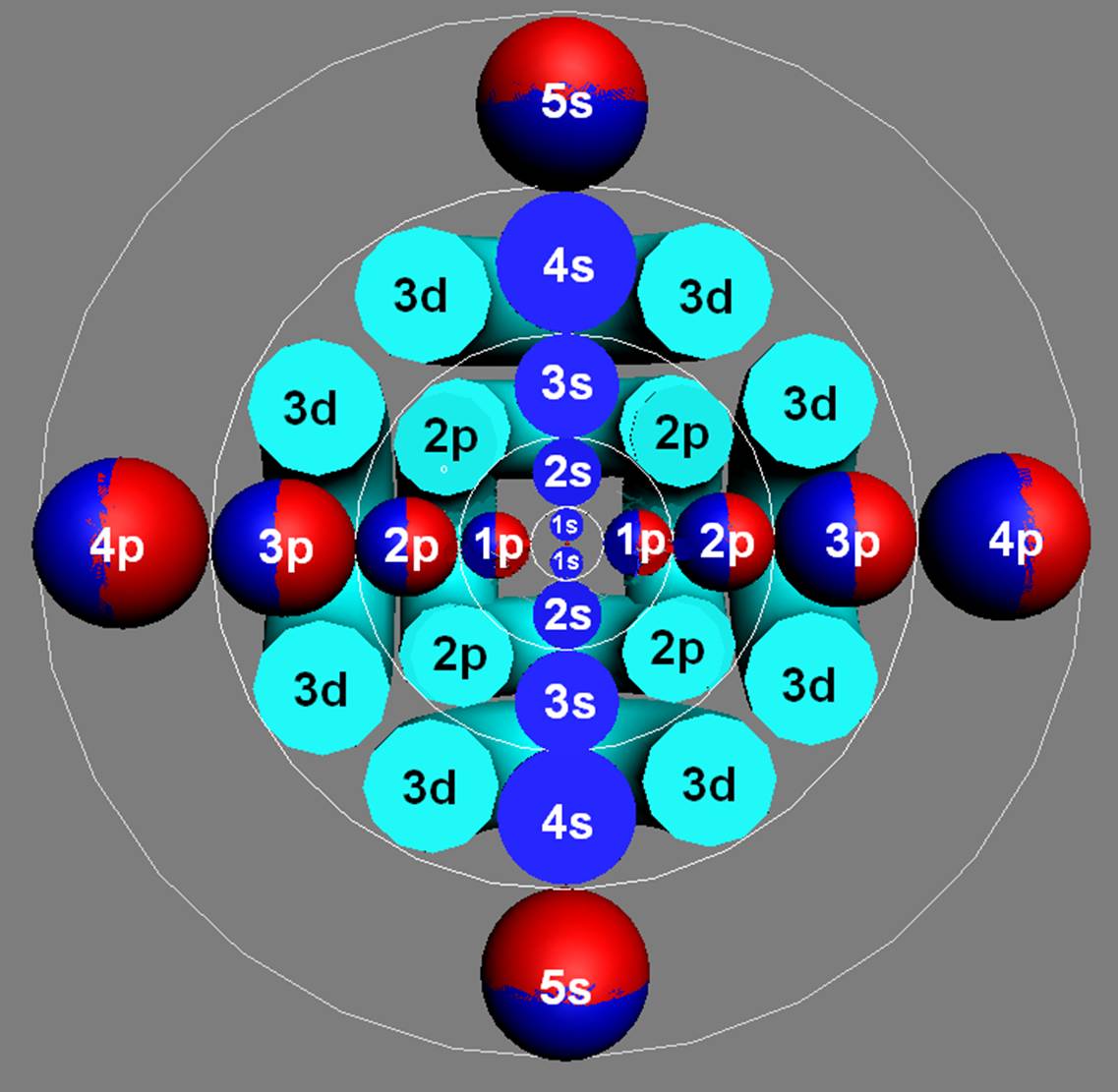
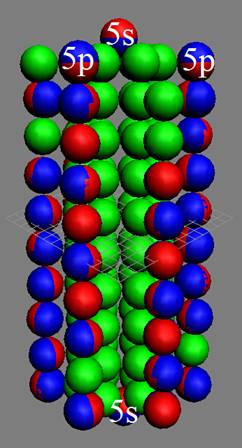
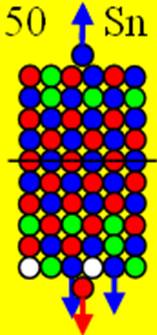
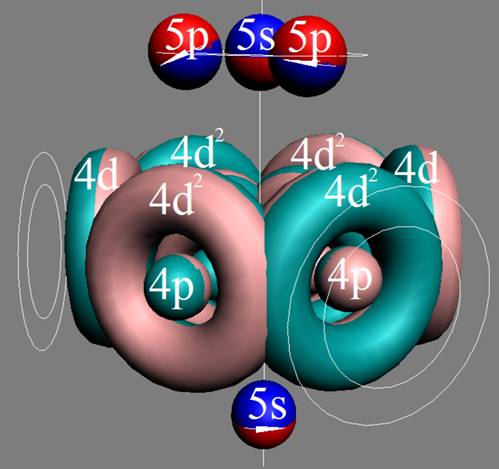
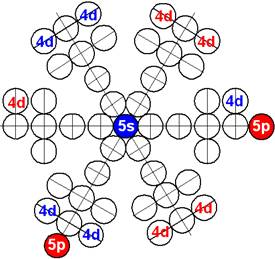
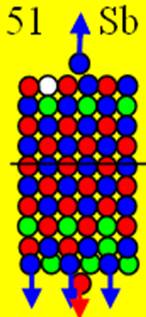
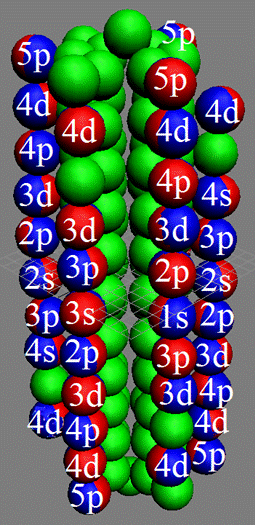
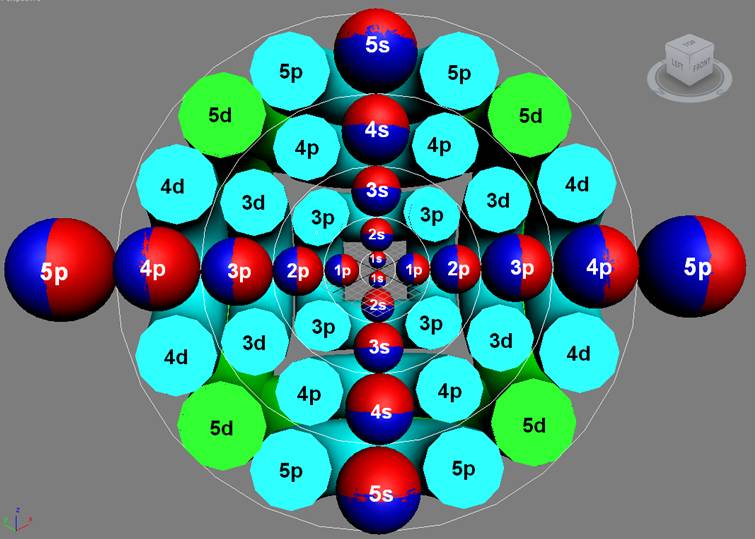
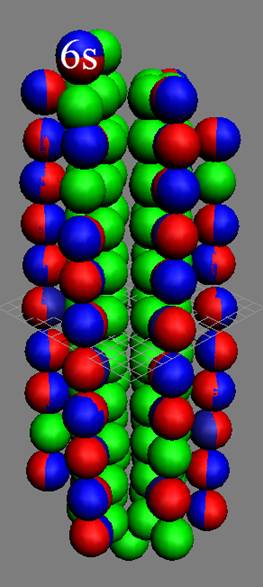
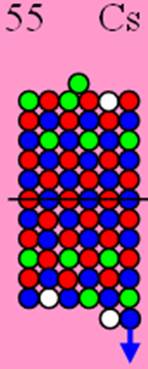
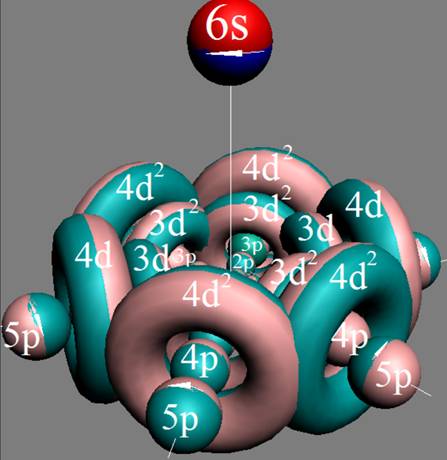
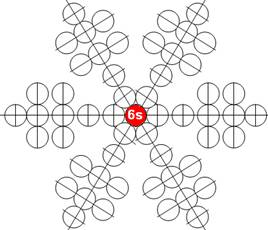
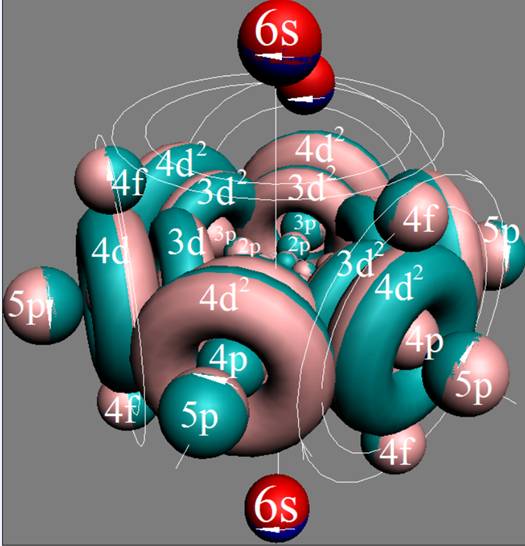
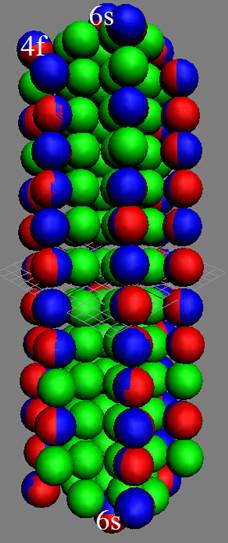
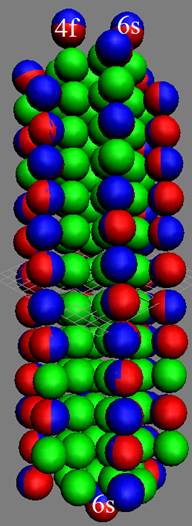
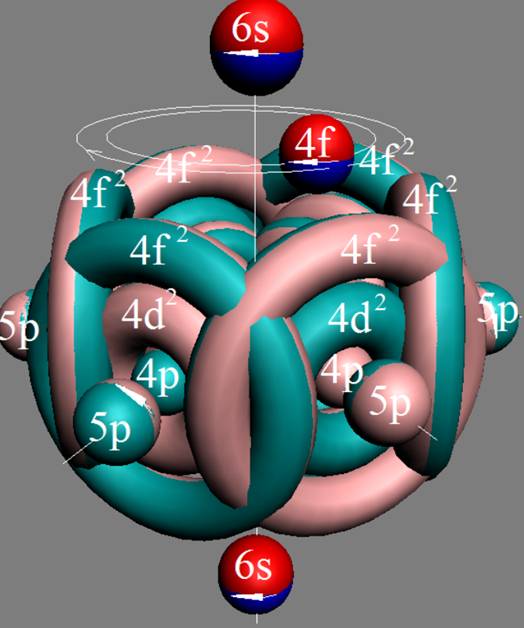
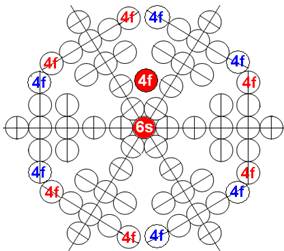
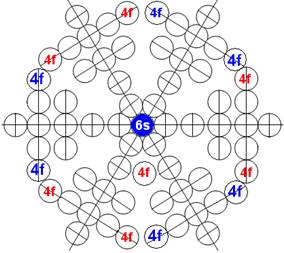
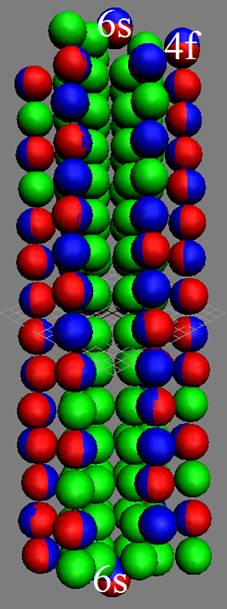
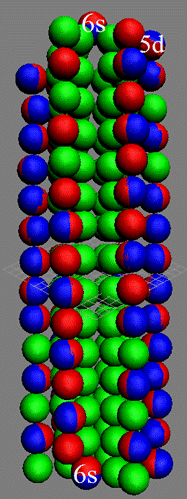
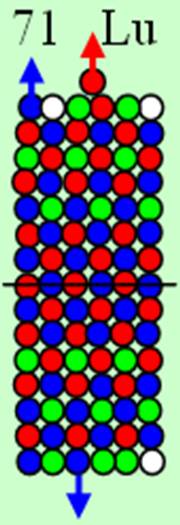
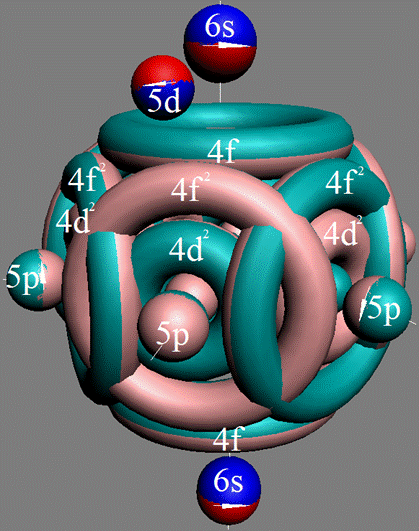
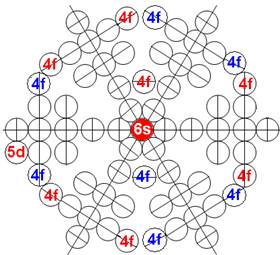
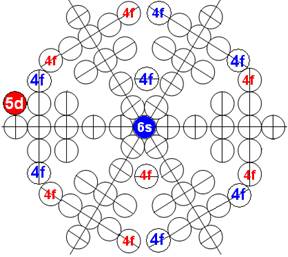
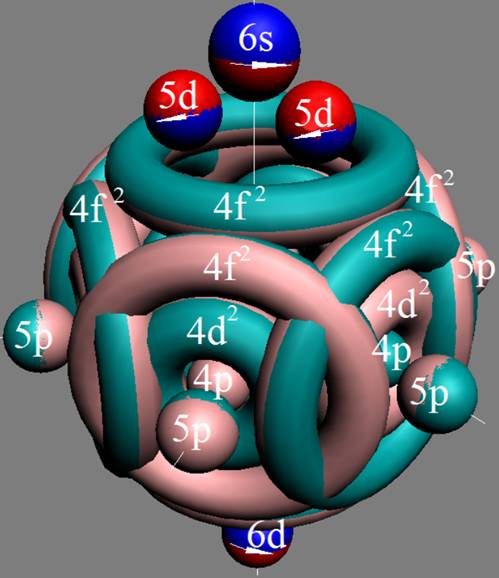
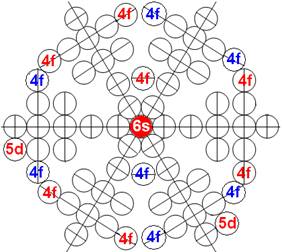
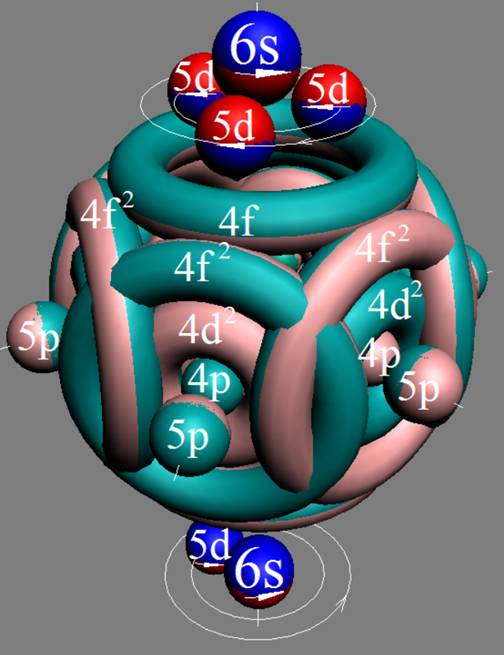
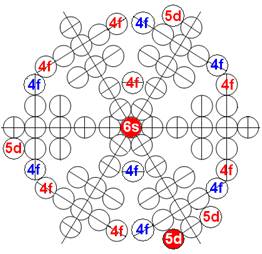
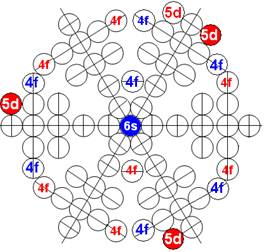
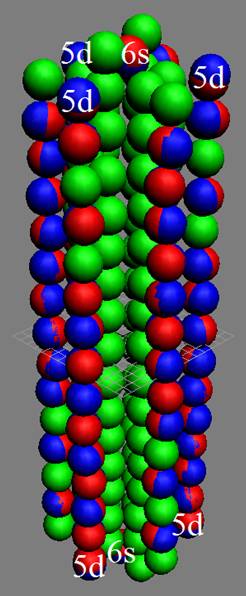
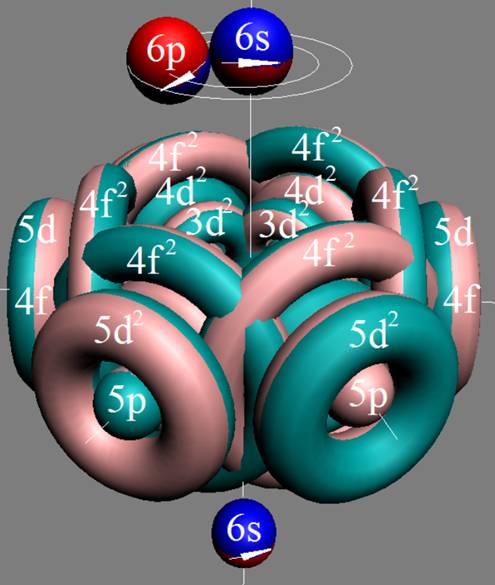
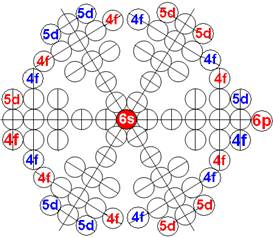
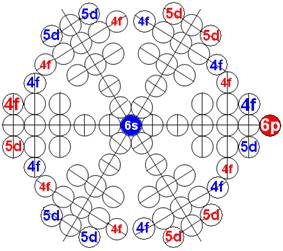
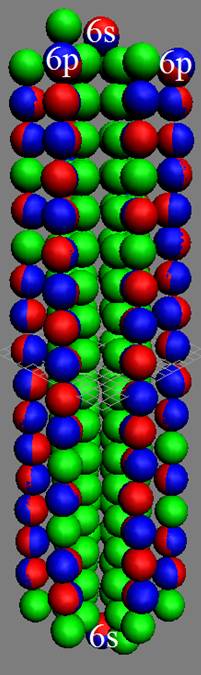
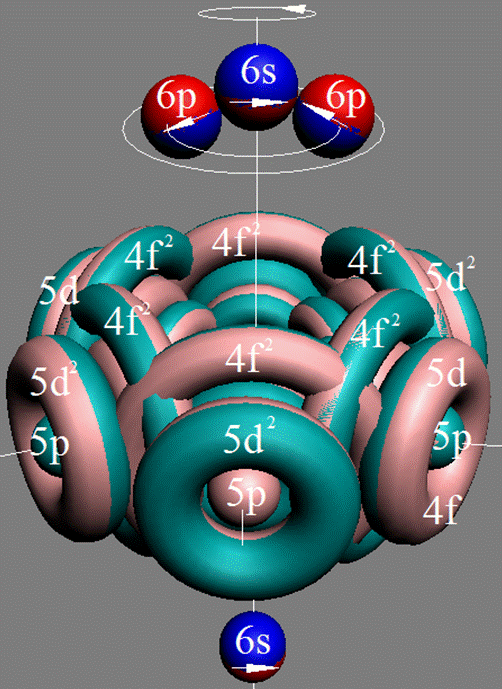
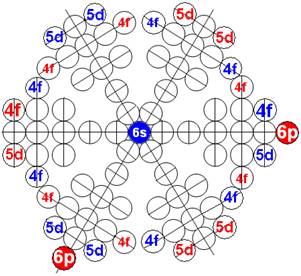
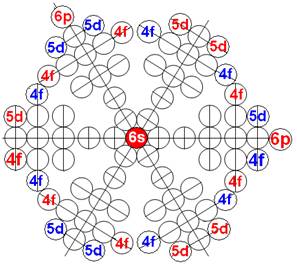
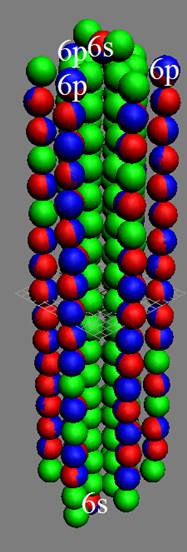
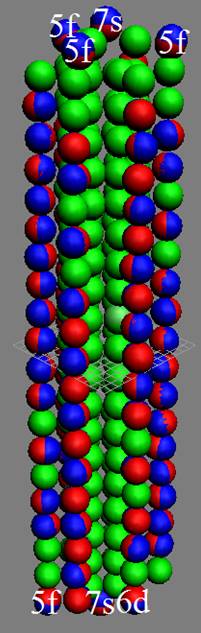
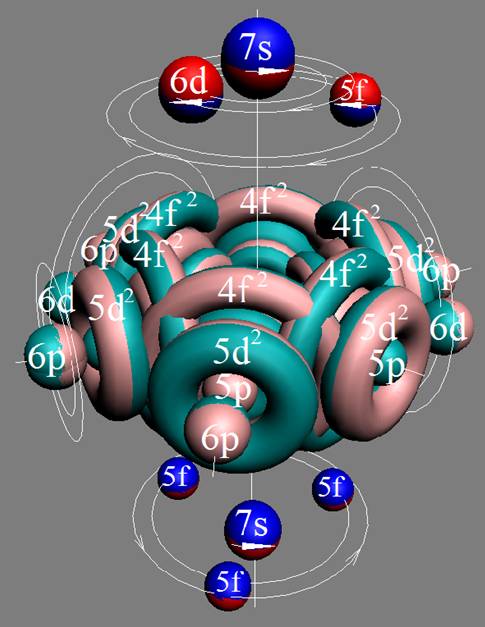
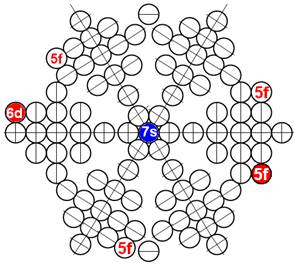
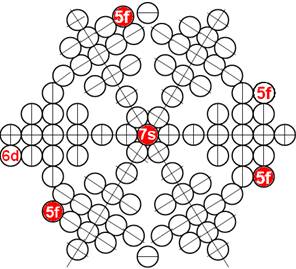
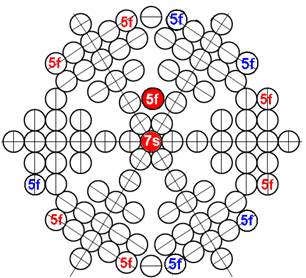
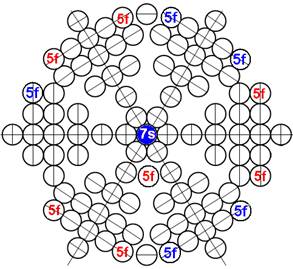
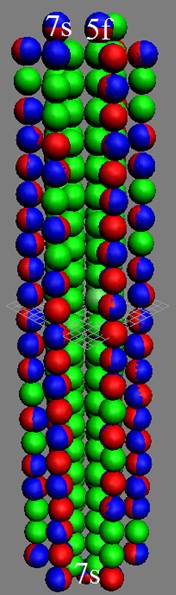
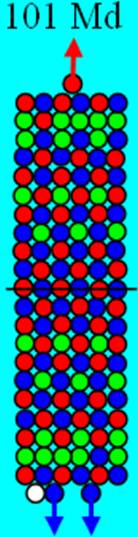
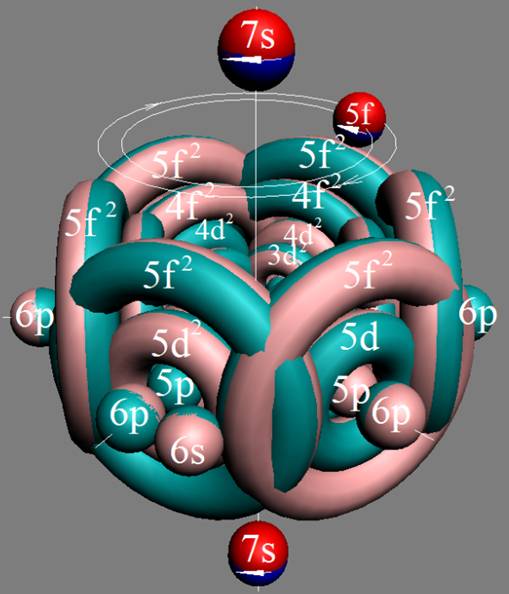
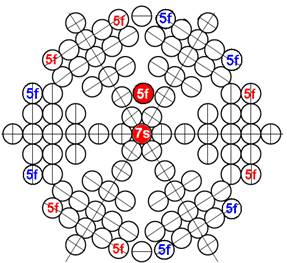
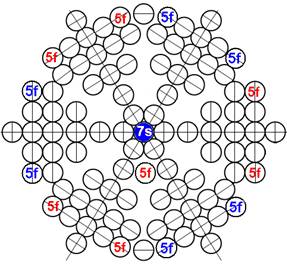
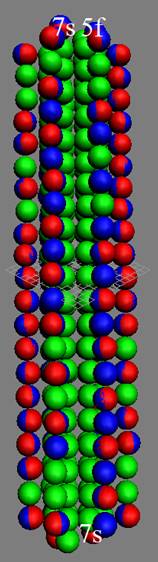
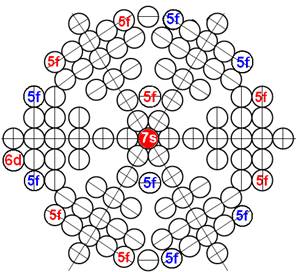
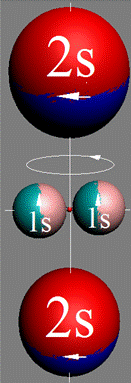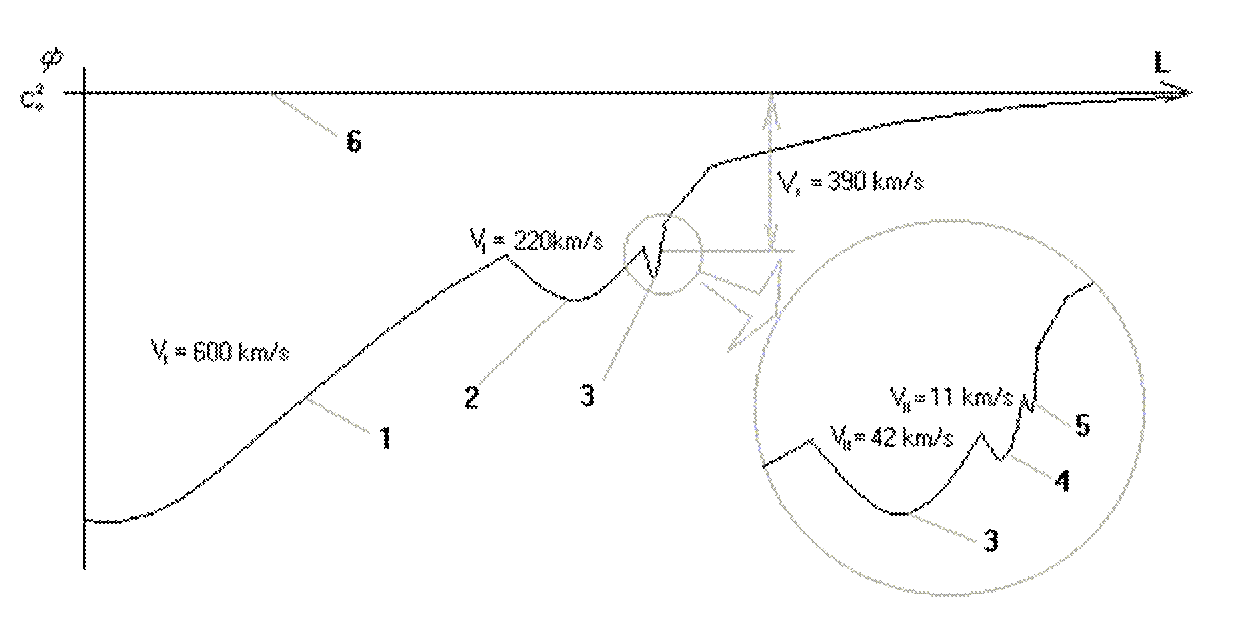Часть 1
Строение атомного ядра
и электронных оболочек
120 химических элементов.
Авторы:
Никитин Андрей Николаевич
Никитин Дмитрий Андреевич
Оглавление
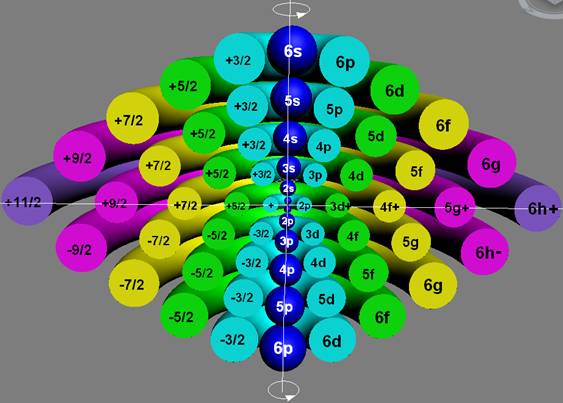
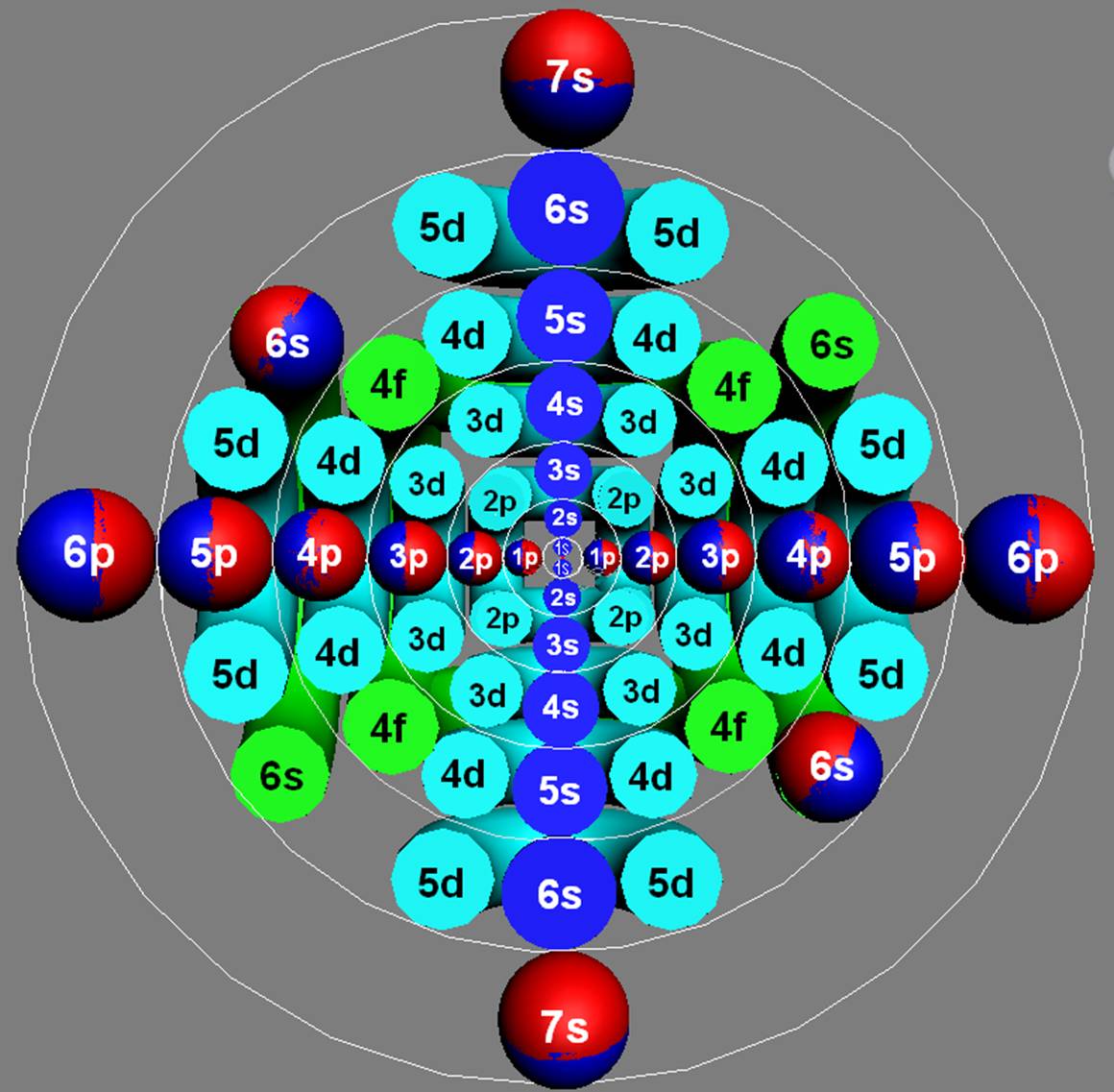
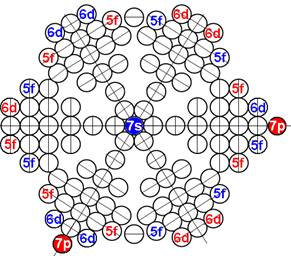
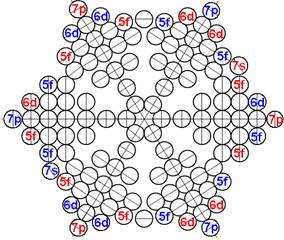
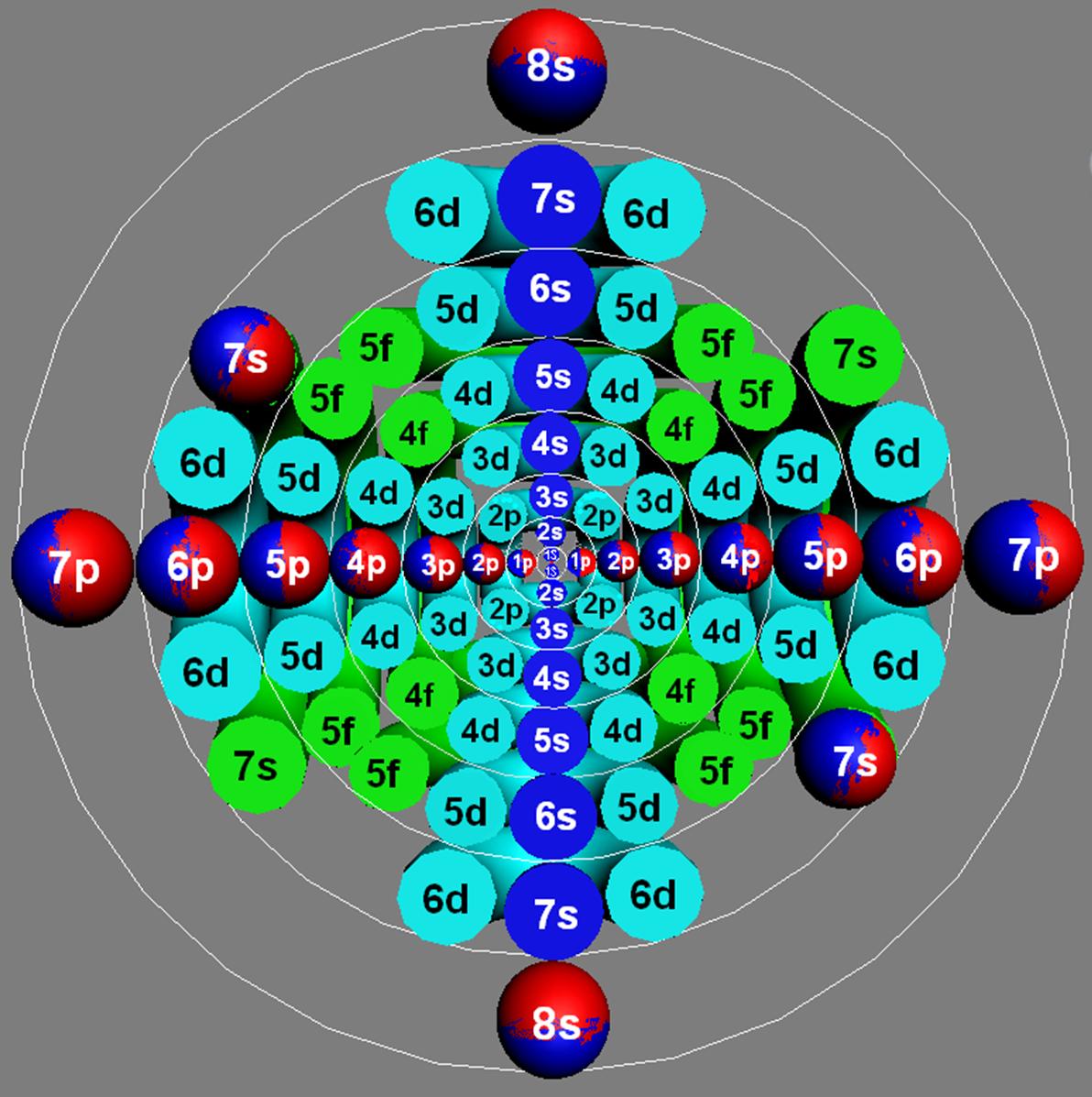
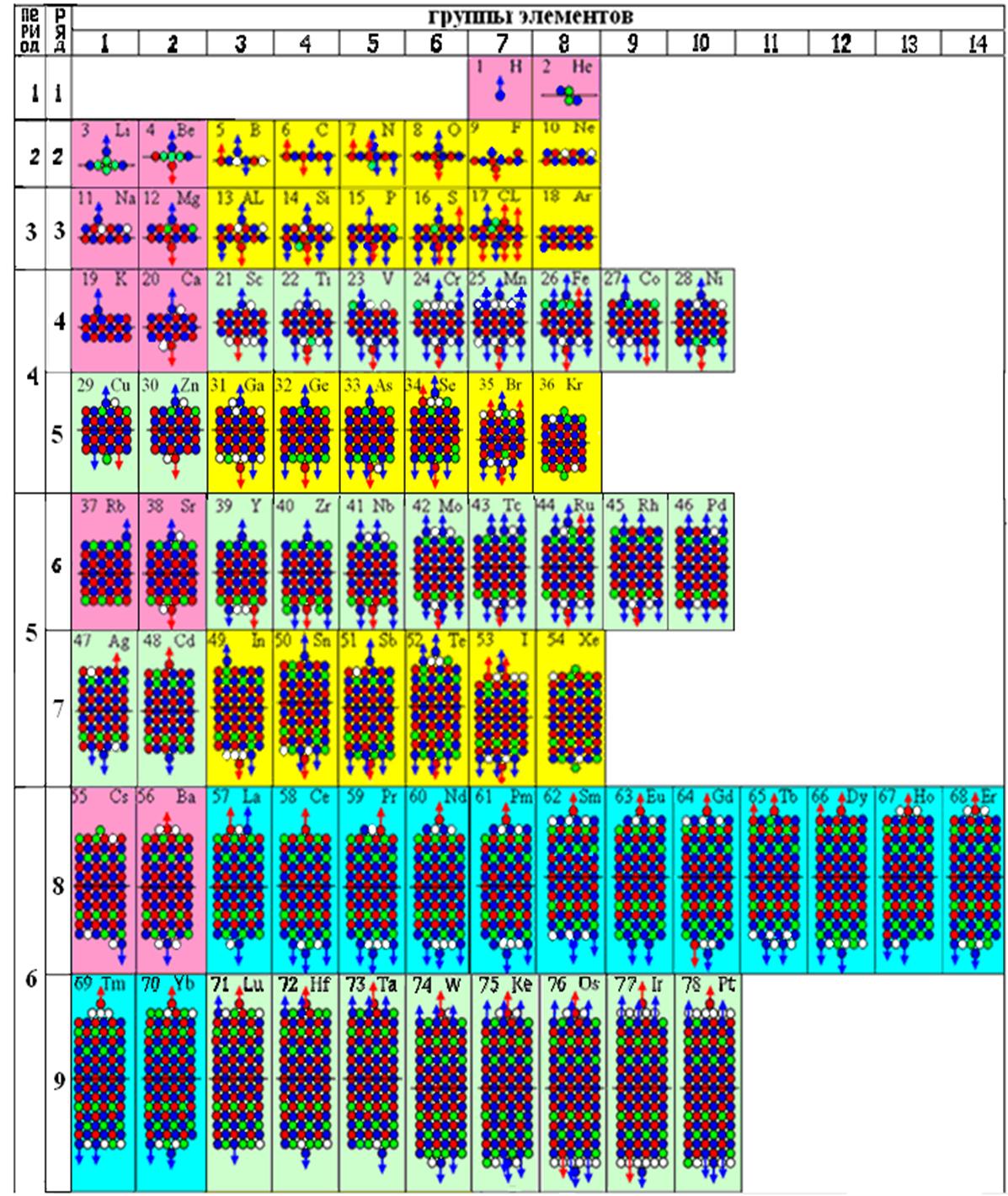
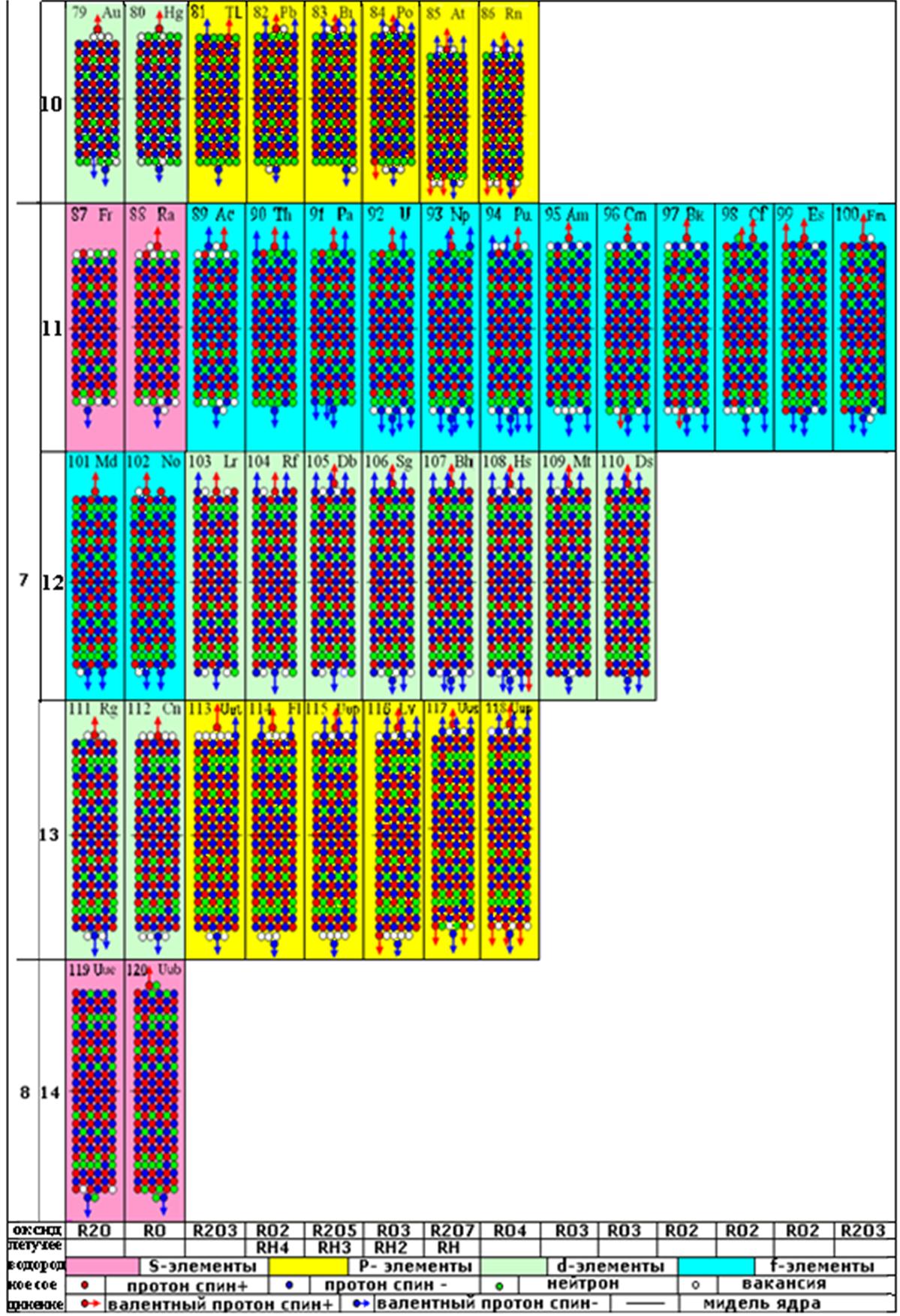
1. Завершённая периодическая система химических элементов Д.И.Менделеева
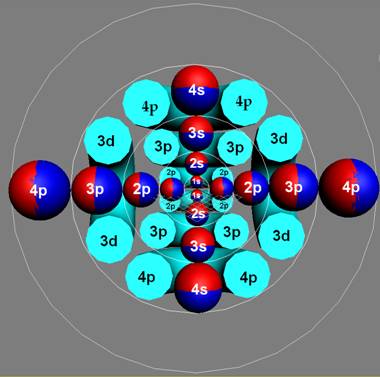
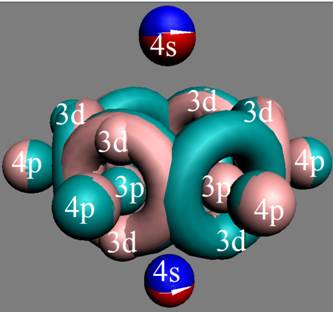
2. Строение атомных ядер и электронных оболочек 120 химических элементов
3. Закономерности в строении атомных ядер и электронных оболочек 120 химических элементов
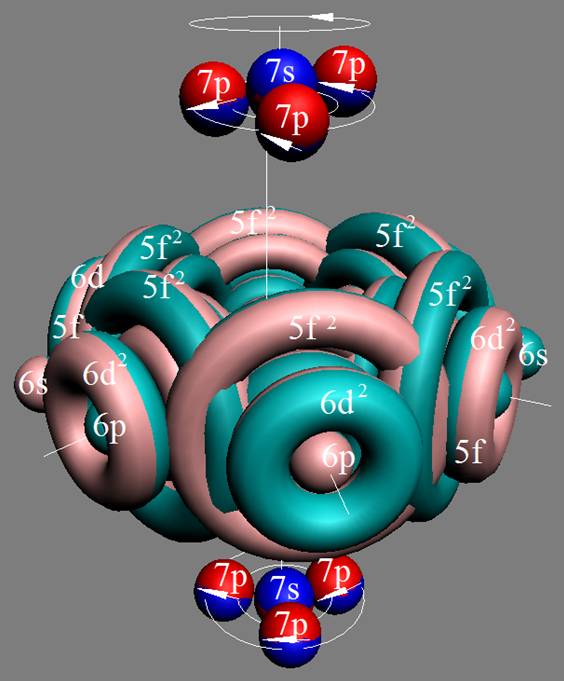
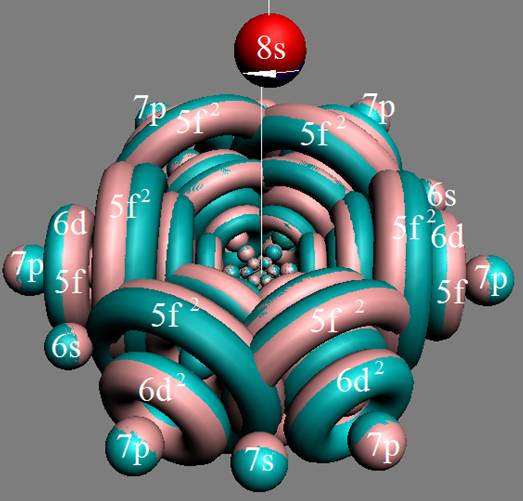
4. Строение ядер инертных химических элементов
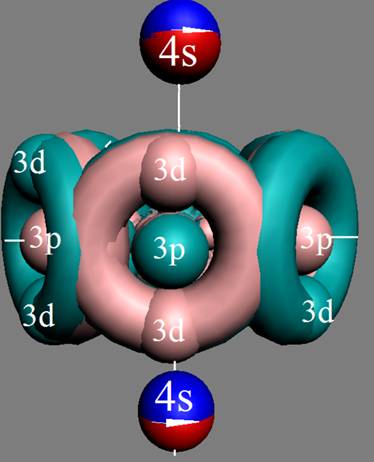
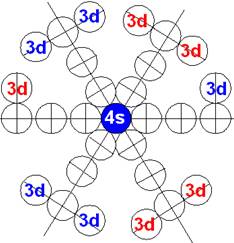
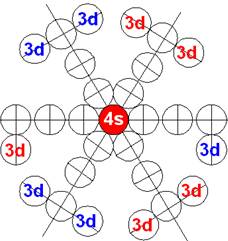
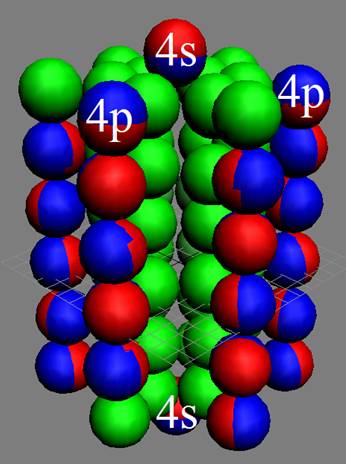
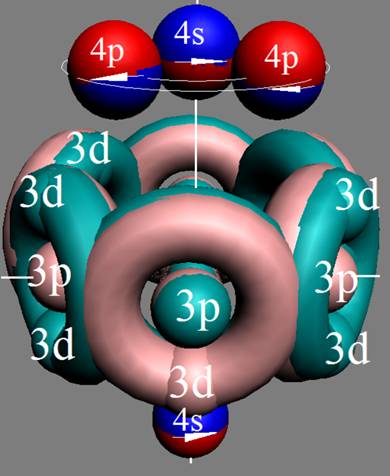
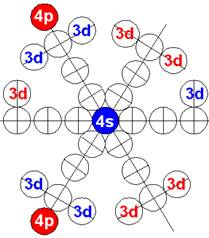
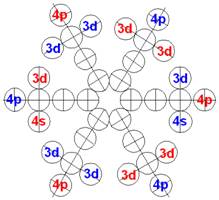
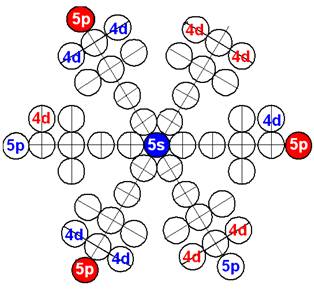
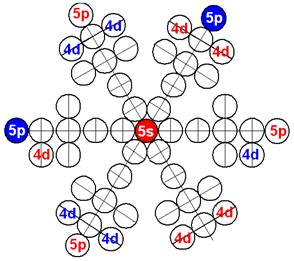
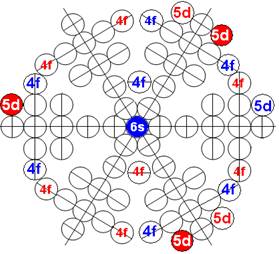
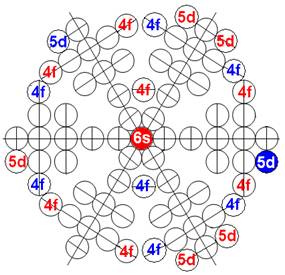
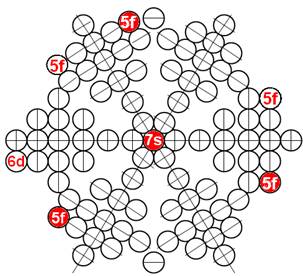
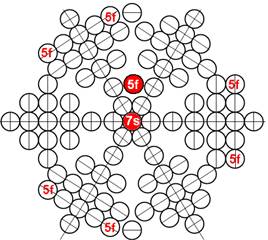
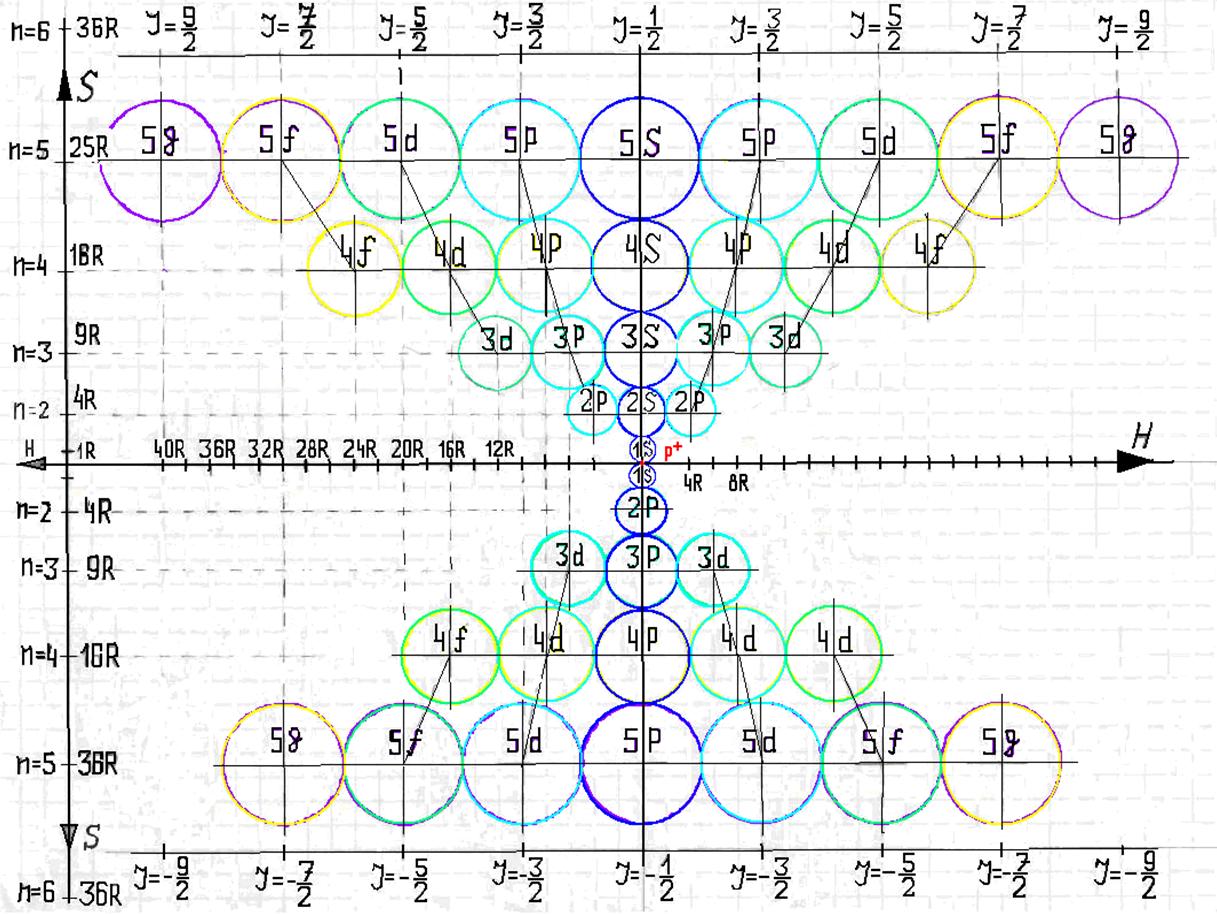
5. Порядок заполнения –s, -p, -d, -f, протонами протонных оболочек 8 инертных ядер химических элементов
6. Периодическая система протонной структуры ядер 120 химических элементов
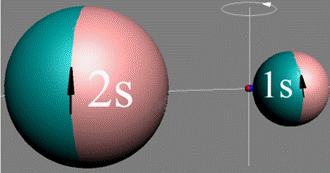
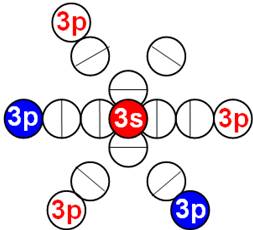
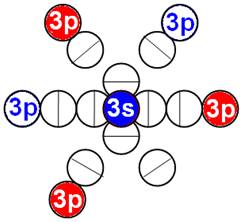
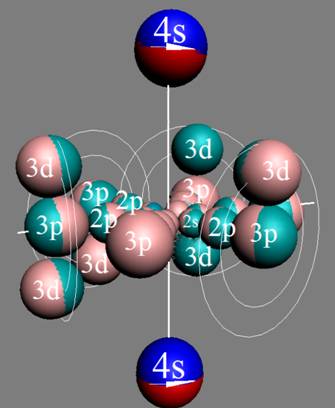
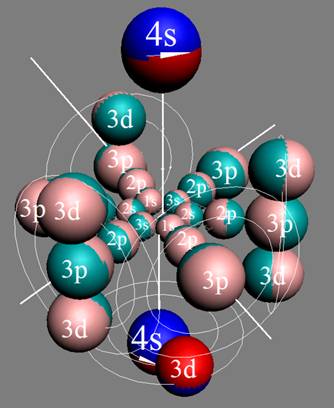
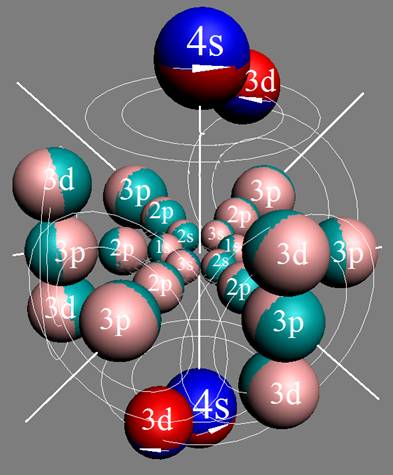
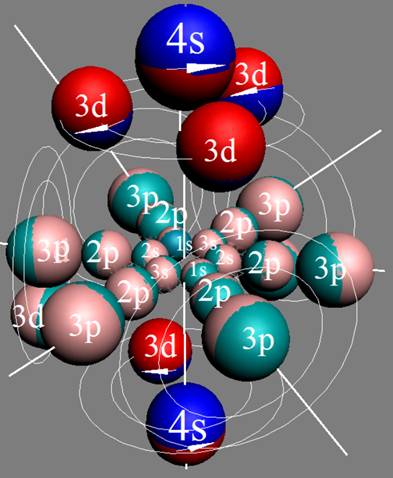
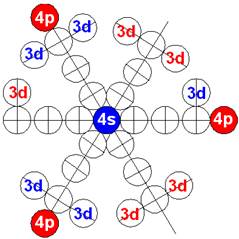
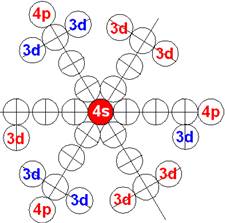
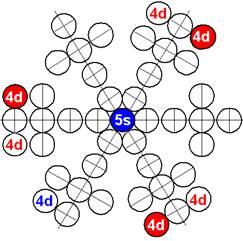
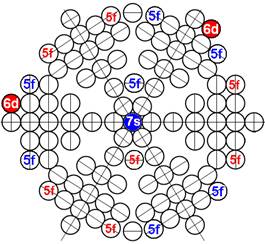
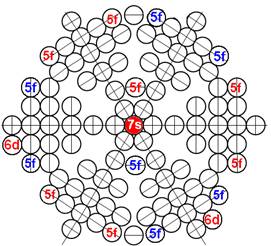
7. Строение электронной оболочки атома водорода
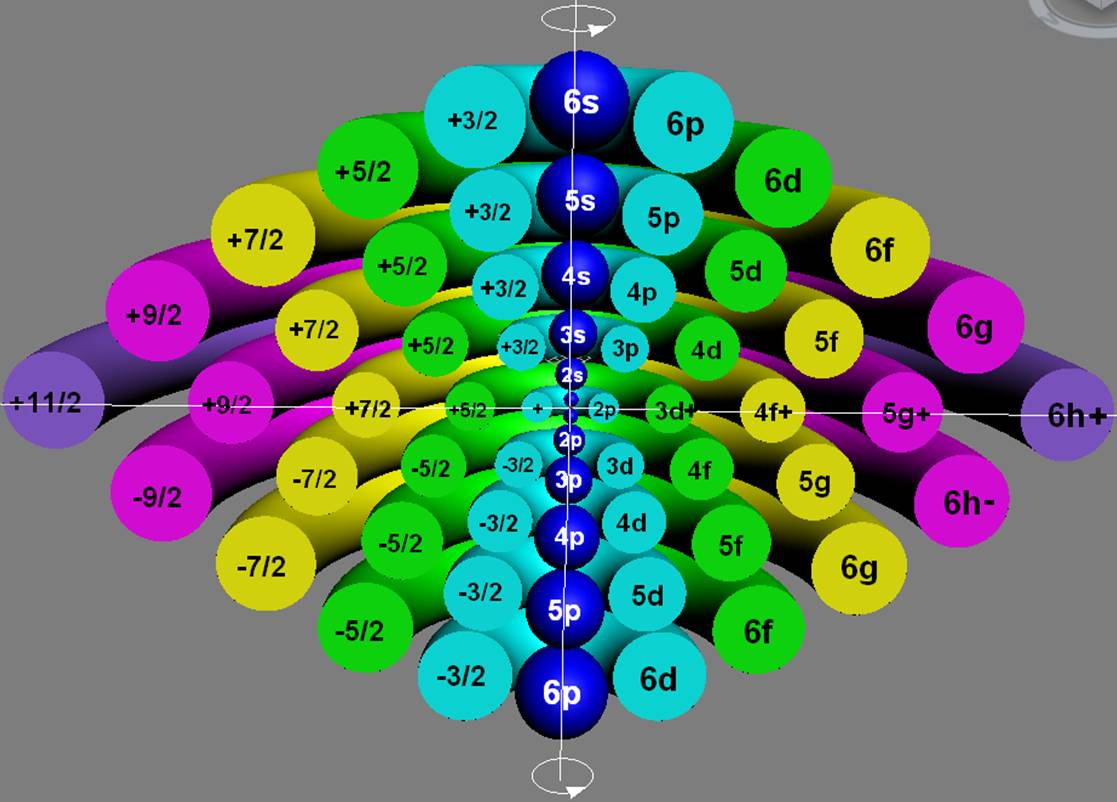
8. Таблица. «Строение электронной оболочки атома водорода»
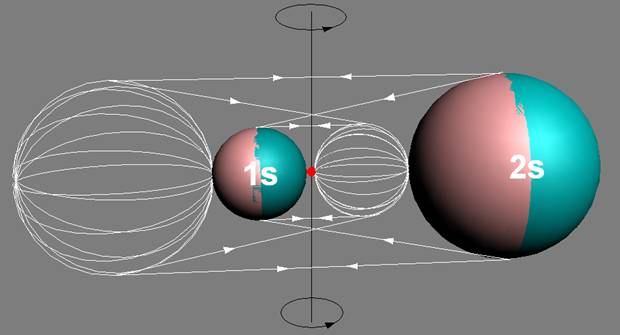
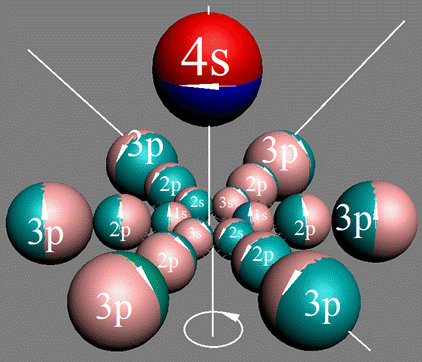
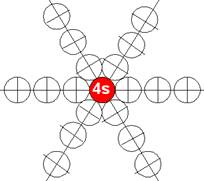
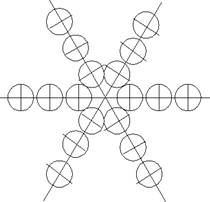
9. Кустарно - механический аналог поведения электрона в оболочке атома водорода
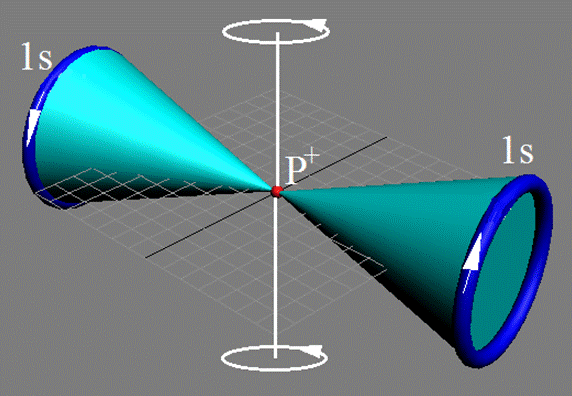
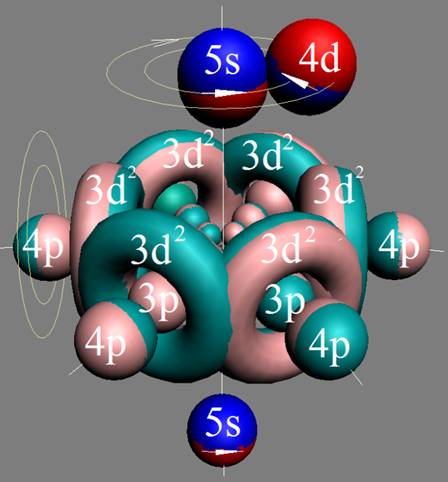
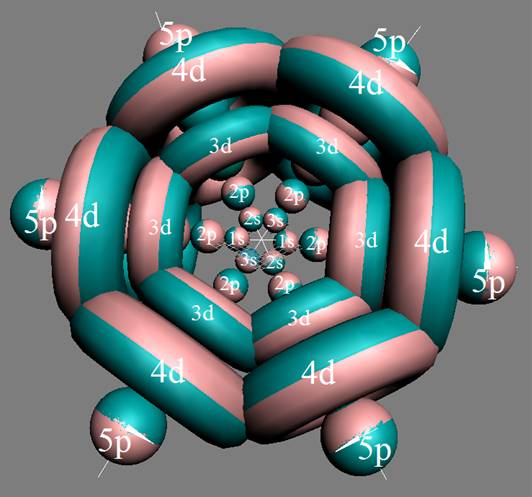
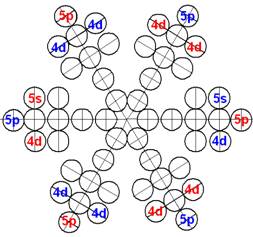
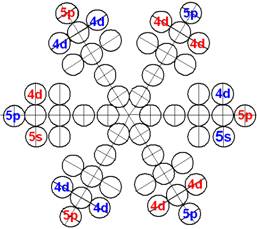
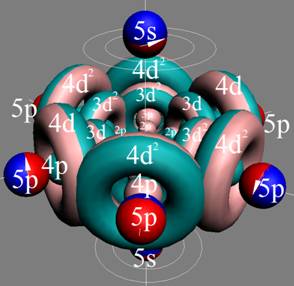
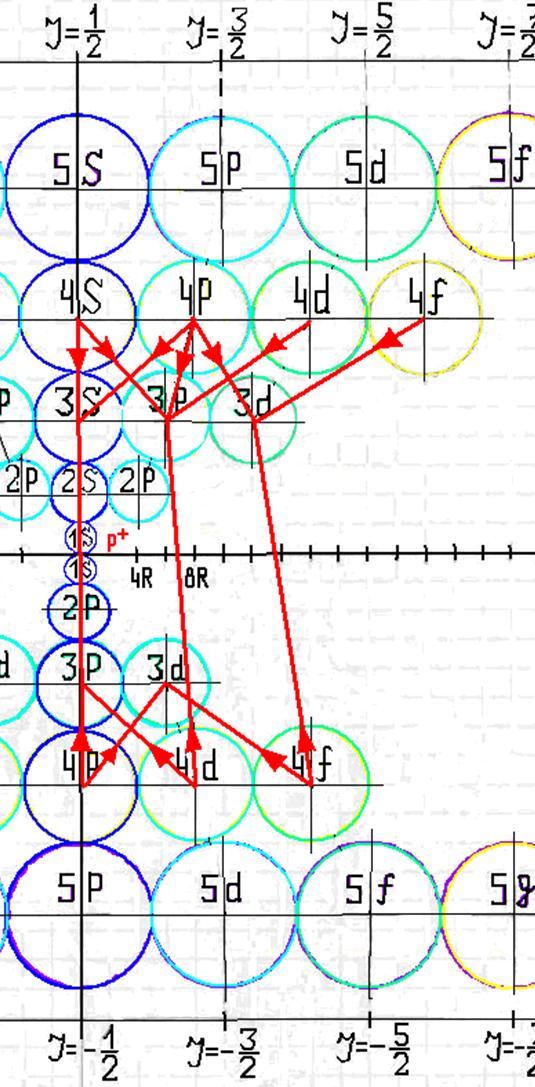
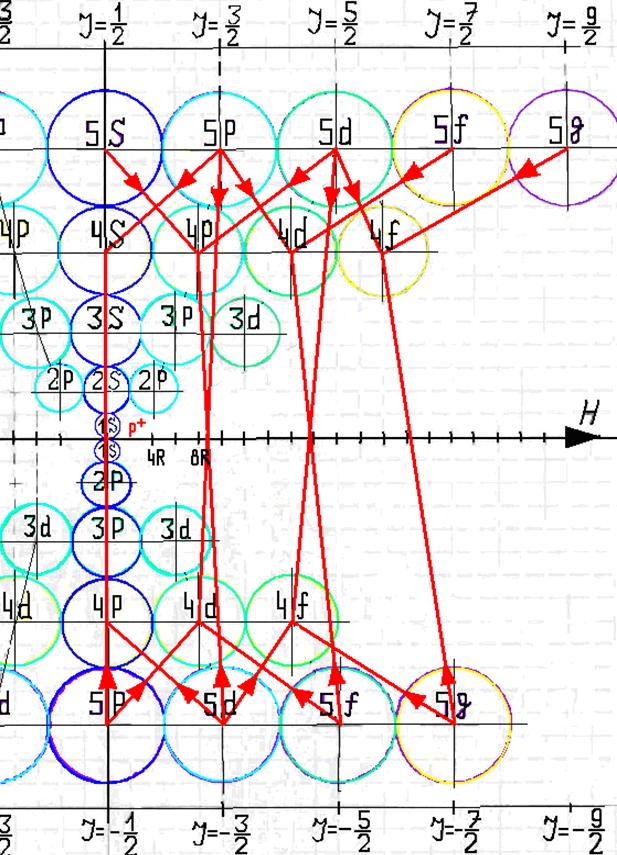
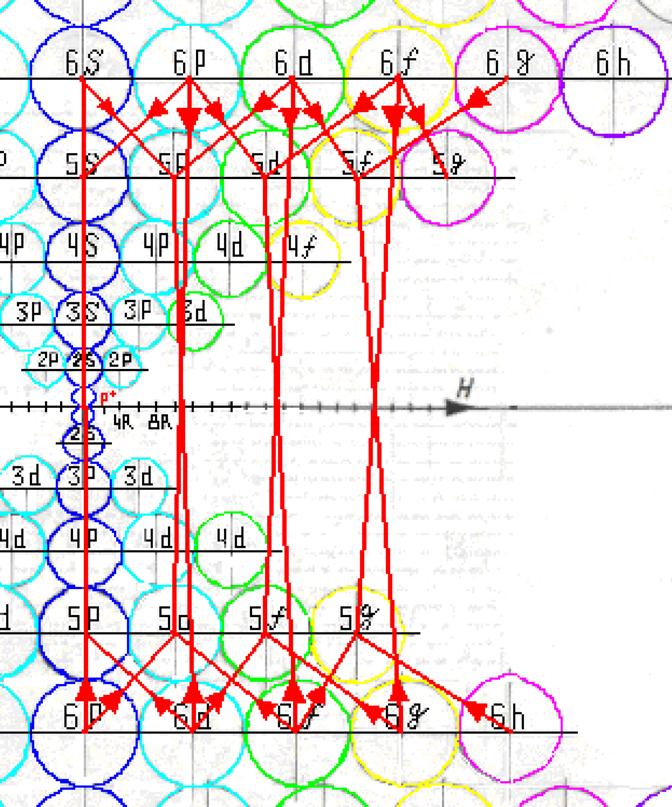
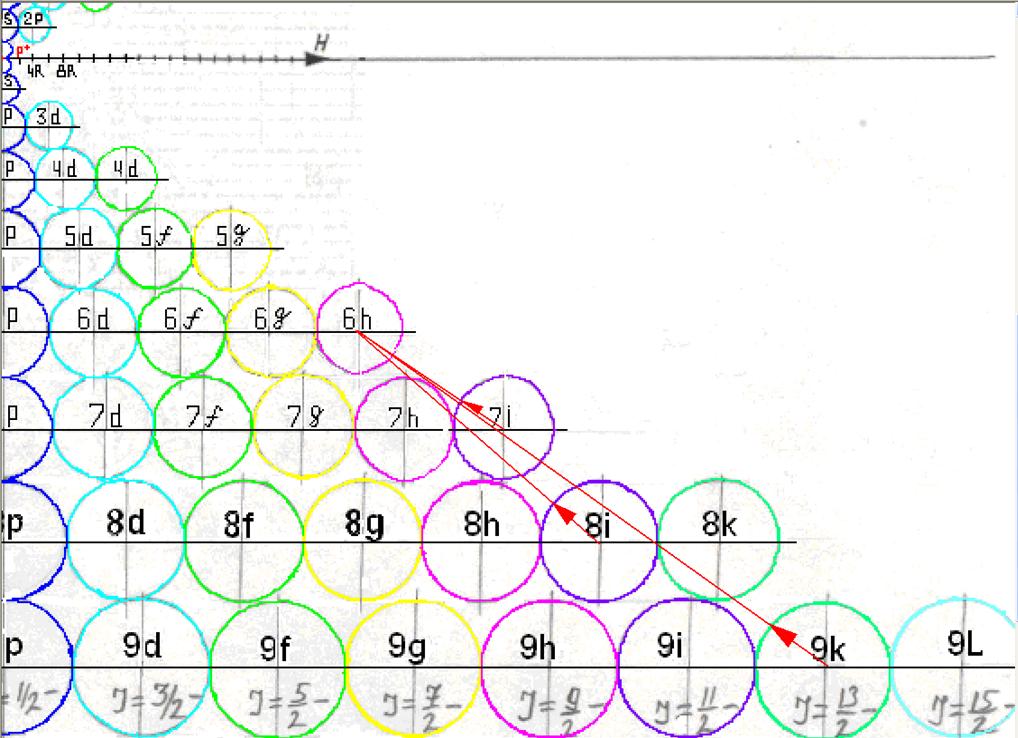
10. Траектории электронного вихря на прецессионных орбитах в атоме водорода
11. Излучательные переходы электрона в атоме водорода
12. Таблица – схема. Переходы и длина волны фотона первых 30 спектральных линий серии Лаймана по Никитину А Н.
13. Таблица – схема. Переходы и длина волны фотона первых 30 спектральных линий серии Бальмера по Никитину А Н.
14. Таблица - схема. Переходы и длина волны фотона первых 11 спектральных линий серии Пашена по Никитину А. Н.
15. Таблица - схема. Переходы и длина волны фотона первых 7 спектральных линий серии Брекета по Никитину А. Н.
16. Таблица - схема. Переходы и длина волны фотона первых 6 спектральных линий серии Пфунда по Никитину А. Н.
17. Таблица - схема. Переходы и длина волны фотона первых 5 спектральных линий серии Хемфри по Никитину А. Н.
18. Фотон - это спиральная деформация эфира
19 . Механизм излучения фотонов
20. Фотон геометрические размеры
21. Взаимодействие электрона с фотонами эффект Комптона
22. Анализ таблицы амплитудных, вращательных, прецессионных частот электрона и скоростей вращения на разных орбитах в атоме водорода
23. Таблица. Амплитудные, вращательные, прецессионные частоты электрона и скорости вращения на разных орбитах в атоме водорода.
24. Уровни энергий электрона в атоме водорода, частоты излучаемых фотонов νf и длины волн λ f фотонов при различных энергетических переходах
Послесловие
Литература
|
1 Завершённая периодическая система химических элементов Д.И.Менделеева |
|
|
2. Строение атомных ядер
и электронных оболочек
120 химических элементов
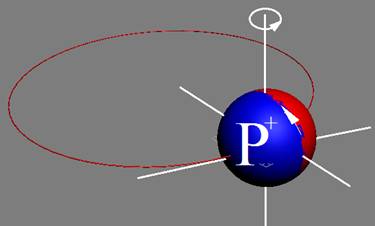
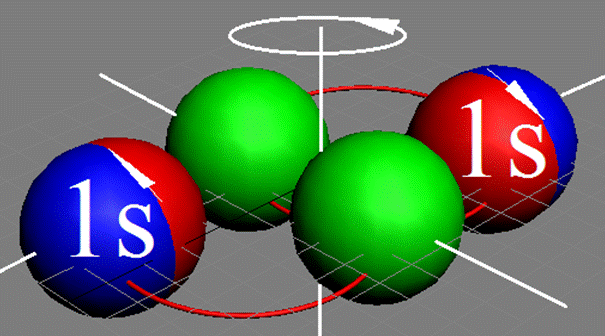
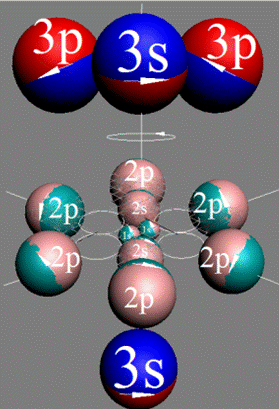
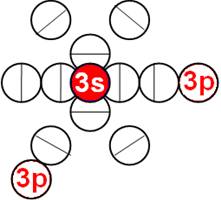
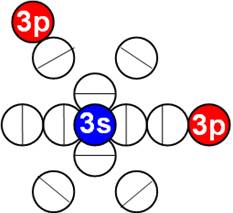
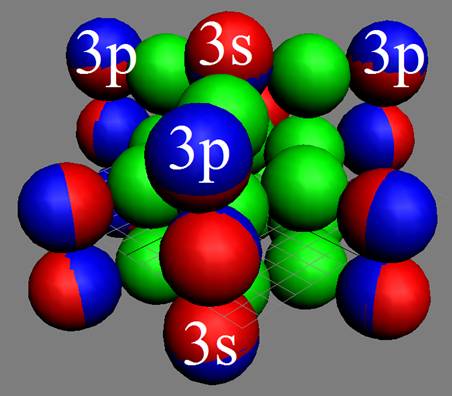
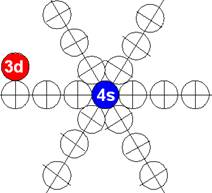
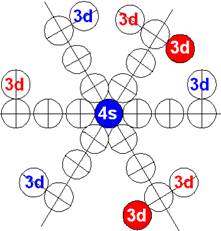
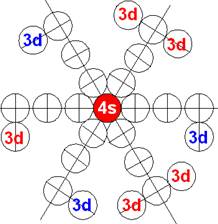
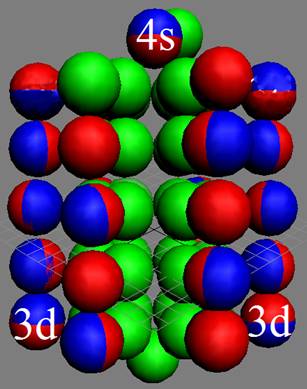
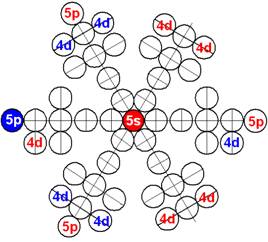
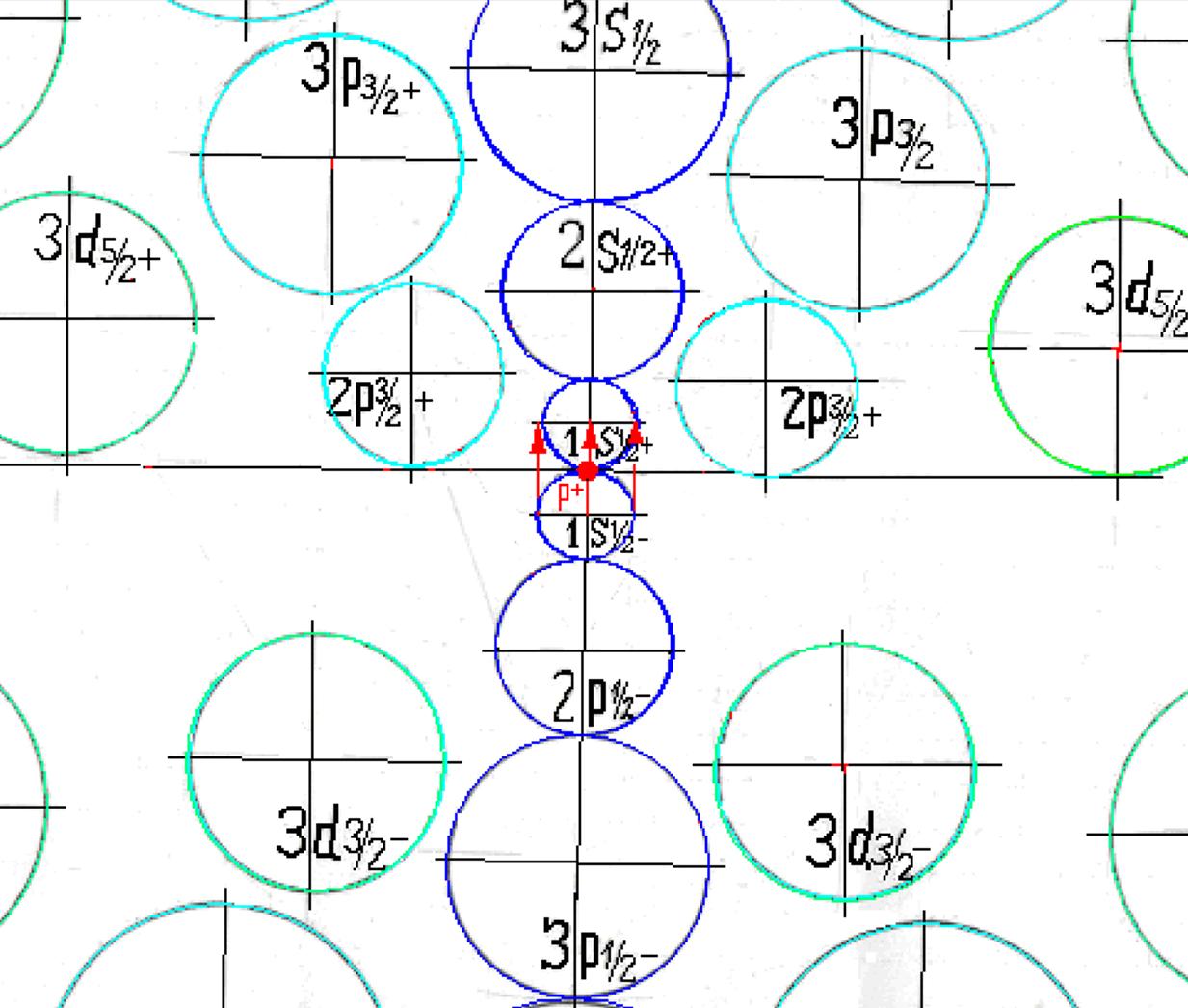
1. Водород.
|
|
|
|
|
|
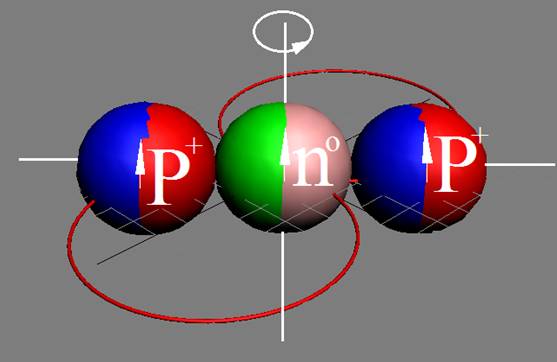
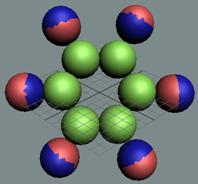
Ядро изотопа водорода 1Н спин J=1 /2+ валентность 1 |
Развёртка протонной оболочки ядра Н |
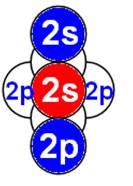
Электронная оболочка и эл. формула атома водорода 1s1 валентность 1 |
Схема электр-ой оболочки атома водорода валентность 1 |
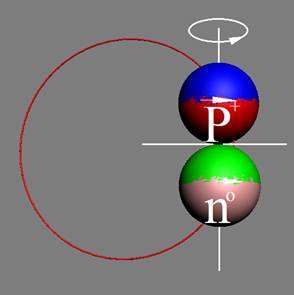
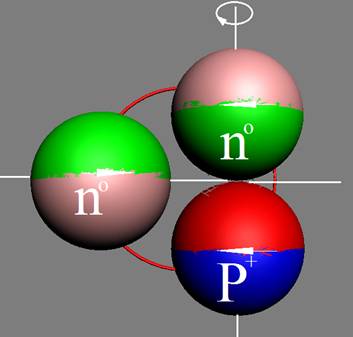
1. Водород Н - существует в двух стабильных изотопах 1Н (99,985%) - протий и 2Н (0,015%) – дейтрон (дейтерий). Строение ядра трёх изотопов водорода, имеющих практическое значение - протий, дейтерий и тритий отражено на рисунках ниже. Спины (вращение) нейтрона и протона в дейтроне (дейтерии) параллельны, в нем осуществляется их осевой контакт. Это подтверждается результатами научных экспериментов с дейтерием (дейтроном).
|
|
|
|
|
Протий 1Н Суммарный спин J = 1/2+ |
Дейтерий 2Н Суммарный спин J = 1/2+1/2+=1+ |
Тритий 3Н Суммарный спин J = 1/2+1/2+3/2- = 1/2- |
Спин водородных ядер по своему характеру аналогичен спину электронов и также сопровождается возникновением магнитных полей. Направление магнитного поля протона противоположно магнитному полю электрона. Этим обеспечивается их магнитное расталкивание, и поэтому они не аннигилируют при контакте.
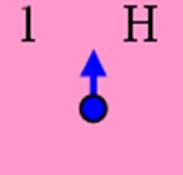
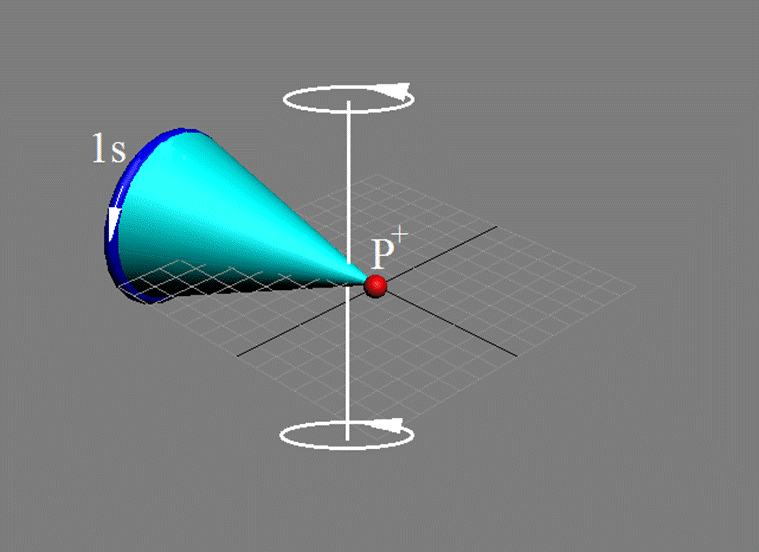
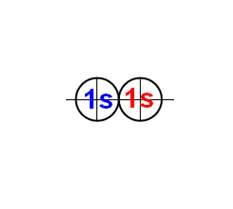
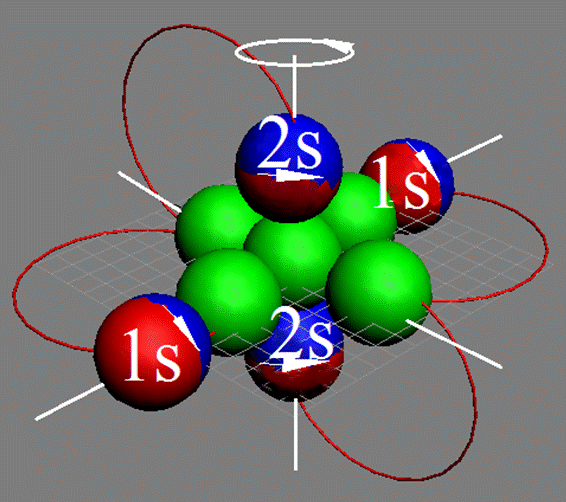
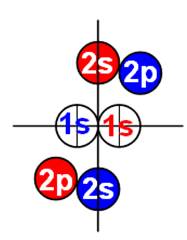
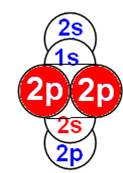
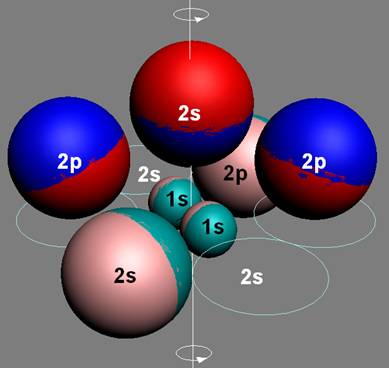
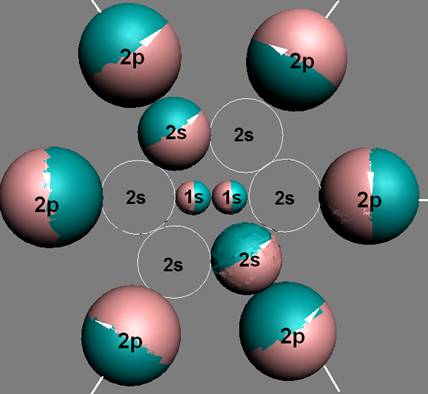
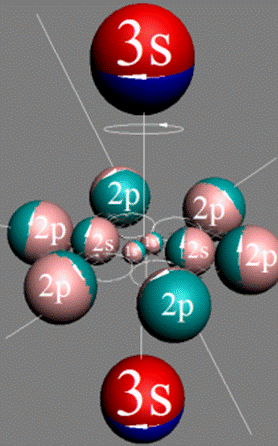
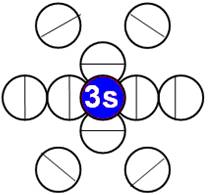
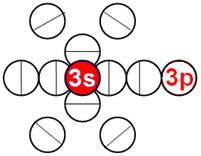
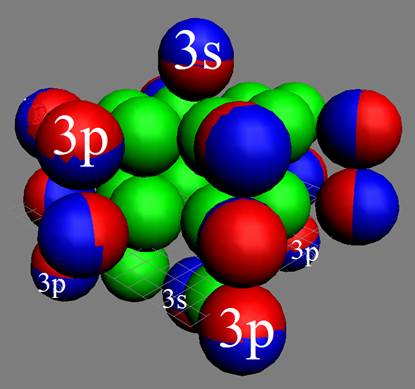
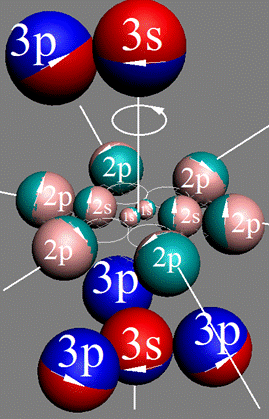
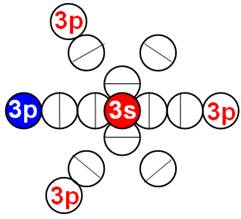
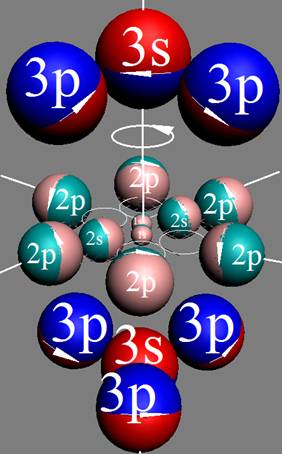
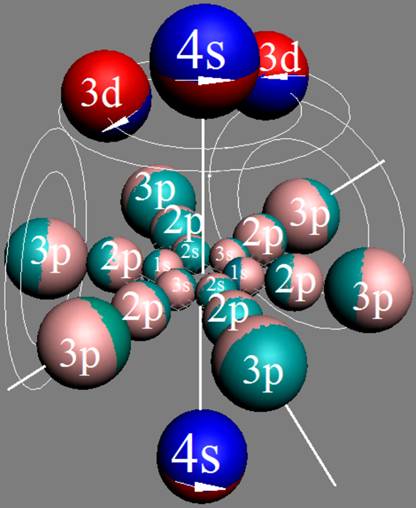
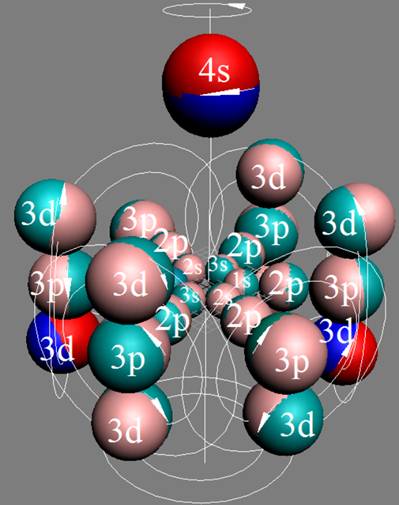
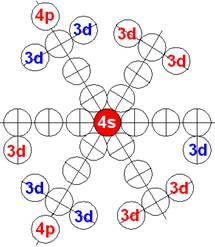
Электронная формула атома водорода Н - 1s1.
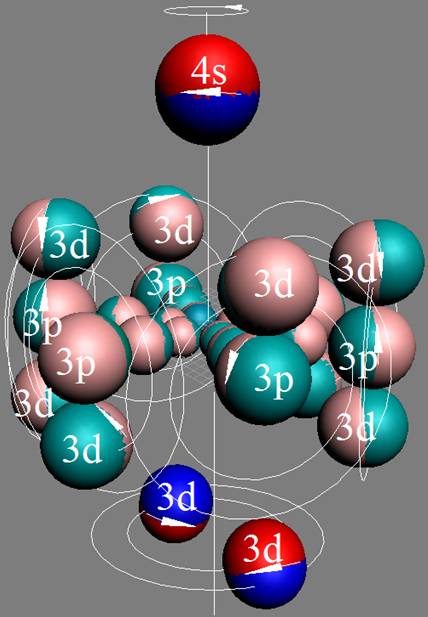
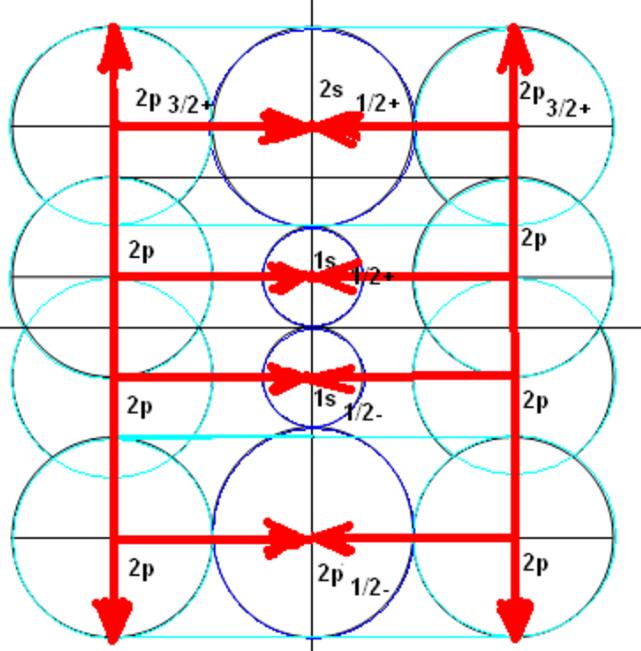
Протон атома водорода почти равновероятно может захватить свободный электрон двумя способами, северным магнитным полюсом (спин J= +1/2) или южным магнитным полюсом (спин J=-1/2). Но частота вращения электрона, а отсюда и энергия вращения электрона справа и с лева от ядра атома водорода немного различаются. Поэтому при переходе электрона с орбиты J = -1/2 на стационарную Боровскую орбиту со спином электрона J = +1/2 излучается фотон с длиной волны λ = 21,1см уносящий излишнюю вращательную энергию.
Так возникает сверхтонкое расщепление основного 1s энергетического уровня атома водорода. Вся Вселенная, заполненная атомарным водородом, и он излучает на этой волне λ = 21,1см. Этот шум по традиции, ошибочно, называют «реликтовым излучением».
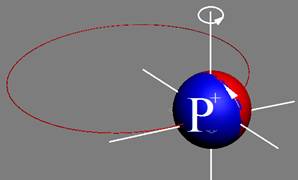
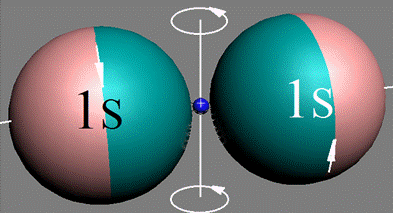
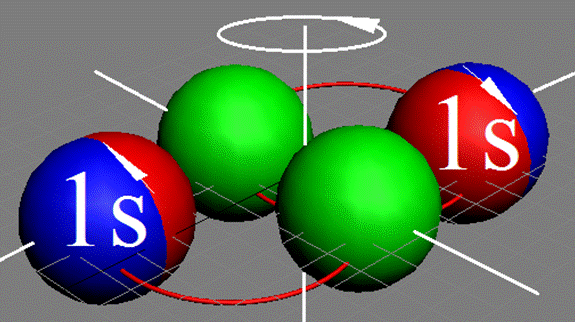
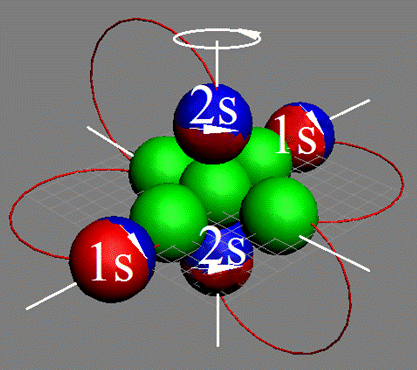
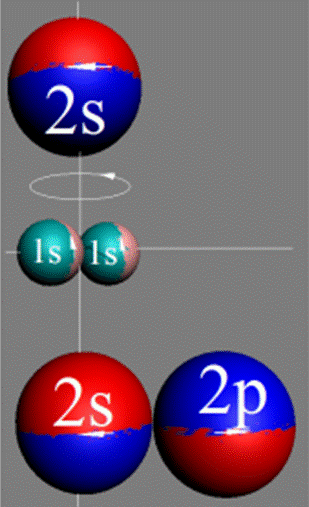
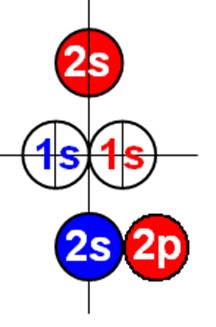
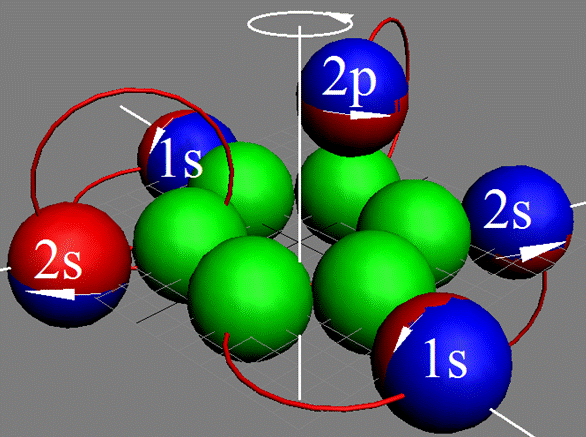
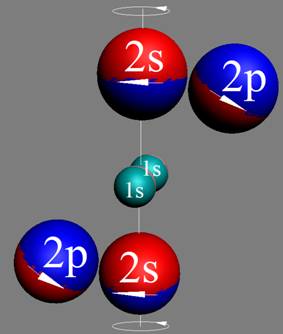
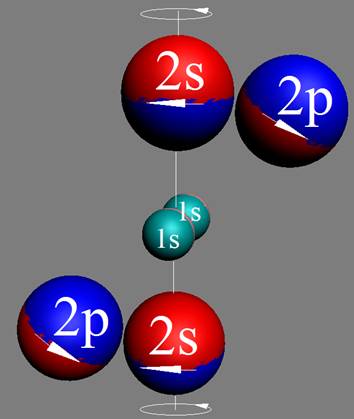
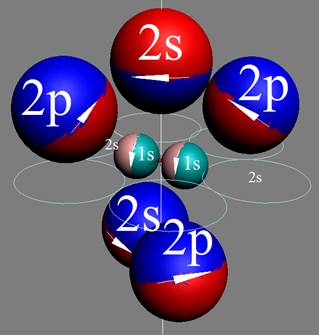
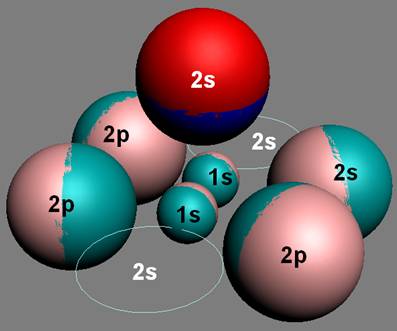
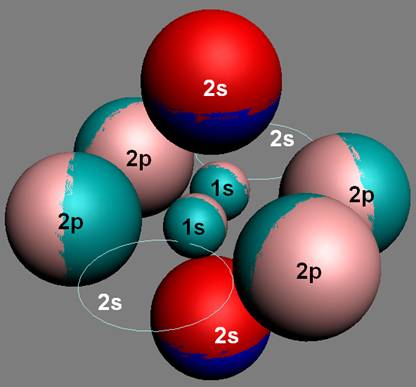
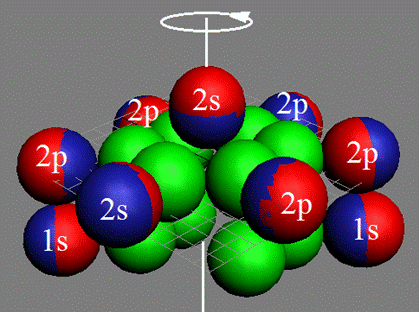
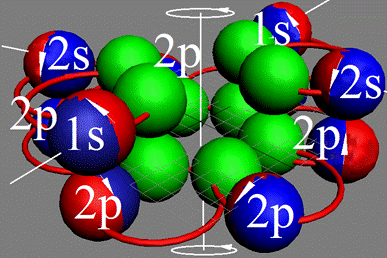
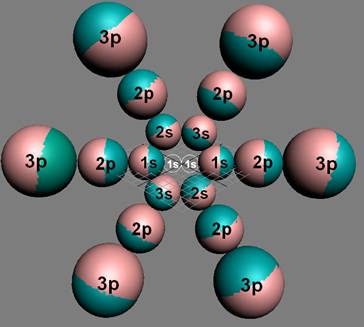
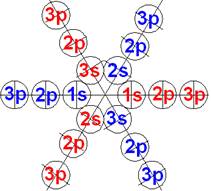
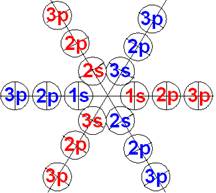
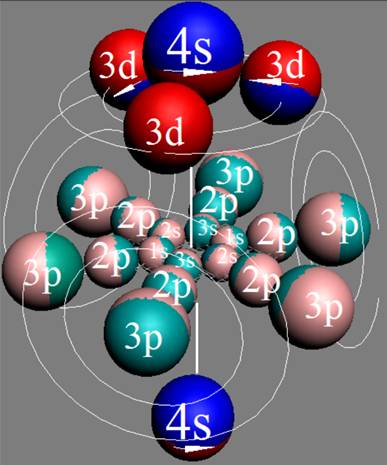
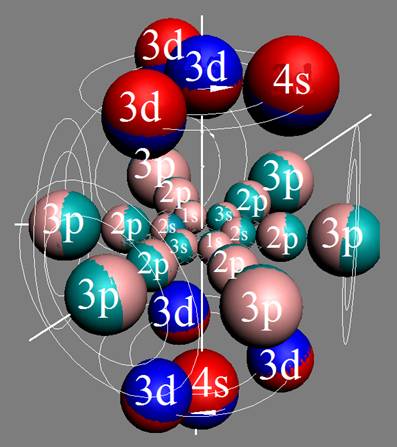
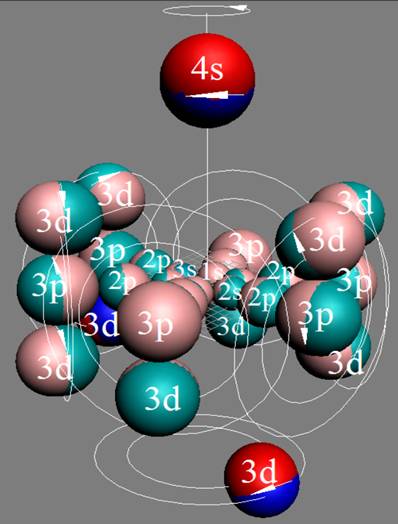
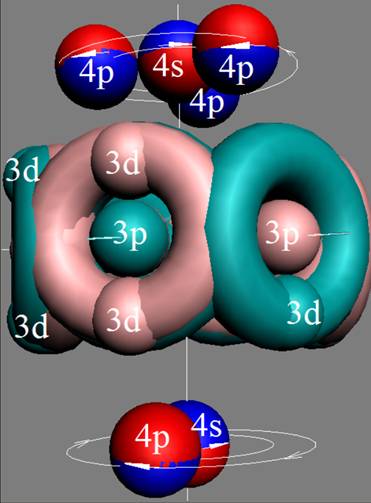
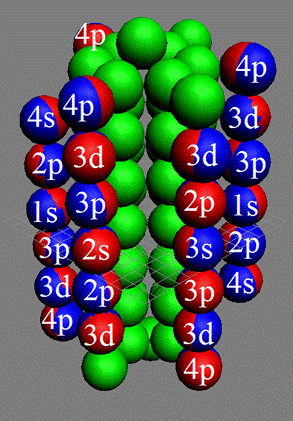
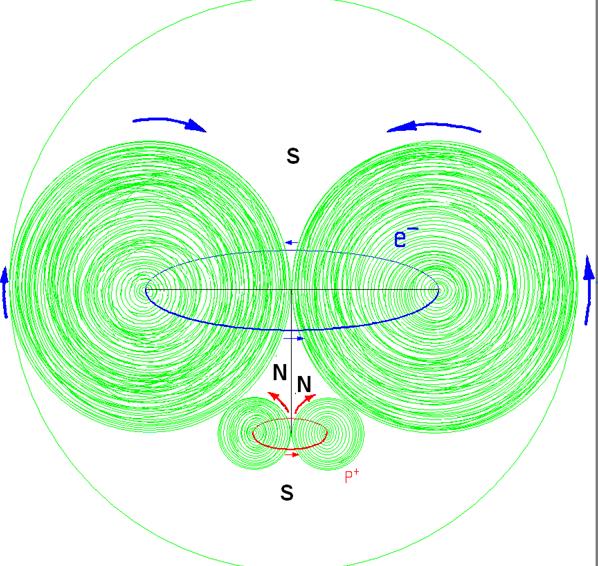
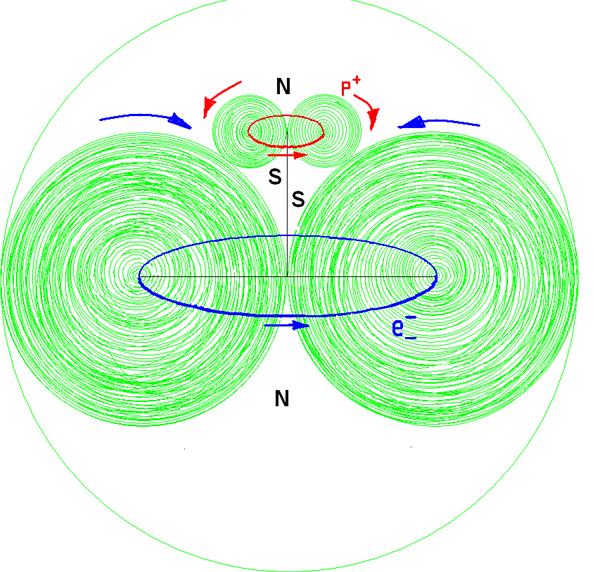
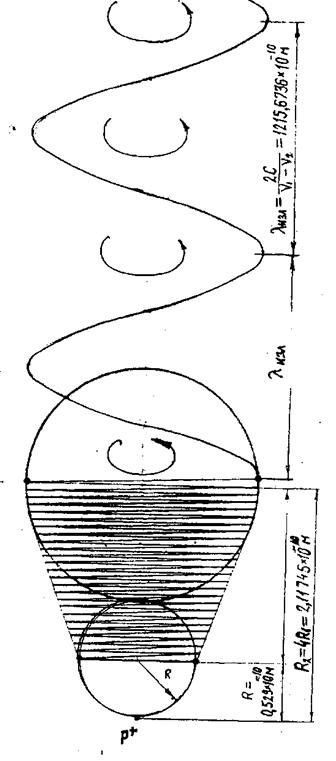
Атом водорода очень быстро вращается вокруг общего центра масс протона и его электрона см. рис. ниже. Это вращение не позволяет электрону атомарного водорода вступать в электромагнитные химические связи. Поэтому атомарный водород химически инертен. Открытый космос заполнен очень разряжённым химически инертным атомарным водородом.
|
|
|
Рис. Вращение атома водорода вокруг общего центра масс протона c массой 1837me и его электрона с массой me. |
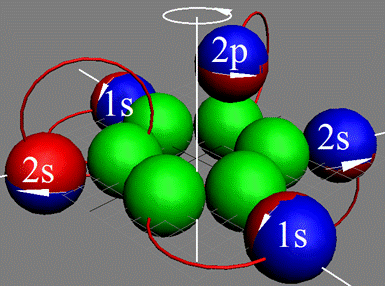
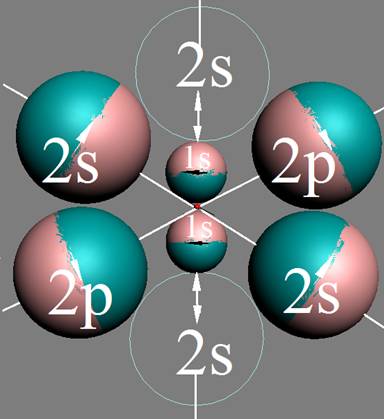
Так как частота вращения электрона, а отсюда и энергия вращения электрона справа и с лева от ядра атома водорода на втором энергетическом уровне немного различаются, появляется так называемый Лэмбовский сдвиг, различие между энергиями стационарных 2s1/2+ и 2p1/2- состояний атома водорода и в водородоподобных ионах.
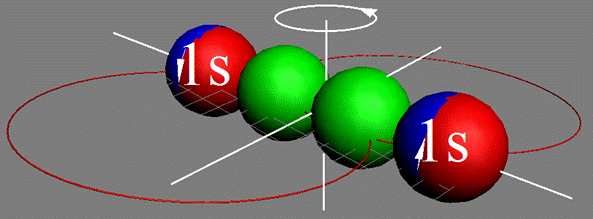
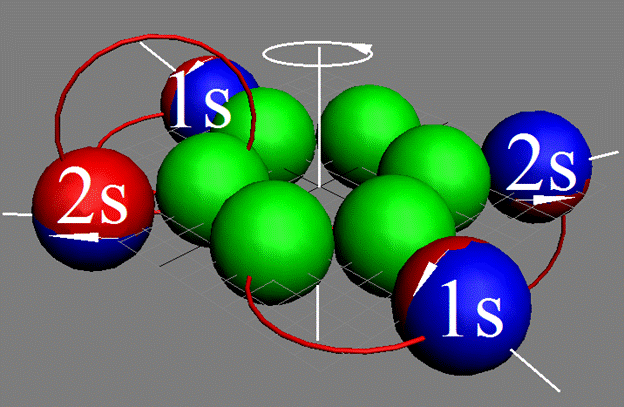
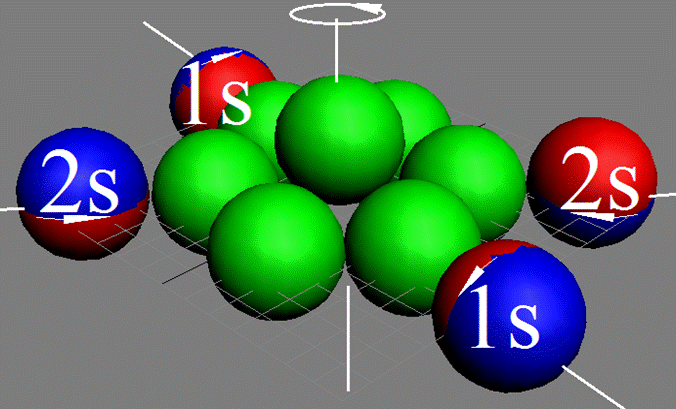
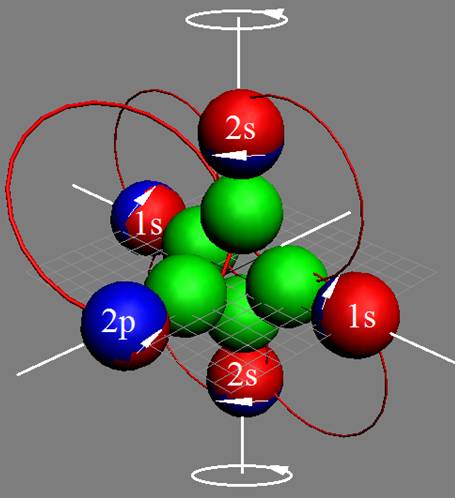
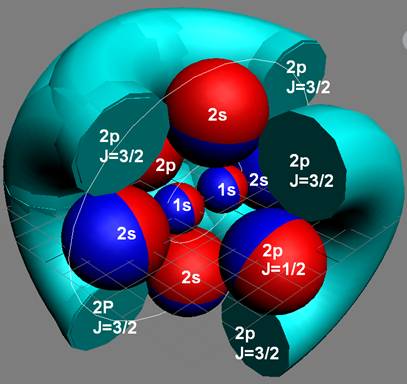
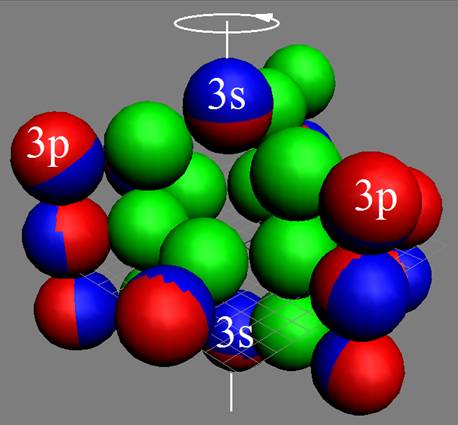
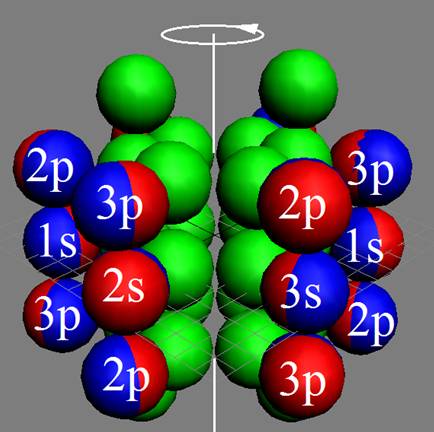
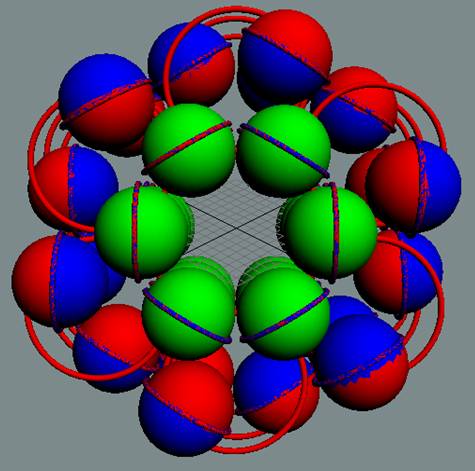
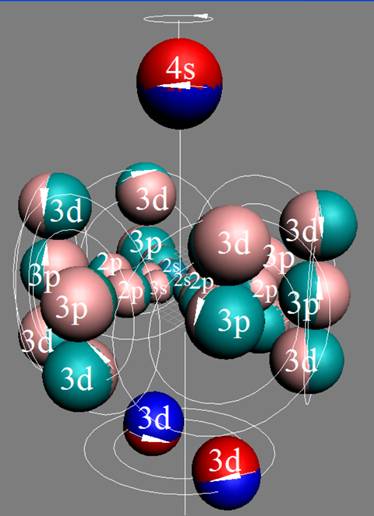
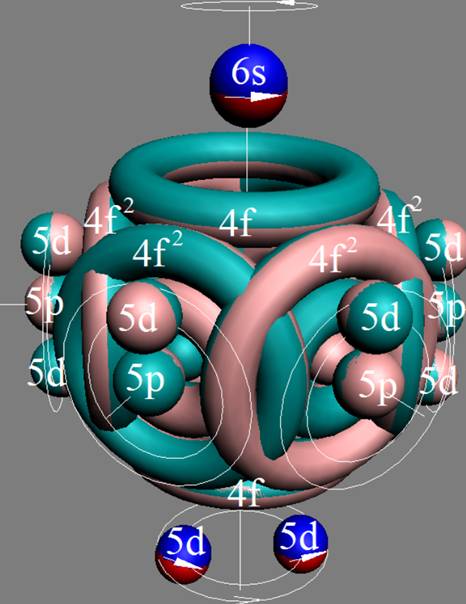
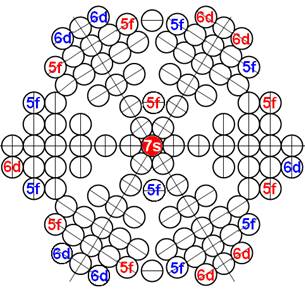
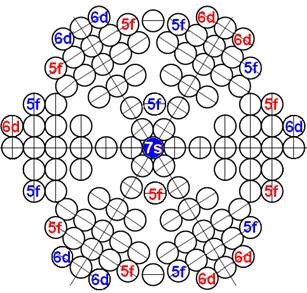
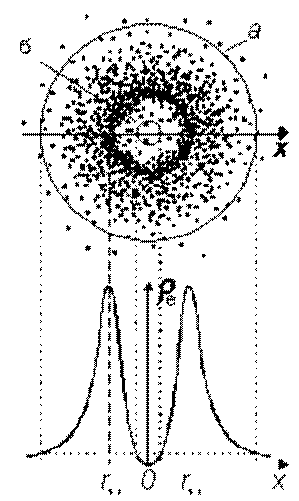
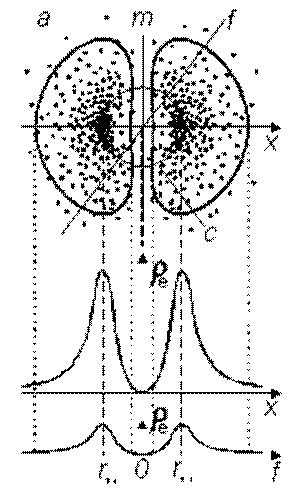
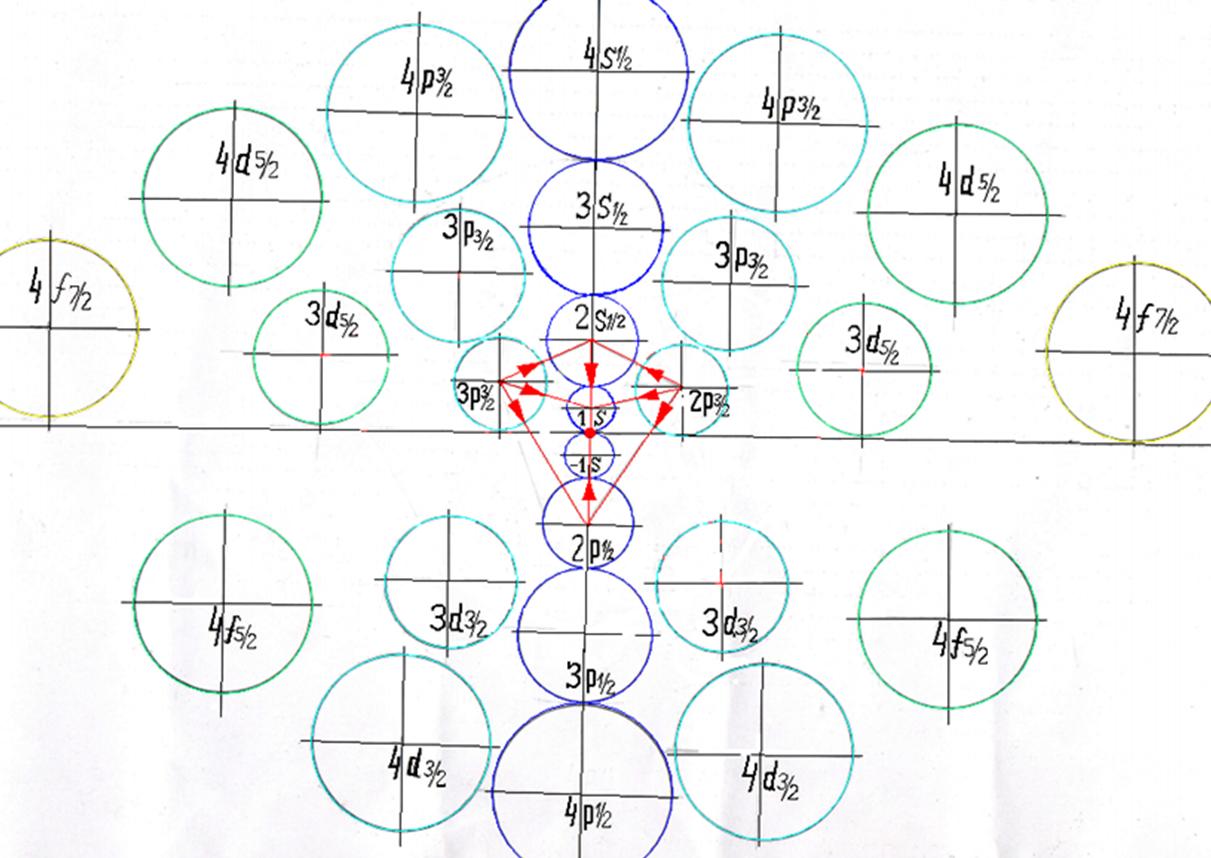
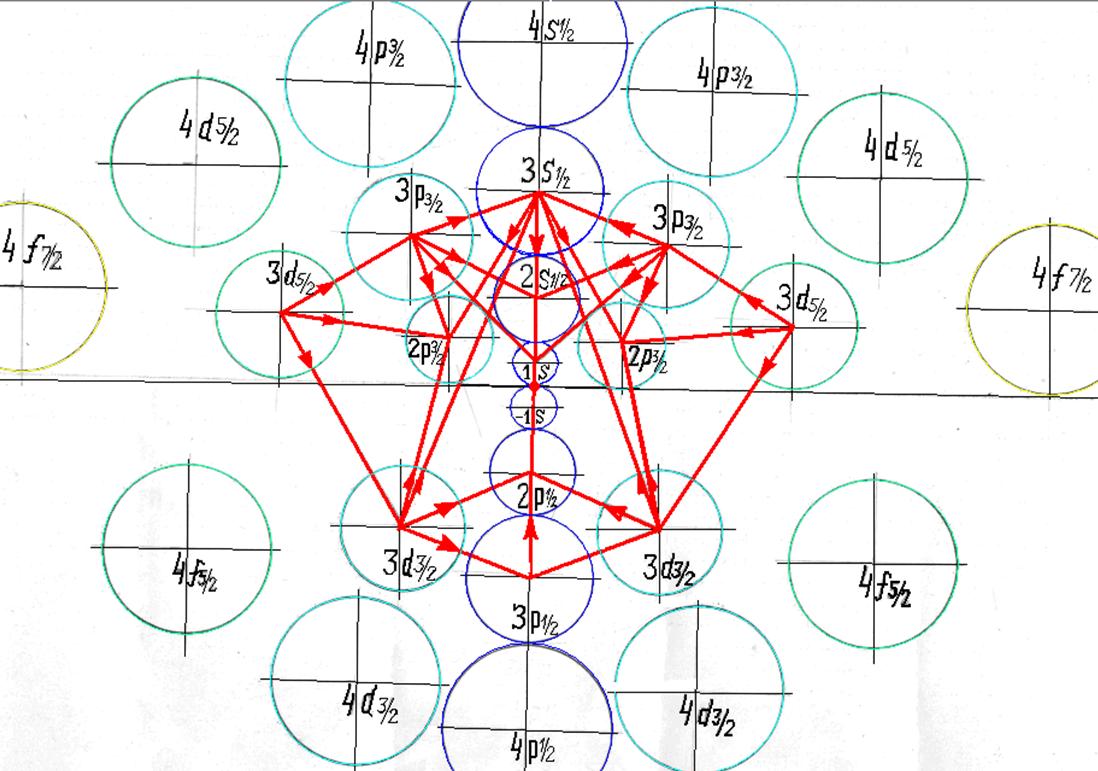
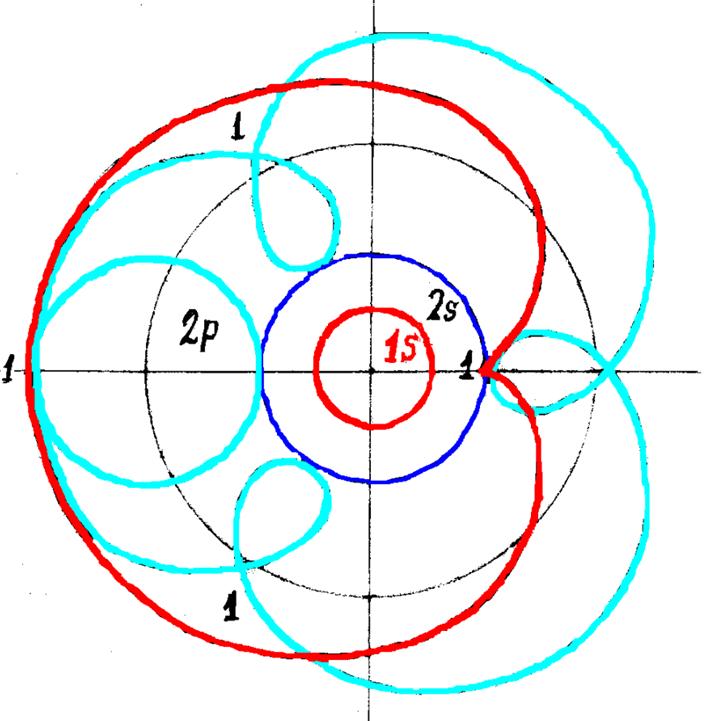
Протон атома водорода почти равновероятно может захватить свободный электрон двумя способами, северным магнитным полюсом (спин J+) или южным магнитным полюсом (спин J–). В этом заключается причина возникновения сверхтонкого расщепления всех энергетических уровней атома водорода, см рис ниже (Визуализация орбит шести энергетических уровней в атоме водорода, построенных по данным спектрометрии).
На рисунке заметно преобладание орбит с положительным спином электрона в атоме водорода.
|
|
|
Рис. Визуализация орбит шести энергетических уровней в атоме водорода, построенных по данным спектрометрии. Заметно преобладание орбит с положительным спином электрона в атоме водорода. |
Атомарный водород парамагнитен, он усиливает внешнее магнитное поле, выстраиваясь вдоль линий магнитного поля. В магнитном поле спины электронов атомарного водорода стремятся выстроиться по направлению поля, усиливая его, хотя этот порядок и нарушается хаотическим тепловым движением. Поэтому парамагнитная восприимчивость зависит от температуры: чем ниже температура, тем выше значение. Все это происходит только в магнитном поле, без него хаос и все микрочастицы сами по себе.
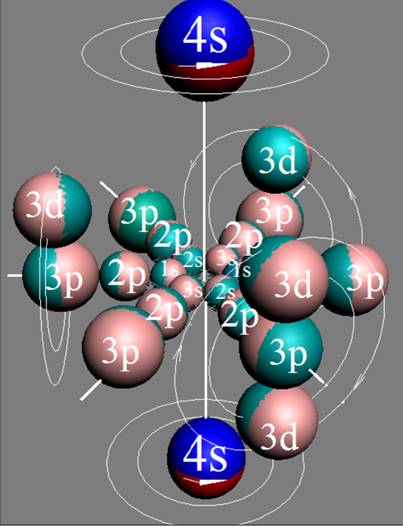
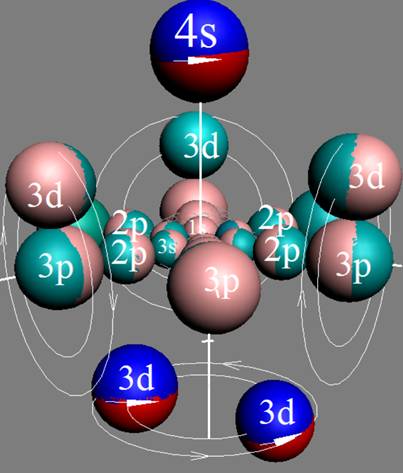
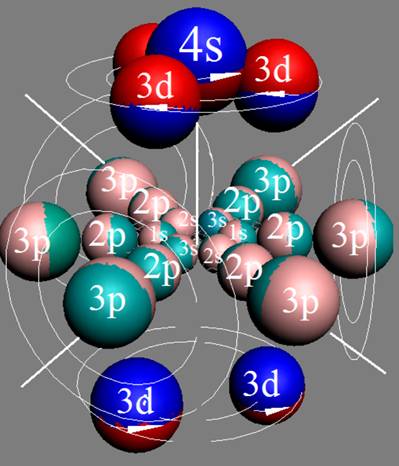
На приведённой модели строения электронной оболочки и ядра атома водорода, можно продемонстрировать пять квантово механических эффектов и объяснить причины парамагнетизма атомов водорода:
1 химической инертности атомарного водорода,
2 причина возникновения сверхтонкого расщепления основного 1s энергетического уровня атома водорода,
3 причина возникновения, так называемого Лэмбовского сдвига
4 вероятность присутствия электрона в центре ядра атома не равно нулю.
5 причина возникновения молекул пара-водорода и ортоводорода
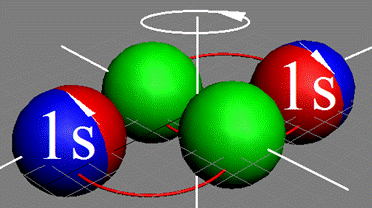
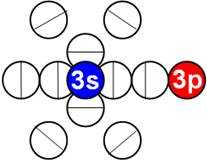
2. Гелий.
|
|
|
|
|
|
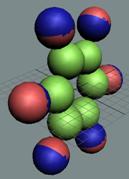
Ядро изотопа парагелия 4He J = 0+ валентность 0 |
Развёртка протонной оболочки ядра 4He |
Электронная оболочка и электронная. формула атома парагелия - 1s2 валентность 0 |
Схема элект-й оболочки атома гелия валентность 0 |
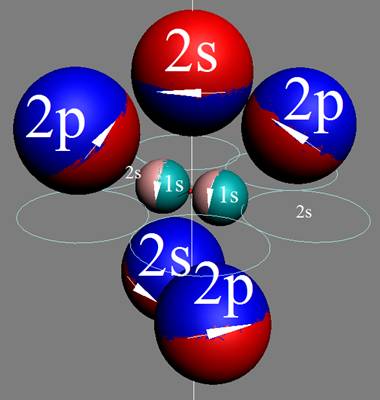
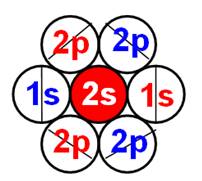
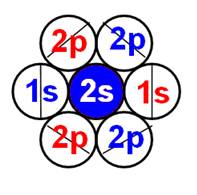
2. Гелий – He. Химический элемент с чётным зарядом состоит из двух стабильных изотопов 4He (99,9999%) и 3He (0,0001%). В основном состоянии 4He не имеет ни магнитного момента, ни электрического дипольного момента. Это возможно только при структуре ядра, показанной на рисунке изотопа гелия 4He2. ниже. Хорошо видна причина инертности гелия. Быстрое вращение ядра атома в экваториальной плоскости не позволяет гелию вступать в химические реакции см. рис пиже.
|
|
|
|
Структура ядра пара-гелия (гелий-1) спины протонов антипараллельные ↑↓ Протоны вращаются на встречу друг к другу. |
Структура ядра орто-гелия (гелий-2) спины протонов параллельные ↑↑. Протоны вращаются в одну сторону. |
Спиновые взаимодействия двух пар протонно-нейтронных вихрей создают условия, при которых оба протона могут иметь одноимённые свободные магнитные полюса. В результате одноимённые полюса будут иметь и электроны с одинаковым спином, что создаёт условия для отсутствия магнитного момента у атома гелия.
Спектр нейтрального гелия делится на две отдельные категории, соответствующие термам, которые не были взаимно связаны. Эти две системы совершенно независимых линий получили название спектров ортогелия и парагелия.
Электронная формула ортогелия (гелий-2) - 1s12s1 .
Электронная формула парагелия (гелий-1) - 1s2.
Два электрона атома гелия могут иметь спины параллельные ↑↑ (орто-гелий гелий-2) или антипараллельные ↑↓ (пара-гелий гелий-1). Обе формы сосуществуют в обычном гелии, в соотношении примерно 1 к 3, причем переход между ними относится к «запрещенным» см.рис. ниже.
Энергия основного состояния орто-гелия (гелий-2) выше, чем энергия основного состояния пара-гелия (гелий-1), однако переход орто-гелия в пара-гелий невозможен, так как должен сопровождаться переворотом спина протона ядра атома, поэтому состояния орто-гелия устойчивы. Перевести орто-гелий в пара-гелий возможно, например, путем бомбардировки атома пучком электронов, тогда, возможно разворачивание спина протона ядра атома, при этом разворачивается и один из электронов в атоме, и состояние ортогелия превратится в возбужденное состояние парагелия.
|
|
|
|
Структура электронной оболочки пара-гелия (гелий-1) эл. формула - 1s2. В возбуж-денном состоянии. спины электронов у оппозитных протонов антипараллельные ↑↓ Электронные оболочки вращаются на встречу друг к другу. |
Структура электронной оболочки орто-гелия (гелий-2) эл. формула - 1s12s1. В возбужденном состоянии. спины электронов у оппозитных протонов параллельные ↑↑ Электронные оболочки вращаются в одну сторону |
Мультиплетность для пара-гелия антинараллельна - ↑↓ будет равна 1 с одиночными линиями в спектре
J = 0
Потому что оба электрона у пара-гелия смотрят на ядро северным полюсом и имеют одно значения спина +. При любых переходах обоих электронов энергия их излучения абсолютно одинаковая и налагается друг, на друга выдавая на спектрограммах только одну линию.
Мультиплетность для орто-гелия параллельная - ↑↑ равна 3 с триплетными (тройными) линиями в спектре. Потому что оба электрона у орто-гелия могут смотрят на ядро северным и южным полюсом и имеют два значения спина + и – см. рис. Ниже.
J=1/2- 1/2+=0
J=1/2+1/2+=1+
J=1/2- 1/2- =1-
|
|
|
|
|
|
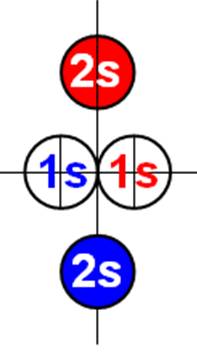
Электронная оболочка и эл. формула атома пара-гелия (гелия-1) 1s2 J = 0 валентность 0 |
Электронная об-чка и эл. формула атома орто-гелия (гелия-2) 1s12s1 J = +1 валентность 0 |
Электронная оболочка и эл. формула атома орто-гелия (гелия-2) 1s12s1 J = -1 валентность 0 |
Электронная оболочка и эл. формула атома орто-гелия (гелия-2) 1s12s1 J = 0 валентность 0 |
Химическая инертность гелия обеспечивается осью вращения атома. Атом гелия как бумеранг вращается в плоскости расположения нуклонов см. рис. ниже. В результате электроны, жёстко сцепленные магнитными силами с протонами, вращаются с огромной скоростью в плоскости вращения атома гелия, не имеют возможности вступать в магнитные взаимодействия с электронами других химических элементов см. рис пиже.
Но при очень низкой температуре экваториальное вращение атомов гелия настолько замедляется, что становится возможной химическая связь. Так образуется димер гелия, молекула He2. Это неожиданно большая молекула — среднее расстояние между атомами гелия намного больше их размеров. Димер гелия обладает исключительно маленькой энергией связи, около десятой доли микроэлектронвольта! Такая молекула разрушается не только при комнатной температуре, но и при температурах вплоть до милликельвинов. Это самая хрупкая молекула, известная на сегодняшний день.
|
|
|
|
Излучательные переходы электронов с орбит 2s на 1s в оболочке орто-гелия (гелия-2) |
Химическая инертность гелия обеспечивается осью вращения атома. |
|
|
|
|
Вид изотопа гелия 4He2.. Ось вращения не позволяет гелию вступать в химические реакции. Суммарный спин J = 0 |
Вид изотопа гелия 3He2 Ось вращения не позволяет гелию вступать в химические реакции. Суммарный спин J = +1/2 |
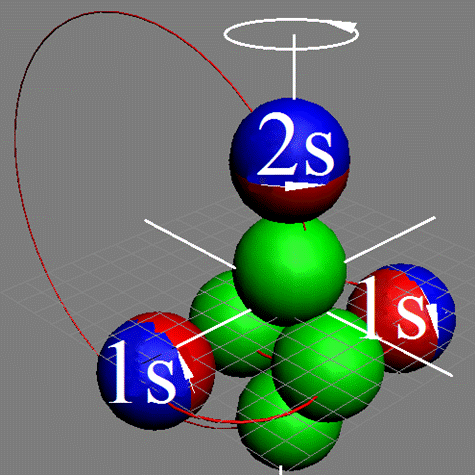
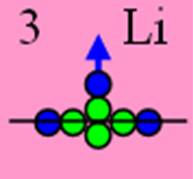
3. Литий.
|
|
|
|
|
|
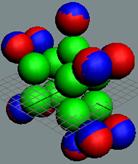
Ядро изотопа литий 7Li J = 3/2- валентность 1 |
Развёртка протонной оболочки ядра 7Li |
Электронная оболочка и эл. формула [He]2s1 атома лития валентность 1 |
Схема электро-ой оболочки атома лития валентность 1 |
3. Литий – Li. Химический элемент с нечётным зарядом состоит из двух стабильных изотопов 6 Li (7,42 %) и 7 Li (92,58 %). Тяжелый изотоп 7 Li прозрачен для нейтронов, имеет эффективное поперечное сечение захвата тепловых нейтронов 0,033 барн. Зато 6L активно поглощает тепловые нейтроны, его сечение захвата 912 барн. По способности захватывать тепловые нейтроны (поперечное сечение захвата) ядра этих изотопов отличаются очень сильно.
Почему?
Посмотрим на изображение лёгкого изотопа 6L. Видно, что он состоит из двух частей. Верхняя часть - это ядро атома водорода 2 дейтерий. Нижняя часть - это ядро атома гелия 4. Двойная прошивка нуклонов позитронами придают гелию 4 большую прочность.
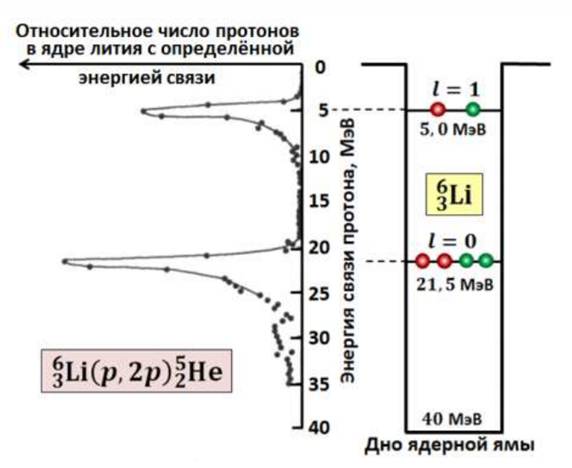
Эксперименты по выбиванию протона из ядра изотопа лития 6L показывают наличие у этого ядра двух групп протонов с энергиями связи 5,0 Мэв и 21,5 Мэв. Менее связанные протоны имеют суммарный орбитальный момент J = 1. Для более связанных протонов J = 0 см. рис ниже.
|
|
|
|
Эксперименты по выбиванию протона из ядра изотопа лития 6L показывают наличие у этого ядра двух групп протонов с энергиями связи 5,0 Мэв и 21,5 Мэв. |
Лёгкий изотоп 6L состоит из двух частей. Нижняя часть, это ядро атома пара-гелия (гелий-1) J =0+. Верхняя часть из дейтерия. J =1+ |
Верхняя часть - это ядро атома водорода 2 – дейтерий 2Н J =1+, в котором позитрон имеет возможность поймать ещё один нейтрон и превратиться в тритий 3Н. Налетающий медленный тепловой нейтрон легко насаживается на кольцо позитрона, образуя ядро атома трития 3Н. Круговое вращение позитрона обеспечивает большое сечение захвата теплового нейтрона.
Тяжелый изотоп 7Li имеет другое строение. Нижняя часть, это ядро атома пара-гелия (гелий-1) J =0+. Вторая осевая часть состоит из трития. J = 3/2-. Посмотрим на изображение изотопа 7Li, видно, что позитрон в этой конструкции переполнен нейтронами и не имеет более возможности их поглощать. Поэтому сечение захвата тепловых нейтронов у 7Li очень маленькое. В случае поглощения теплового нейтрона изотопом 7Li, получается короткоживущий тяжёлый изотоп лития 8Li, который через 0,01 секунду разваливается на два атома гелия 4He2 и один электрон е-.
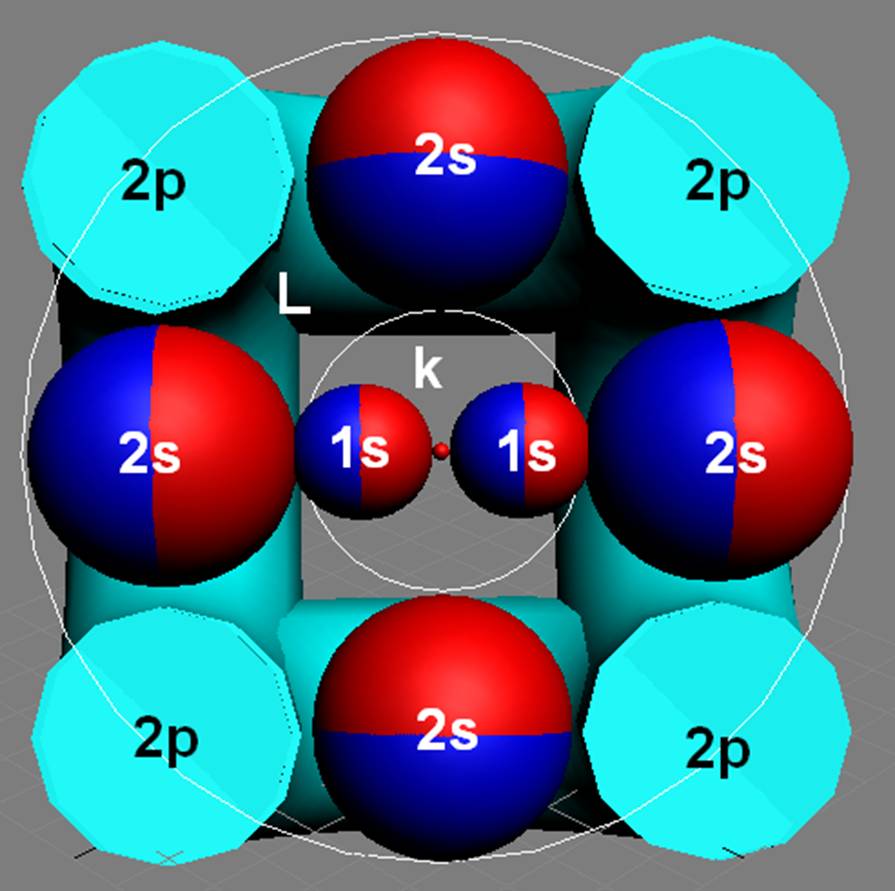
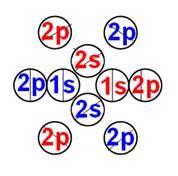
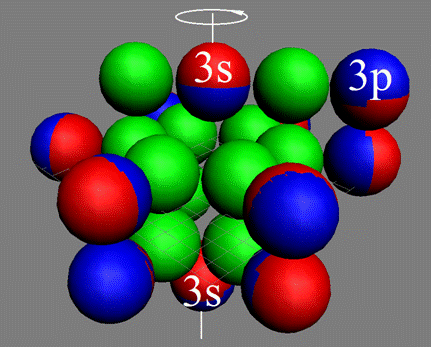
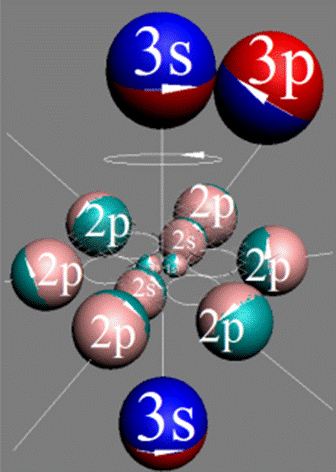
Электронная формула атома лития Li - [He]2s1 содержит три s-электрона, два из которых1s2 электроны заполнили К оболочку, а один - 2s электрон L оболочку.
Рождественский Д. (1925), сравнивая термы атомов щелочных элементов и водорода, установил, что число возможных орбит у щелочных атомов равно числу возможных орбит у атома водорода. Поэтому они имеют совершенно аналогичные и простые оптические спектры как у атома водорода.
При возбуждении s-электрона возникают дублетные термы конфигураций nl. Дуплетные термы возникают из за практически равной вероятности захвата 2s электрона третьим протоном ядра лития северным или южным магнитным полюсом.
«Запрещенные» по правилу отбора - 2s2S - nd2D и 2p2P0 - np2P0 переходы возникают из за того, что 2s электрон может занимать np и nd орбиты на оси Х двух 1s электронов.
|
|
|
Строение электронной оболочки лития в возбуждённом состоянии повторяет электронную оболочку водорода с дуплетными термами («запрещённые» орбиты по оси Х не нарисованы только обозначены. |
Из щелочных металлов Li обладает наименьшим атомным радиусом (0,157 нм), и следовательно, наибольшим ионизационным потенциалом, равным 5,39 эВ, поэтому литий химически менее активен по сравнению с другими щелочными металлами. Ионный радиус Li+ равен, по разным данным, 60-68х10-11м., что весьма близко к размерам атомов водорода и гелия. Благодаря малому атомному радиусу литий обладает наиболее прочной кристаллической решеткой по сравнению с остальными щелочными металлами. Это обусловливает наиболее высокие температуры плавления и кипения лития по сравнению с его аналогами.
Литий как и атомарный водород парамагнитен он усиливает внешнее магнитное поле, выстраиваясь вдоль линий магнитного поля, соединения его диамагнитны. В магнитном поле спины электронов лития стремятся выстроиться по направлению поля, усиливая его, хотя этот порядок и нарушается хаотическим тепловым движением.
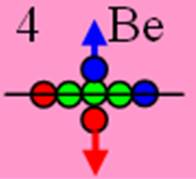
4. Бериллий.
4. Бериллий – Ве. Химический элемент с чётным зарядом, бериллий на 100% состоит из одного изотопа 9В с массовым числом 9. Из всех твердых материалов бериллий считается лучшим замедлителем нейтронов. Бериллий (а также его окись) отличают малое сечение захвата нейтронов и большое сечение их рассеяния. Бериллий при небольшом атомном весе почти не захватывает нейтроны, он просто замедляет скорость их движения за счет столкновений с атомами бериллия.
Почему?
Это свойство объясняется очень компактной структурой строения ядра атома бериллия и насыщенностью позитронов нуклонами. Фактически ядро изотопа 9В можно рассматривать как два ядра атома гелия. На каждый из четырёх позитронов ядра атома бериллия 9Ве приходится по три нуклона. Это предельное число нуклонов, что может очень долго удержать один позитрон см рис изотопа водорода трития. Поэтому бериллий 9Ве просто не способен захватить «лишний» нейтрон. Ну а если такое маловероятное событие произошло, то изотоп бериллия 9Ве превращается в долгоживущий изотоп бериллия 10Ве с полной перестройкой структуры ядра см. рис. ниже.
|
|
|
|
|
|
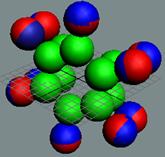
Ядро изотопа берилий 9Ве J = 3/2- валентность 2 |
Развёртка протонной оболочки ядра Ве |
Электронная оболочка атома и эл. формула атома Ве бериллия [He]2s2 макс. валентность 2 |
Схема электрон-й оболочки атома бериллия валентность 2 |
Если изотоп бериллия 9Ве имеет объёмно крестовую структуру строения нуклонов см. рис. выше. Его пяти нейтронов не хватает для образования шестигранного нейтронного остова. То уже у изотопа бериллия 10Ве, мы впервые наблюдаем образование этого шестинейтронного остова, см. рисунок ниже. Но протонное кольцо у изотопа бериллия 10Ве ещё не завершённое, для его завершения не хватает двух протонов, этим объясняется его нестабильность. Это симметричный долгоживущий изотоп, с периодом полураспада 2,7х106лет. Его шесть нейтронов образуют шестигранный остов, на который пришиты позитронами четыре протона.
|
|
|
|
Ядро изотопа берилий 9Ве J = 3/2- пяти нейтронов не хватает для шести-нейтронного остова. |
Ядро изотоп бериллия 10Ве J = 0+, впервые образуется шести-нейтронный остов |
Два позитрона, лежащие в экваториальной плоскости вращения ядра изотопа 9Ве, скрепляют по три нуклона. Такая прошивка ограничивает их подвижность, и протон в такой связке не может развернуться в валентное полярное положение. Два других позитрона скрепляют ещё по три нуклона. Такая позитронная связка, перпендикулярна плоскости вращения изотопа и не ограничивает подвижность двух валентных протонов. Позитронная прошивка не позволяет двум экваториальным протонам развернуться в валентное положение. Поэтому в химических связях участвует только два полярных протона и их электроны. Максимальная валентность 2.
|
|
|
|
Изотоп бериллия 9В позитронная прошивка связывает все его нуклоны J = 0+ |
Седьмой центрально-осевой нейтрон придаёт другому изотопу бериллия 11Ве спин J = 1/2–. |
Электронная формула атома Ве бериллия [He]2s2. Каждый из его четырёх электронов взаимодействует со своим протоном ядра. Симметричность ядра порождает симметричность атома и симметричность электростатических сил, действующих между его электронами. В результате, когда они все находятся в атоме, то энергии связи у них с протонами ядра одинаковые на одноимённых энергетических уровнях. Седьмой центрально-осевой нейтрон придаёт другому изотопу бериллия 11Ве спин J = 1/2–.
5. Бор.
|
|
|
|
|
|
Ядро изотопа бор 11В J = 3/2+ макс валентность 3 |
Развёртка протонной оболочки ядра В |
Электронная оболочка и эл. формула атома B бора [He]2s22p1 макс. валентность 3 |
Схема электрон-й оболочки атома бора валентность 3 |
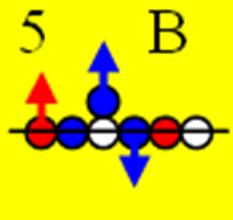
5. Бор – В. Химический элемент с нечётным зарядом состоит из двух стабильных изотопов бора 11В (80,39%) и 10В (19,6%). Атомное ядро изотопа бора 11В несимметрично, что подтверждает его спин ( J = 3/2-) и имеет такой вид, см. рисунок выше. Его шесть нейтронов образуют шестигранный остов, на который позитронами прошиты, пять протонов. Каждый из его пяти электронов взаимодействует со своим протоном ядра.
|
|
|
|
Ядро изотопа бора 10В J = 3+, пяти нейтронов не хватает для шести-нейтронного остова. |
Ядро изотопа бор 11В J = 3/2+ образуется шести-нейтронный остов как у берилия 10Ве |
Электронная формула B [He]2s22p1. Пяти электронам невозможно симметрично разместиться на орбите, предназначенной только для шести электронов. Пятый электрон выталкивается электростатическими силами четырёх электронов в торец ядра. Два первых 1s2 электрона, на оси Х, занимают первую K оболочку см.рис ниже. Причём оба его 1s2 электрона, согласно принципу Паули, как у орто-гелия, могут периодически занимать орбиты 2s2 электронов на оси Х. Оставшиеся два 2s2 электрона и один 2p1 электрон образуют вторую L оболочку. Один 2p электрон L оболочки не может занять 2s2 экваториальную не валентную орбиту на оси Х. Поэтому пятый электрон у бора занимает полярную 2p орбиту, постоянно вращаясь вокруг 2s2 полярного валентного электрона на оси У. Поэтому бор всегда трёхвалентен.
|
|
|
Порядок заполнения электронных орбит первых двух энергетических уровней. |
Протон, жёстко, намертво сцепленный со своим 2p+ электроном, следует за ним. Но он не может занять, ни центрально осевую позицию, не хватает оппозитного протона, ни боковую как остальные протоны, его связывает 2p+ электрон. Поэтому протон занимает среднее положение с спином J = 3/2+. Все остальные протоны симметрично расположены и дают суммарный спин ядра J = 0.
Ещё более интересно строение атомного ядра изотопа бора 10В. В этом ядре всего пять нейтронов, и он имеет такой крестообразный вид, см. рисунок выше. Недостающий шестой нейтрон придаёт стабильному изотопу бора 10В очень высокий несбалансированный суммарный ядерный спин J = 3+. Он складывается из двух несбалансированных и четырёх осевых нуклонов.
J = -5/2 - 3/2+1/2+1/2+1/2+1/2 = -8/2+2/2 = 6/2+ = 3+
6. Углерод.
|
|
|
|
|
|
Ядро изотопа углерод 12С в аллотропной форме графита J = 0+ макс. валентность 4 |
Развёртка протонной оболочки ядра С |
Электронная оболочка и эл. формула атома C углерода [He]2s22p2 макс. валентность 4 |
Схема электронной оболочки атома углерода валентность 4 |
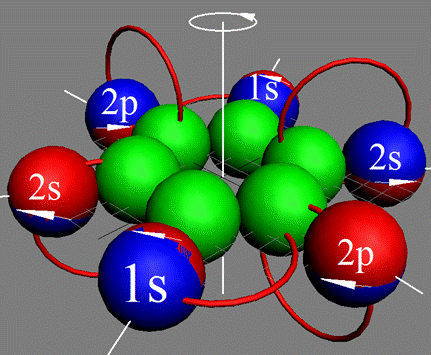
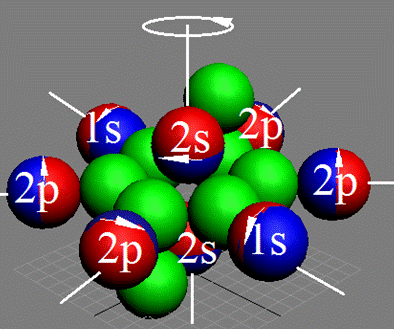
6. Углерод - С. Химический элемент с чётным зарядом состоит из двух стабильных изотопов 12С (98,93%) и 13С (1,07%). У изотопов углерода 12С (J =0+) образуется полностью замкнутое протонное кольцо, но оно ещё пластичное нестабильное. Нейтроны остова ядра связывают кольца позитронов у протонов. Причём два позитронных кольца из шести у углерода связывает сразу три нуклона. Четыре «валентных» позитронных кольца прошивают только по два нуклона. Это прочная и лёгкая нуклонная связка среди изотопов ядер химических элементов. Поэтому атом углерода выбран эталоном атомной массы. Такая позитронная прошивка защищает протоны от взаимного расталкивания, и позволяют протонам собираться в гексагональные «кристаллы-снежинки» графита. Первая такая «снежинка» появляется у ядра атома углерода, см. рисунок выше.
Кроме протонной сборки ядра атома углерода в виде гексагональной «снежинки» графита. Существует более редкая и энергетически затратная и вращательно не сбалансированная «объёмно крестовая» алмазная сборка ядра.
Электронная формула углерода C [He]2s22p2. Шесть электронов атома углерода в инертном не возбуждённом состоянии могут симметрично и равномерно разместить свои заряды двумя способами.
Первый «плоский» способ – когда все шесть электронов равномерно, на одинаковом расстоянии от ядра распределяются по окружности, в одной плоскости, используется при построении оболочки химически инертного графита.
Второй «сферический» способ - равномерного и симметричного размещения электронов на сфере, вокруг ядра углерода. Такой способ возможен, когда два электрона выталкиваются электростатическими силами с окружной орбиты и занимают торцевые полярные положения.
Ранее считалось, что углерод в природе может находиться в нескольких аллотропических модификациях алмаз, графит, чёрноый углерод (сажа и др.).
Как выяснилось, графит и все разновидности так называемого чёрного углерода (сажа и др.) не является аллотропической модификацией углерода, а представляет собой углеводород, содержание водорода в котором сравнительно не велико.
Графит и все разновидности так называемого чёрного углерода (сажа и др.) являются полициклическими углеводородами образующиеся в результате термической конденсации различных углеводородов.
Спины (оси вращения) всех электронов у графита лежат в экваториальной плоскости и перпендикулярны полярной оси вращения ядра атома. Углерод в форме графита, химически инертен и не растворяется ни в каких растворителях, кроме расплавленных металлов! Температура воспламенения в струе кислорода составляет для явнокристаллических графитов 700-730°С! Температура плавления графита — 3845-3890°С!
Графит с идеальной структурой диамагнетик. Магнитное поле выталкивает графит, и графит устанавливаются перпендикулярно магнитному полю. Магнитная восприимчивость велика в направлении, перпендикулярном базисным плоскостям ( -22*10-3), и незначительна в параллельном направлении ( -0,5*10-3).
Графит с дефектами структуры способен самонамагничиваться.
|
|
|
|
|
Электронная оболочка графита |
Электронная оболочка алмаза |
Электронная оболочка аморфного углерода, валентность 4 |
Известны смазочные свойства многослойного графита со слабым взаимодействием между слоями отдельных углеродных (графеновых) листов. Атомы углерода очень сильно связаны в слоях графита, образуя шестигранные кристаллы. И эти кристаллы графита очень слабо связаны валентными электронами между слоями. Поэтому при нагревании тепловое расширение графита до 427°С отрицательно (т.е. графит сжимается при нагревании!). При нагревании кристалла графита постепенно увеличивается количество возбуждённых электронов. Возбуждённые электроны покидают экваториальные орбиты и переходят на полярные валентные орбиты. Между слоями графита увеличивается число стягивающих валентных электронных пар, и слои графита взаимно притягиваются. Температура графита растет, а объём его уменьшается!
Электрическая
проводимость монокристаллов графита
в направлении, параллельном базисной плоскости (![]() =0,385*10-6 Ом*м), близка к
металлической, в перпендикулярном в сотни раз меньше, чем у металлов (52,0*10-6
Ом*м). Высокая анизотропия свойств монокристаллов графита
обусловлена строением его кристаллической решетки. В направлении базисных
плоскостей
=0,385*10-6 Ом*м), близка к
металлической, в перпендикулярном в сотни раз меньше, чем у металлов (52,0*10-6
Ом*м). Высокая анизотропия свойств монокристаллов графита
обусловлена строением его кристаллической решетки. В направлении базисных
плоскостей
Второй способ равномерного и симметричного размещения электронов в пространстве вокруг ядра углерода реализован у алмаза. В форме алмаза углерод имеет другое не кольцевое симметричное геометрическое строение ядра.
В монокристалле у каждой молекулы есть свое место, а весь монокристалл – повторение одной элементарной ячейки. Алмаз - самое твердое вещество, найденное в природе.
|
|
В возбужденном состоянии углерод становится химически активным веществом. Такой углерод мы называем аморфным углеродом. Уголь, кокс, сажа - химически более активны, чем графит или алмаз. Свежая сажа пирофорна и может самовоспламеняться на воздухе.
У аморфного углерода ядро как у графита, а электронная оболочка равномерно и симметрично размещает 4 валентных электрона в пространстве вокруг ядра. У аморфного углерода два 2s электрона выталкиваются электростатическими силами с окружной экваториальной орбиты и занимают торцевые полярные положения. Полярное торцевое положение 2s электронов делает их двух валентными. Два других его 2р валентных электрона примагничиваются к торцевым валентным 2s электронам делая атом углерода четырёх валентным. Два его торцевых валентных электрона легко примагничиваются к торцевым валентным электронам других атомов, ведь им не надо гасить инерцию вращения ядра атома. После того как два валентных 2s электрона атома углерода вступили в магнитную связь с двумя инородными атомами, к ним могут подтянуться ещё два 2р электрона. Таким образом, углерод становится четырёхвалентным. Это объясняет переменную валентность углерода 2 и 4.
Четыре валентных протона связанные элекиромагнитными силами с своими валентными электронами имеют возможность в ядре разворачиваться с экваториальной ориентации на полярную ориентацию.
7. Азот.
|
|
|
|
|
|
|
|||
|
Ядро изотопа азота 14N J = 1+ макс. валентность 5 |
Развёртка протонной оболочки ядра N |
Электронная оболочка и эл. формула атома азота [He]2s22p3 валентность 5 |
Схема электронной оболочки атома азота валентность 5 |
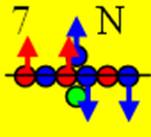
7. Азот – N. Химический элемент с нечётным зарядом состоит из двух стабильных изотопов 14N (99,634%) и 15N (0,366%). Строение ядра изотопа азота 14N имеет спин J = 1+. Это говорит о том, что один протон с спином J = 1/2+ и один нейтрон с спином J = 1/2+ ядра изотопа азота 14N находятся на оси вращения атома. Спин протона и спин нейтрона, как у дейтерия, дают суммарный спин J = 1+.
Два позитрона, лежащие в экваториальной плоскости, связывают по три нуклона сразу. При таком способе позитронной прошивки протоны не имеют возможности развернуться в валентное полярное положение. Поэтому два протона с их электронами у ядра атома азота всегда химически инертны.
Два центральных нуклона, протон и нейтрон, как у дейтерия, прошиты одним позитроном. Протон и его электрон в таком валентном полярном положении обеспечивает постоянную валентность атома азота 1, см. рисунок ниже.
Оставшиеся четыре протона могут разворачиваться из экваториального инертного положения в полярное валентное положение. Позитронная прошивка позволяет двум валентным протонам, имеющим вращение, противоположное вращению центрального протона, разворачиваться в свою сторону. Такая комбинация обеспечивает атому азота наиболее частую валентность 3, см. рисунок ниже.
Два других протона у атома азота имеют такое же вращение, как и центральный протон, поэтому они могут разворачиваться только в противоположную от протона сторону. Один первый протон разворачивается легко, и его электрон занимает центральное положение на противоположном торце атома азота, обеспечивает атому азота валентность 2 или 4.
Пятый протон и его электрон в валентное полярное положение разворачивается с большим трудом. Ему мешает однонаправленное вращение четвёртого протона и электрона. Для реализации редкой валентности 5 атому азота нужна дополнительная энергетическая накачка, см. рисунок.
Электронная формула азота N [He]2s22p3. Шесть электронов атома азота располагаются как у углерода в экваториальной плоскости. Седьмой электрон полярный и очень химически активный как у атома фтора. Поэтому азот не существует в свободном атомарном состоянии. Два атома азота всегда связаны в виде молекул N2. Эта молекула чрезвычайно химически инертна, на уровне инертных газов. Молекулу азота очень трудно разорвать, потому что к центральному полярному 2s электрону присоединяются два 2p экваториальных электрона, имеющих попутное вращение. То есть между атомами азота существует тройная электронная связь.
Третий 2p и один 2s экваториальный электрон имеет противоположное вращение и в молекулярной связи не участвует.
|
|
|
|
|
Электронная оболочка атома азота валентность 1 |
Электронная оболочка атома азота валентность 3 |
Электронная оболочка атома азота валентность 5 |
8. Кислород.
|
|
|
|
|
|
|
|||
|
Ядро изотопа кислорода 16О J = 0+макс. валентность 2 |
Развёртка протонной оболочки ядра О |
Электронная оболочка и электронная формула атома кислорода [He]2s22p4 валентность 2 |
Схема эл. об. атома кислорода валентность 2 |
8. Кислород – О. Химический элемент с чётным зарядом состоит из трёх стабильных изотопов 16О (99,959%) 17О (0,037%) 18О (0,204%). Ядро изотопа 16О кислорода имеет 8 протонов, это второе после гелия магическое число в ядерной физике. У кислорода впервые образует полностью замкнутое, полностью стабильное, химически инертное углеродное кольцо, см. рисунок выше.
В углеродном кольце шесть позитронов сшивают по три нуклона, по одному протону и по два нейтрона. Каждый нейтрон прошит позитроном дважды, это объясняет особую прочность связей нейтронов в ядре атома кислорода. Шесть позитронных колец лежат в экваториальной плоскости, и у 6 экваториальных протонов нет никакой возможности развернуться в валентное полярное положение. Валентными являются только два торцевых полярных протона, расположенных точно по центру симметрии ядра атома (спин J=0+), отсюда такая химическая активность кислорода. Два его торцевых валентных электрона легко примагничиваются к торцевым валентным электронам других атомов, ведь им не надо гасить инерцию вращения ядра атома.
Каждый валентный протон прошит общим позитроном с одним нейтроном. Пришитый нейтрон имеет возможность вращаться вокруг протона, подавляя отдельные вылазки кольцевых протонов.
Известно, например, что у всех лёгких элементов от лития до кислорода (атомный номер 8) имеется только два стабильных изотопа, из которых один (лёгкий изотоп 16О) соответствует равенству Ν=Ζ, а в другом (более тяжёлом изотопе 17О) число нейтронов на единицу больше числа протонов. У кислорода такие изотопы также имеются, но, кроме того, у кислорода имеется и третий изотоп 18О с массовым числом 18.
Начиная с кислорода, закономерность в числе изотопов другая - элементы с нечётным Ζ имеют только один стабильный изотоп (F, Na, ΑΙ, Ρ), а элементы с чётным Ζ обладают тремя изотопами (О, Ne, Mg, S).
Происшедшее при Z = 8 изменение в характере изотопного состава элементов является следствием того, что нуклоны заполнили первую из ядерных слоёв-оболочек (первое углеродное кольцо).
В литосфере содержится более 47% кислорода по весу, в гидросфере — 85,89% и в атмосфере — 23,01%. И это не случайно. Природа отдаёт предпочтение симметричным ядрам химических элементов с полностью заполненными ядерными слоями-оболочками.
Существует глубокий минимум распространённости в области лития, бериллия и бора и максимум распространенности углерода и кислорода!
Магические числа 2, 8, 14, 20, 28, 50, 82 и 126. Почему именно эти числа являются магическими в ядерной физике?
Магические числа в ядерной физике являются следствием геометрически правильного строения ядер атомов при заполнении очередного N-го углеродного слоя- оболочки.
Ни азот 14N с числом протонов 7, ни фтор 19F с числом протонов 9 не имеют такого красивого правильного абсолютно симметричного строения, как ядро атома кислорода с числом протонов 8.
Атом кислорода и молекула кислорода подобны стержневому магниту, поэтому струя жидкого кислорода реагирует на магнитное поле, отклоняется при поднесении к ней постоянного магнита. Этим кислород отличается, например, от немагнитных (диамагнитных) водорода, азота и воды, в молекулах которых все электроны спарены.
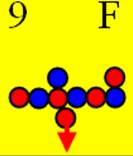
9 Фтор.
|
|
|
|
|
|
|
|||
|
Ядро изотопа фтора 19F J = 1/2+ макс. валентность 1 |
Развёртка протонной оболочки ядра F |
Электронная оболочка и эл. формула атома фтора [He]2s22p5 валентность 1 |
Схема эл-ой оболочки атома фтора валентность 1 |
9 Фтор – F. Химический элемент с нечётным зарядом имеет только один изотоп 19F (100%) начинается одновременное строительство с обоих торцов второго и третьего углеродного кольца.
Одинокий торцевой валентный протон ядра атома фтора обеспечивает повышенную химическую активность (J = ½+). Почему фтор химически активнее, чем кислород?
Это объясняется строением его ядра, см. рисунок выше. На рисунке видно, что одинокий протон ничем не связан, и позитрон имеет возможность свободно вращаться. Эта энергия свободного позитрона передаётся валентному электрону.
Почему два протона с противоположного торца ядра атома фтора не проявляют валентных свойств?
Потому что они пришиты позитронами к двум парам нейтронов. Плоскость вращения позитронов параллельна экваториальной плоскости вращения ядра атома фтора. У этих протонов нет возможности развернуться в валентное полярное положение, см. рис.
Протонное строение ядра атома фтора повторяется у галогенов и всех щелочных
металлов, вплоть до предпоследнего, ещё не синтезированного 119 химического элемента. Одинаковое торцевое протонное строение фтора и щелочных металлов обеспечивает лёгкость протекания химических реакций с их участием и прочность их химических соединений.
10 Неон.
|
|
|
|
|
|
Ядро изотопа неон 20N J = 0+ макс. валентность 0 |
Развёртка протонной оболочки ядра N |
Электронная оболочка и эл. формула атома неона Ne [He] 2s22p6 валентность 0 |
Схема элект. оболочки атома неона валентность 0 |
10 Неон – Ne. Химический элемент с чётным зарядом имеет три стабильных изотопа 20N - самый распространённый в природе (90,92%) суммарный спин ядра J = 0+, 21N (0,257%) суммарный спин ядра J = 3/2+, 22N (8,82%) суммарный спин ядра J = 0+. Ядро атома неона можно рассматривать как ассоциацию пяти альфа частиц. У неона второе углеродное кольцо не достроено, оно состоит из двух атомов гелия, отсюда такая химическая инертность.
Все позитронные кольца, прошивающие по три нуклона сразу, лежат в экваториальной не валентной плоскости. Протоны не имеют возможности развернуться в валентное полярное положение.
|
2p |
2s |
очерёдность заполнения протонной оболочки ядра неона |
|
2р |
1s |
|
|
2p |
|
|
|
2p |
2s |
|
|
2p |
1s |
|
|
2p |
|
После неона следующие протоны симметрично поочерёдно собираются на торцах ядра атома неона. Когда с каждой стороны первого углеродного кольца набралось по 6 протонов и 6 нейтронов, образуется тройное углеродное кольцо ядра атома аргона, см. рис. Рассмотрим ход этого строительство подробнее.
Электронная формула атома неона Ne [He] 2s22p6. Очерёдность заполнения электронной оболочки атома неона повторяет очерёдность заполнения протонной оболочки ядра неона.
Атомный радиус химических элементов во втором периоде от лития до фтора постепенно уменьшаются. У неона атомный радиус резко, почти в два раза по сравнению с фтором, возрастает! Это объясняется тем, что внутренние электронные облака первой оболочки К выталкивают вторую электронную оболочку L на более высокую орбиту.
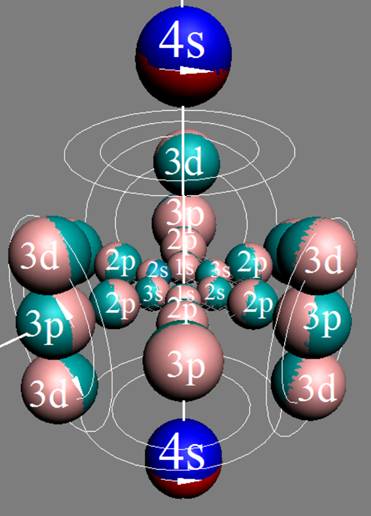
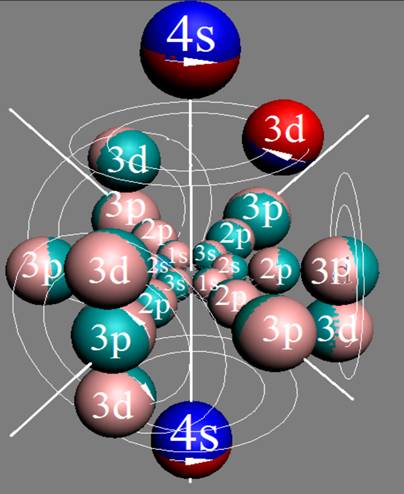
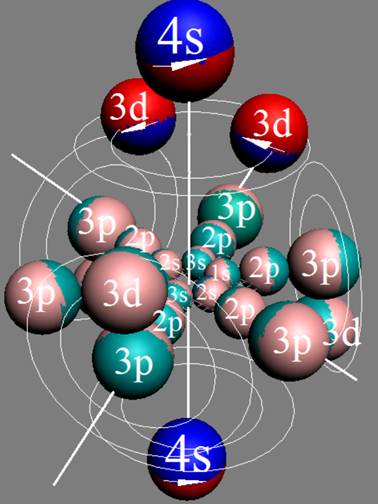
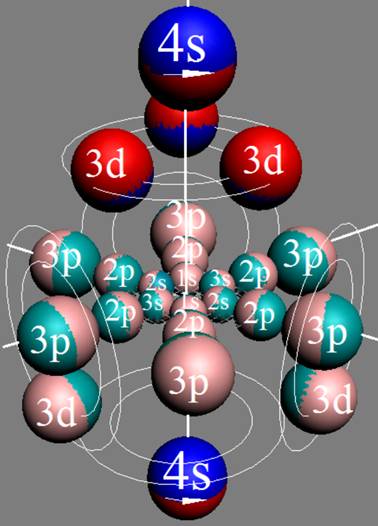
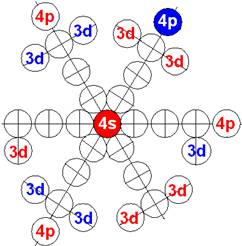
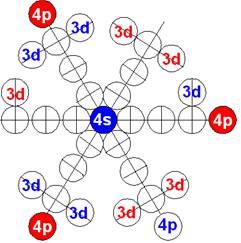
Первая К оболочка состоит из двух энергетических слоёв заполненных двумя 1s электронами и двумя 2s электронами. Вторая электронная L оболочка симметрично заполнена шестью 2р электронами см. рис выше.
11 Натрий.
|
|
|
|
|
|
|
|||
|
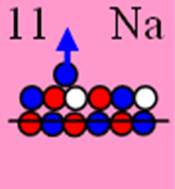
Ядро изотопа натрий 23Nа J = 3/2+ макс. валентность 1 |
Развёртка протонной оболочки ядра Nа |
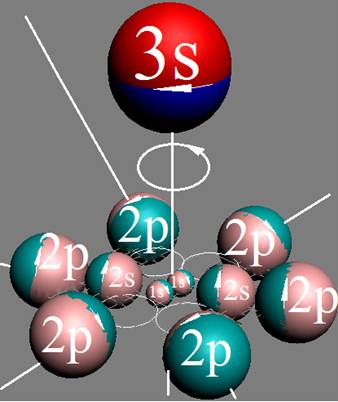
Электронная оболочка и эл. формула атома натрия Nа [Ne]3s1 макс. валентность 1 |
Схема элек-й оболочки атома натрия валентность 1 |
11 Натрий – Nа. Химический элемент с нечётным зарядом единственный стабильный изотоп 23Nа, имеет не симметричное строение (J = 3/2+).
Строение его ядра и позитронная прошивка аналогична неону. Одиннадцатый протон занимает положение, позволяющее ему сшивать своим позитроном ещё два нейтрона. Но для центральной позиции ему не хватает оппозитного протона или нейтрона. А из бокового положения его выталкивает электрон, который с ним жёстко связан.
Электронная формула атома натрия [Ne]3s1 максимальная валентность 1
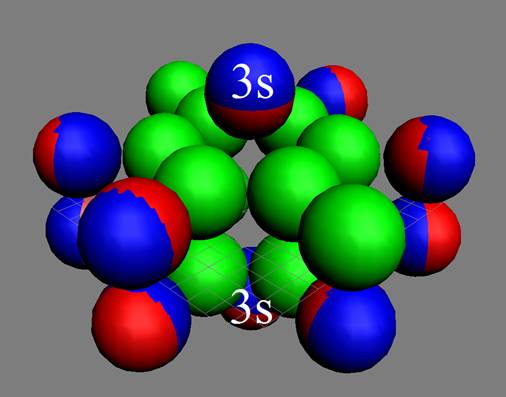
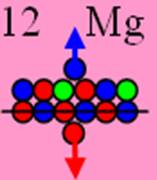
12 Магний.
|
|
|
|
|
|
|
|||
|
Ядро изотопа магния 26Mg J = 0 макс. валентность 2 |
Развёртка протонной оболочки ядра Mg |
Электронная оболочка и эл. формула атома магния Mg [Ne]3s2 макс. валентность 2 |
Схема эл-ой оболочки атома магния валентность 2 |
12 Магний - Mg, Химический элемент с чётным зарядом имеет три стабильных изотопа 26Mg (78,7%), 25Mg(11,17%), 24Mg (10,13%). Ядро магния получив двенадцатый протон, выстраивает два валентных торцевых протона по оси симметрии. Два его изотопа 24Mg (10,13%) и 26Mg (78,7%) симметричны и немагнитны J = 0+, а изотоп 25Mg(11,17%) обладает магнитными свойствами, он не симметричен J = 5/2-.
Электронная формула атома магния [Ne]3s2 максимальная валентность 2. Строение электронной оболочки атома магния подобна строению оболочки атома кислорода.
13 Алюминий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа алюминий 27Al J = 5/2+ макс. валентность 3 |
Развёртка протонной оболочки ядра Al |
Электронная оболочка и эл. формула атома алюминия AL [Ne]3s23p1 валентность 3 |
Схема элект-ой оболочки атома алюминия валентность 3 |
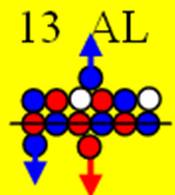
13 Алюминий – AL. Химический элемент с нечётным зарядом имеет единственный стабильный изотоп 27AL (100%). Один торец ядра атома алюминия повторяет торец ядра неона, плюс один центральный валентный протон на оси симметрии J = 0. Второй торец ядра атома алюминия пытается повторить торец ядра неона. Он имеет два валентных протона с одним протоном на оси симметрии, а второй протон не сбалансирован он придаёт ядру суммарный спин J = 5/2. Это делает систему самоорганизующихся нуклонов устойчивой.
Электронная формула атома алюминия AL [Ne]3s23p1. Строение электронной оболочки атома алюминия похожа на строение оболочки атома бора. Во всех своих устойчивых соединениях алюминий трёхвалентен, как бор. Это говорит о том, что три торцевых валентных электрона, жёстко связанных с его торцевыми протонами, имеют одинаковую энергию и находятся на практически одинаковом расстоянии от ядра. При этом 3р+ электрон имеет круговую орбиту около полярного 3s- электрона. При высоких температурах алюминий может проявлять валентность 1, это его единственный 3р+ электрон, при нагреве удаляется от ядра дальше остальных двух 3s электронов.
14 Кремний.
|
|
|
|
|
|
|
|||
|
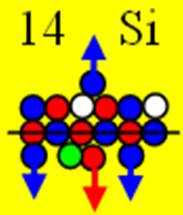
Ядро изотопа кремний 28Si J = 0+ макс. валентность 4 |
Развёртка протонной оболочки ядра Si |
Электронная оболочка и эл. формула атома кремния Si [Ne]3s23p2 валентность 4 |
Схема элект-ой оболочки атома кремния валентность 4 |
14 Кремний – Si. Химический элемент с чётным зарядом имеет три стабильных изотопа 28Si (92,21%), 29Si (4,7%), 30Si (3,09%). Изотоп кремния 28Si самый распространённый в четырёхвалентном состоянии имеет такой вид, см. рисунок выше. В двухвалентном состоянии кремний бывает реже, но может принимать и инертную форму, 14 протонов позволяют ему это делать. В инертной форме все 14 осей вращения протонов параллельны плоскости вращения ядра атома кремния.
Поэтому изотоп кремния относят к магическим ядрам. Кремний - второй после кислорода по распространенности в земной коре элемент (27,6% по массе). И это не случайно. Природа отдаёт своё предпочтение симметричным ядрам химических элементов с полностью заполненной протонной оболочкой. При низких температурах кристаллический кремний химически инертен, при нагревании его реакционная способность резко возрастает. Судя по более предпочтительной валентности 4, все его торцевые валентные электроны находятся на примерно одинаковом расстоянии от ядра.
15 Фосфор.
|
|
|
|
|
|
|
|||
|
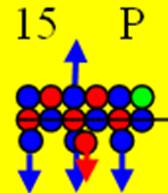
Ядро изотопа фосфор 31P J = 1/2+ макс. валентность 5 |
Развёртка протонной оболочки ядра P |
Электронная оболочка и эл. формула атома фосфора Р [Ne]3s23p3 валентность 5 |
Схема электро-ой оболочки атома фосфора валентность 5 |
15 Фосфор – Р. Химический элемент с нечётным зарядом имеет только один стабильный изотоп 31Р и может принимать валентные формы 3, 1, 5. Валентные протоны сосредоточены по торцам ядра атома неона. Четыре с одного торца (3s и три 3p протона) и один 3s протон с другого торца ядра атома. Суммарный спин 1/2+ обеспечен смещением одного 3s протона с центрально осевого положения.
Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических модификаций. Обычно выделяют четыре модификации простого вещества — белый, красный, черный и металлический фосфор. В обычных условиях существует только три аллотропических модификации фосфора, а в условиях сверхвысоких давлений — также металлическая форма. Все модификации различаются по цвету, плотности и другим физическим характеристикам. Заметна тенденция к резкому убыванию химической активности при переходе от белого к металлическому фосфору и нарастанию металлических свойств.
Наиболее характерная валентность 5 говорит о том, что все его валентные торцевые электроны находятся на одинаковом расстоянии от ядра.
16 Сера.
|
|
|
|
|
|
|
|||
|
Ядро изотопа серы 32S J = 0+ макс. валентность 6 |
Развёртка протонной оболочки ядра S |
Электронная оболочка и эл. формула атома S [Ne]3s23p4 валентность 6 |
Схема электронной оболочки атома серы валентность 6 |
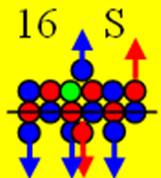
16 Сера – S. Химический элемент с чётным зарядом имеет четыре стабильных изотопа 32S (95%), 33S (0,76%), 34S (4,22%), 36S (0,014%). Самый распространённый изотоп серы 32S, см. рисунок выше, может принимать валентные формы 2, 4, 6.
Три валентных 3р- протона симметрично расположены вокруг 3s+ протона, с одного торца ядра атома как у фосфора. Четвёртый 3р+ протон и 3s- протон расположены с другого торца ядра.
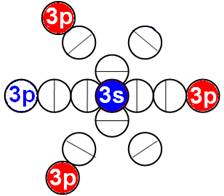
17 Хлор.
|
|
|
|
|
|
|
|||
|
Ядро изотопа хлора 35Cl J = 3/2+ макс. валентность 7 |
Развёртка протонной оболочки ядра Cl |
Электронная оболочка и эл. формула атома Cl [Ne]3s23p5 валентность 7 |
Схема электронной оболочки атома хлора валентность 7 |
17 Хлор – Cl. Химический элемент с нечётным зарядом имеет два стабильных изотопа изотоп 35Cl (75,53%) и 37Cl (24,47%) Хлор может принимать семь валентных форм. Наиболее частая валентность 1, 3, 5, 7 редко 2 и 4.
Валентные протоны распределились по торцам ядра атома хлора следующим образом. Три валентных 3р- протона симметрично расположены вокруг 3s+ протона, с одного торца ядра атома как у фосфора и серы. Четвёртый и пятый 3р+ протон и 3s- протон расположены с другого торца ядра.
18 Аргон.
|
|
|
|
|
|
|
|||
|
Ядро изотопа аргона 40Аr J = 0+ валентность 0 |
Развёртка протонной оболочки ядра Аr |
Электронная оболочка и эл. формула атома Аr [Ne]3s23p6 валентность 0 |
Схема эл. оболочки атома аргона валентность 8 |
18 Аргон - Аr. Химический элемент с чётным зарядом имеет три стабильных изотопа 40Аr (99,6%), 36Аr (0,337%), 40Аr (0,063%). Изотоп аргона 40Аr - самый распространённый в природе, его 18 протонов хватает для полноценного заполнения трёх углеродных слоёв-оболочек. Ядро атома аргона состоит из трёх углеродных колец, в которых нуклоны уложены в плотную упаковку столбиком, см. рисунок выше. На обоих торцах находятся по два стабилизационных запирающих нейтрона, не позволяющих протонам разворачиваться в валентное полярное положение. Этим объясняется химическая инертность аргона. Ни один протон не может развернуться из экваториальной ориентации и стать валентным, совместив свою ось вращения с осью вращения ядра атома.
Для криптона известны только соединения в матрице твердых инертных газов (например, HArF), которые разлагаются при криогенных температурах.
Позитронная прошивка углеродного кольца вызывает смещение сфер непроницаемости протона. Протон и его нейтрон вращаются немного не соосно. Плоскости их вращения находятся под углом 300. Инертное ядро атома аргона набирается из трёх слоёв углеродных колец. Каждый слой развёрнут на 1800 друг относительно друга. Это позволяет нуклонам вращаться сонаправленно.
|
|
|
|
|
А протонная оболочка смещается в шахматном порядке. У ядра атома образуется три северных и три южных магнитных полюсных дорожек. |
Каждая сдвоенная магнитная полюсная дорожка «смотрит» на свой электронный цуг. Каждый протон «пристально смотрит» на свой электрон. |
Очерёдность заполнения протонной оболочки ядра атома аргона. |
Нейтронная сердцевина ядра укладывается правильными стопками. А протонная оболочка строится в шахматном порядке. У ядра атома образуется шесть сдвоенных магнитных полюсных дорожек. Три магнитных полюса северных и три магнитных полюса южных. Каждая сдвоенная магнитная полюсная дорожка «смотрит» на свой электронный цуг. Каждый протон «пристально смотрит» на свой электрон.
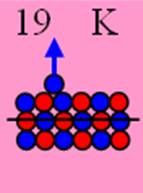
19 Калий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа калия 39К J =3/2+ валентность 1 |
Развёртка протонной оболочки ядра К |
Электронная оболочка и эл. формула атома калия К [Ar]4s1 макс. валентность 1 |
Схема эл. оболочки атома калия валентность 1 |
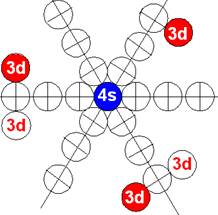
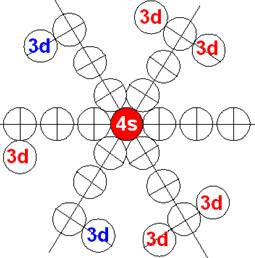
19 Калий К. Изотоп калия 39К имеет спин J = 3/2+, это говорит о том, что один из нуклонов ядра не сбалансирован и ядро калия не симметрично. Валентный 4s- протон занимает не осевое положение, что характерно для всех щелочных элементов см. рисунок выше.
У калия один полярный валентный 4s электрон спин J=+1/2. К валентному 4s- протону жёстко прикреплён магнитными связями 4s+ валентный электрон. Этот валентный 4s+ электрон обшаривает всё полушарие над осью вращения ядра атома. Этот электрон, как голодный волк, набрасывается на всё, что есть в его полушарии. Этим объясняется повышенная химическая активность калия. Калий обладает большой сжимаемостью при приложении внешнего давлении, т.к. его одинокий валентный торцевой электрон далеко отбрасывается электромагнитными силами.
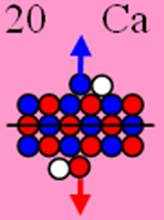
20 Кальций.
|
|
|
|
|
|
|
|||
|
Ядро изотопа кальций 40С J=0+ макс. валентность 2 |
Развёртка протонной оболочки ядра С |
Электронная оболочка и эл. формула атома кальция С [Ar]4s2 макс. валентность 2 |
Схема элект-ой оболочки атома кальция валентность 2 |
20 Кальций – Са. Химический элемент с чётным зарядом имеет шесть стабильных изотопов 40С ( 96,97%), 44С (2,06%), 42С (0,64%), 48С (0,185%), 43С (0,145%), 46С (0,0033%). Изотоп 40С имеет абсолютно симметричное ядро атома (J = 0+). У него дважды магическое число 20 протонов и 20 нейтронов.
У кальция два оппозитных полярных валентных электрона один полярный валентный 4s электрон спин J=+1/2, второй 4s электрон имеет спин J=-1/2. Имея два валентных 4s протона, но его химическая активность ниже, чем у калия, в чём причина?
Причина в центрально осевом положении двух валентных 4s протонов. Их оси вращения жёстко связаны с осью вращения ядра атома. Валентные электроны сильнее связаны с протонами и вращаются они гораздо быстрее. Поэтому радиус валентных электронов меньше чем радиус электрона калия. Площадь сегмента полусферы, доступная для контактов у электронов кальция, гораздо меньше, чем у электрона калия. Этим объясняется меньшая химическая активность кальция по сравнению с калием.
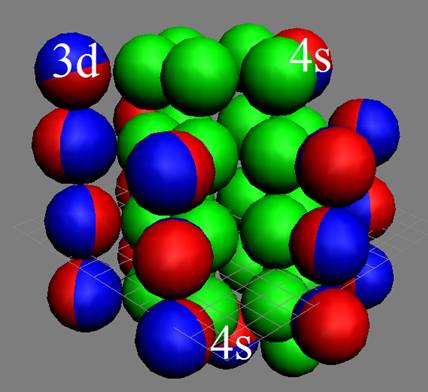
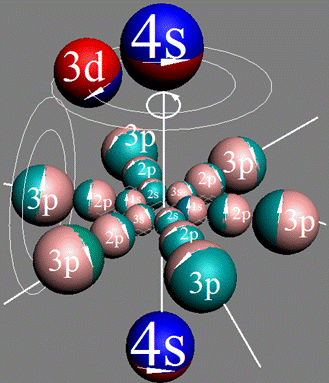
21 Скандий.
|
|
|
|
|
|
|
|||
|
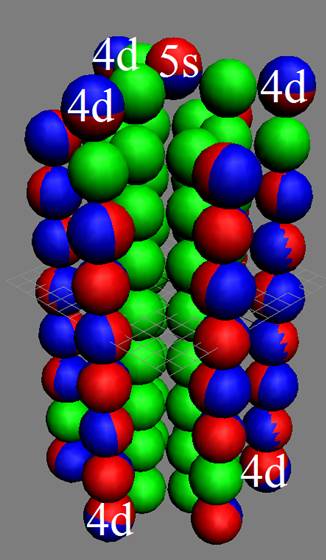
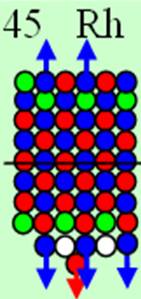
Ядро изотопа скандий 45Sc J=7/2- макс. валентность 3 |
Развёртка протонной оболочки ядра Sc |
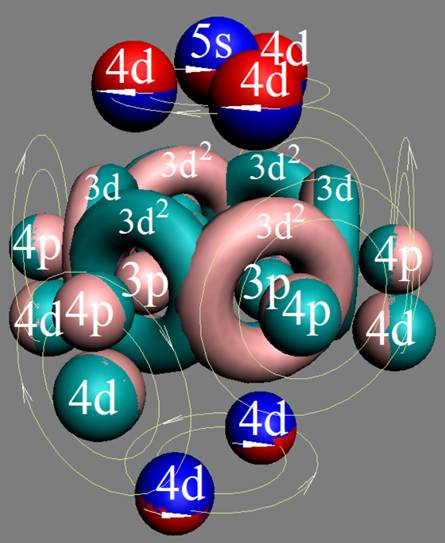
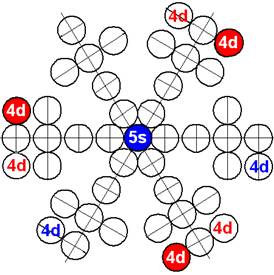
Электронная оболочка и эл. формула атома скандия Sc [Ar]4s23d1 валентность 3 |
Схема электронной оболочки атома скандия валентность 3 |
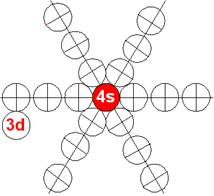
21 Скандий – Sc. Химический элемент с нечётным зарядом на 100% состоит из изотопа 45Sc. Такая не симметричная комбинация зарядов из 21-го протона может устойчиво существовать только при таком наборе нейтронов см рис. Дополнительные пять нейтронов и 4s протон образуют новый четвёртый нейтронный слой и дают возможность устойчиво существовать нечётному 21-му протону (J = 5/2-). С скандия начинается строительство четвёртого углеродного кольца см. рисунок выше. Суммарный спин ядра J=5/2-3/2-1/2+=7/2-
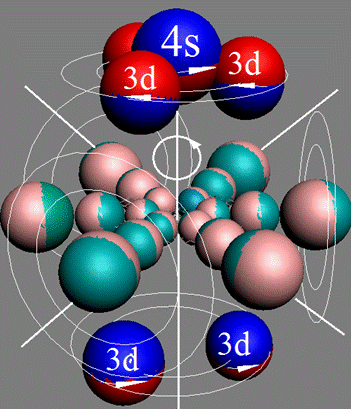
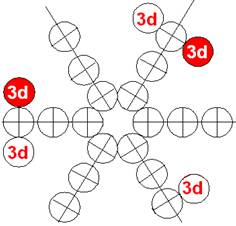
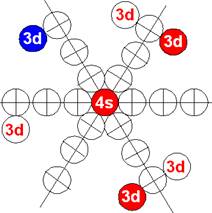
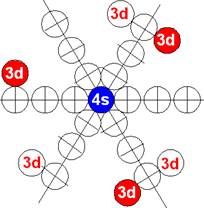
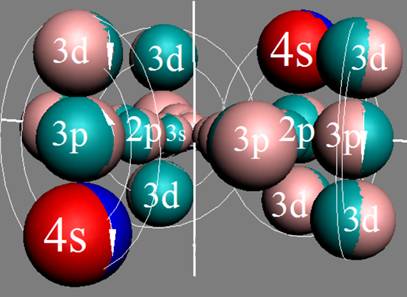
У скандия впервые из химических элементов появляется валентный 3d+ электрон спин J=+3/2. Этот 3d+ электрон имеет не только круговое вращение вокруг собственной оси, но и орбитальное вращение вокруг второго 4s- электрона имеющего спин J=-1/2. Кроме того этот 3d+ электрон в не возбуждённом состоянии может вращаться вокруг экваториального не валентного 3р электрона имеющего спин J=-1/2.
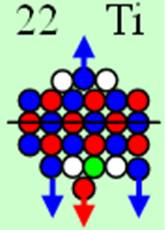
22 Титан.
|
|
|
|
|
|
|
|||
|
Ядро изотопа титан 48Ti J=0+ макс. валентность 2 |
Развёртка протонной оболочки ядра Ti |
Электронная оболочка и эл. формула атома титана Ti [Ar]4s23d2 макс. валентность 4 |
Схема эл. оболочки атома титан валентность 4 |
22 Титан - Ti. Химический элемент с чётным зарядом имеет пять стабильных изотопов 48Ti (73,99%), 46Ti (7,99%), 47Ti(7,32%), 49Ti(5,46%), 50Ti(5,25%). У самого распространённого изотопа титана 48Ti четвёртый протонно-нейтронный слой сбалансирован ( J = 0+), см. рисунок ниже. Четыре торцевых протона обеспечивают валентность 2, 3, 4. Валентность 2 обеспечивают два торцевых 4s протона.
У титана появляется второй валентный 3d+ электрон спин J=+3/2. Этот второй 3d+ электрон, так же как и у скандия вращается вокруг второго 4s- электрона имеющего спин J=-1/2. Кроме того эти два 3d+ электрона в не возбуждённом состоянии могут вращаться вокруг второго экваториального не валентного 3р- электрона имеющего спин J=-1/2.
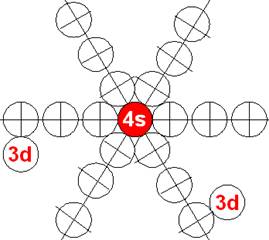
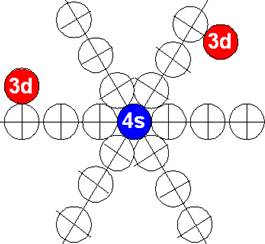
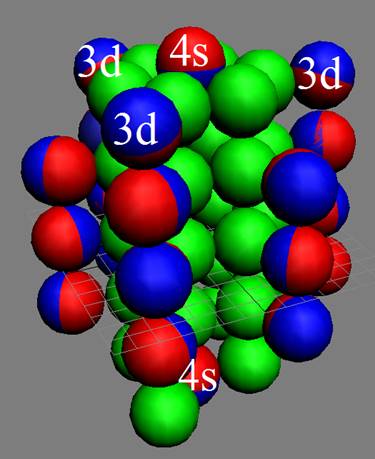
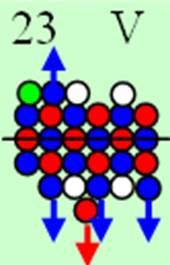
23 Ванадий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа ванадий 51V J =-5/2-3/2+1/2 = 7/2- макс. валентность2 |
Развёртка протонной оболочки ядра V |
Электронная оболочка и эл. формула атома ванадия [Ar]4s23d3 макс. валентность 5 |
Схема электронной оболочки атома ванадия валентность 5 |
23 Ванадий – V. Химический элемент с нечётным зарядом имеет два стабильных изотопа 51V (99,75%) и 51V (0,25%). У ядра изотопа ванадия 51V заканчивается заполнение одного торца валентными 3d+ протонами. Этот торец ядра изотопа ванадия 51V симметричен. Второй торец ядра атома изотопа 51V ванадия не симметричен, поэтому суммарный ядерный спин J =-5/2-3/2+1/2 = 7/2-
Электроны жёстко привязаны к своим протонам электромагнитными связями. Строительство ядра атома происходит параллельно со строительством его электронной оболочки. Электронная оболочка это зеркальное отражение строения ядра атома.
Пять торцевых протонов изотопа ванадия 51V обеспечивают ему валентность 2, 3, 4, 5. Три экваториальных 3р+ протона имеют одинаковый спин 1/2+. Они лежат на «боку» под углом 120 градусов в четвёртом протонном слое и обеспечивают валентность 3, 4, 5. Изначально они не валентны, их экваториальные электроны перпендикулярны оси вращения ядра ванадия. Первыми в магнитную связь вступают два полярно-торцевые электрона у осевых 4s протонов, обеспечивая валентность 2. Эти осевые электроны вращаются синхронно с ядром ванадия. Им не надо гасить инерцию вращения тяжёлого ядра атома.
У ванадия появляется третий полярный валентный 3d+ электрон спин J=+3/2. Этот третий 3d+ электрон, в валентном состоянии, также вращается вокруг второго 4s- электрона имеющего спин J=-1/2. Кроме того третий 3d+ электрон в не возбуждённом состоянии может вращаться вокруг третьего экваториального не валентного 3р- электрона имеющего спин J=-1/2. Эти три 3d+ электрона обеспечивают переменную валентность ванадия. Электронная оболочка ванадия зарядово симметрична.
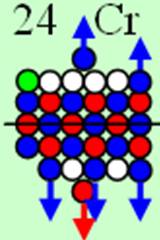
24 Хром
|
|
|
|
|
|
|
|||
|
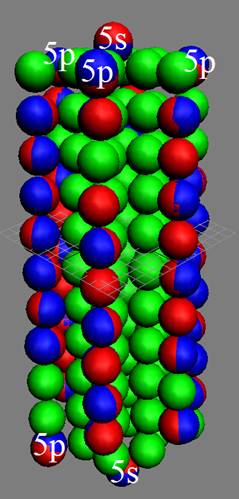
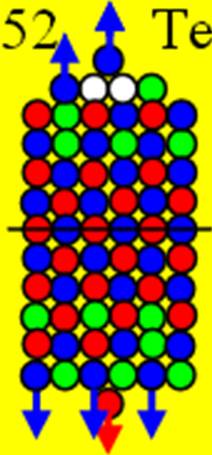
Ядро изотопа хром 52Cr J=0+ макс. валентность 3 |
Схема протонной оболочки ядра Cr |
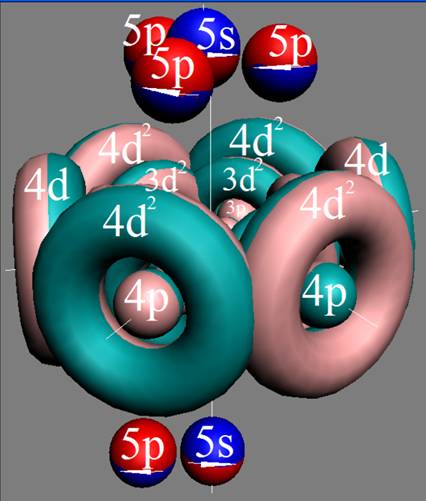
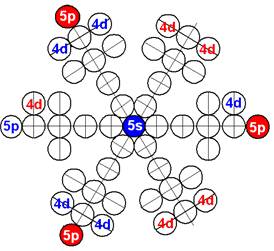
Электронная оболочка и эл. формула атома хрома Cr [Ar]4s13d5 макс. валентность 6 |
Схема электронной оболочки атома хрома валентность 6 |
24 Хром – Cr. Химический элемент с чётным зарядом имеет четыре стабильных изотопа 52Cr (83,76%), 53Cr (9,55%), 50Cr (4,31%), 54Cr (2,98%),. У хрома начинается строительство пятого протонно-нейтронного углеродного кольца.
Хром первый химический элемент, у которого обнаружено нарушение в заполнении электронной оболочки. По теории, электронная оболочка должна выглядеть так: (Аr)4s23d4. Но спектральный анализ показывает такое строение: (Аr)4s13d5. Вместо одного отсутствующего 4s электрона появляется пятый 3d электрон. Почему?
Прежде всего, надо обратить внимание на то, что энергетически 4s электроны и 3d электроны практически идентичны. Что до построения четвёртой 4р оболочки ранее у химических элементов не встречалось. Эта энергетическая равноценность электронных вихрей вызывает сбои в дальнейшем построении электронных энергетических слоёв.
|
|
|
|
|
Электронная оболочка хрома валентность 2 |
Электронная оболочка хрома валентность 3 |
Электронная оболочка хрома валентность 6 |
Взглянем на рисунок ядра атома хрома, и всё становится ясно! Виновата зарядовая симметрия (J=0+), у ядра атома хрома появился пятый нейтронный слой, на котором можно удобно разместиться протонам. Ни у ванадия, ни у титана нет такой возможности,
поэтому их ядра зарядово не симметричны. А начиная с ядра атома хрома, начинает восстанавливаться зарядовая симметрия! Для сохранения зарядовой симметрии, у ядра атома хрома, начинается заполнение другого торца ядра валентными 3d+ протонами, имеющими спин J=+3/2.
Поэтому четвёртый валентный 3d+ электрон спин J=+3/2 у атома хрома так же появляется на другой стороне электронной оболочки у первого 4s+ электрона имеющего спин J=+1/2. Но оба 4s+ и 3d+ электрона имеют осевое однонаправленное вращение, на что указывает положительный + спин.
В возбуждённом состоянии на одном торце электронной оболочки атома хрома сталкиваются два электрона с одинаковой полярностью 4s+ электрон 3d+ электрон. Встречное вращение двух электронов взаимно тормозит их, уравнивая их скорости вращения. И 3d+ электрон выталкивает 4s+ электрон с центральной оси вращения электронной оболочки, и он занимает положение пятого валентного 3d+ электрона.
Поэтому две энергетически одинаковые электронные сферы непроницаемости на одном торце атома хрома занимают две 3d+ зарядово-симметричные позиции. Поэтому с центральной осевой позиции 4s+ протон переходит в более удобную не конфликтную 3d+ позицию.
Шесть торцевых валентных протонов обеспечивают валентность 2, 3, 6 см рис.
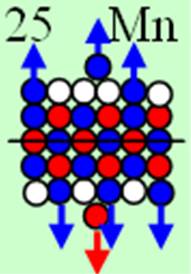
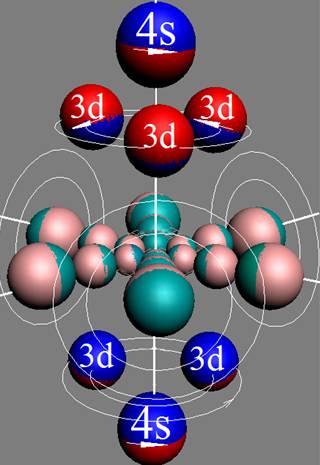
25 Марганец.
|
|
|
|
|
|
|
|||
|
Ядро изотопа марганец 55Mn J=5/2- макс. валентность 2 |
Развёртка протонной оболочки ядра Mn |
Электронная оболочка и эл. формула атома марганца [Ar]4s23d5 макс. валентность |
Схема электр-ой оболочки атома марганца валентность 7 |
25 Марганец – Mn. Химический элемент с нечётным зарядом имеет только один стабильный изотоп 55Mn. Ядро изотопа имеет не симметричное строение спин J=5/2-. Основные валентные состояния 2, (3), 4, (5), (6), 7. Семь валентных протонов размещаются на торцах ядра атома в соотношении как 3 к 4.
Из рисунков электронных оболочек видно, что у марганца валентные состояния 3, 5, 6 с не симметричной конфигурацией электронов более редкие, чем валентные состояния 2, 4, 7 с симметричной конфигурацией электронов.
Причём теоретическая электронная формула атома марганца [Ar]4s23d5 совпадает с данными спектрального анализа.
В отличие от атома хрома у марганца присутствуют оба 4s электрона.
Почему?
Потому что два 3d+ электрона симметрично толкают и тормозят 4s+ электрон. Разнонаправленное воздействие 3d+ электронов на этот 4s+электрон взаимно гасят друг друга. Этот 4s+ электрон вынужден занимать центрально-осевую позицию.
|
|
|
|
|
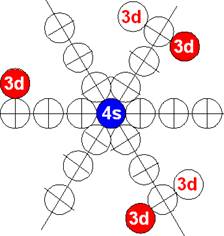
Электронная оболочка атома марганца валентность 2 |
Электронная оболочка атома марганца валентность 3 редко |
Электронная оболочка атома марганца валентность 4 |
|
|
|
|
|
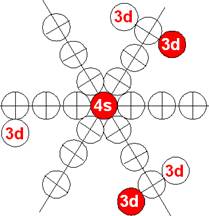
Электронная оболочка атома марганца валентность 5 редко |
Электронная оболочка атома марганца валентность 6 редко |
Электронная оболочка атома марганца валентность 7 |
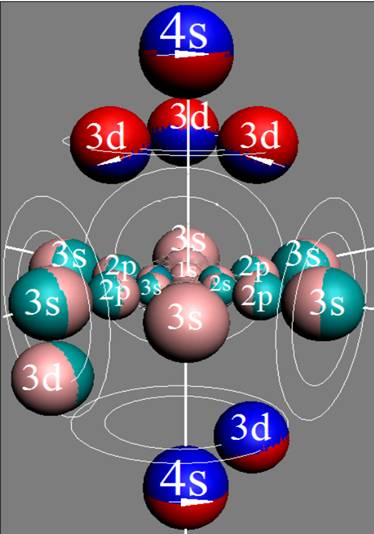
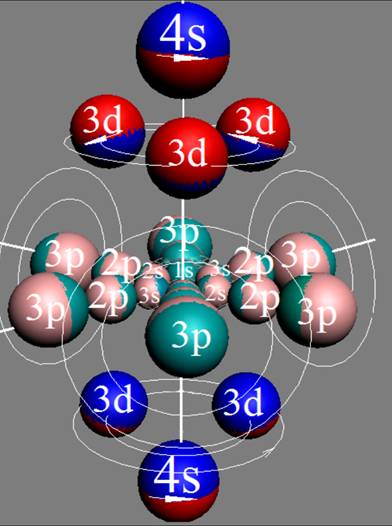
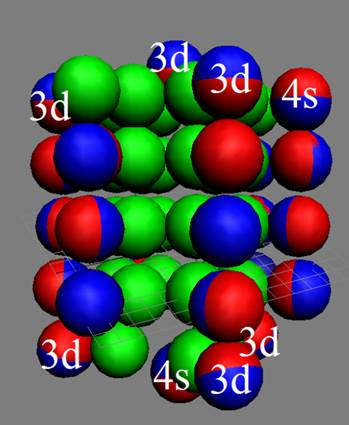
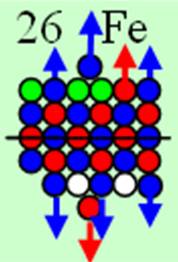
26 Железо.
|
|
|
|
|
|
|
|||
|
Ядро изотопа железо 56Fe J=0+ макс. валентность 8 |
Развёртка протонной оболочки ядра Fe |
Электронная оболочка и эл. формула атома железа [Ar]4s23d6макс. валентность 8 |
Схема электр-ой оболочки атома железо валентность 8 |
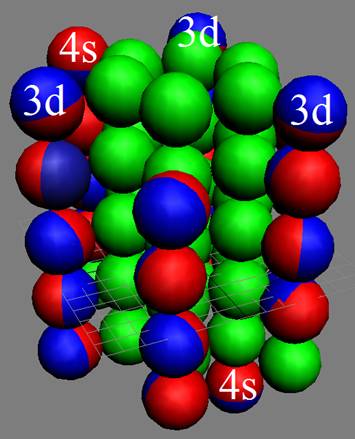
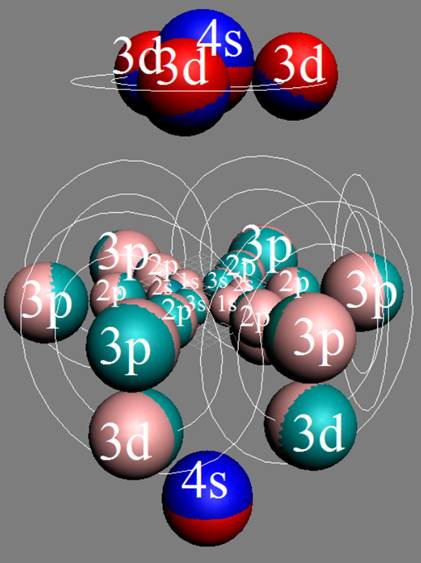
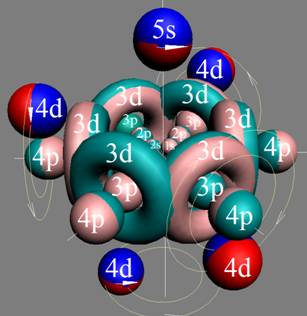
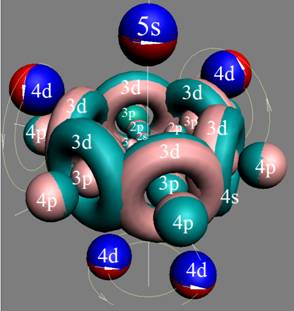
26 Железо – Fe. Химический элемент с чётным зарядом имеет четыре стабильных изотопа 56Fe(91,66%), 54Fe(5,82%), 57Fe(2,19%), 58Fe(0,33%). Восемь протонов симметрично по четверо, размещаются на четвёртом и пятом нейтронном кольце ядра атома железа, объясняют экзотическую предельную валентность железа 8. Четыре валентных протона на торце ядра атома - предельно возможное состояние для химических элементов. Причём центральный S протон, чтобы не тормозить три боковых протона, должен иметь обратное вращение (спин). Изображение ядра см. рис. объясняет его предельную валентность 8 и его химическую инертность к некоторым химическим веществам.
Железо — ферромагнетик, оно легко намагничивается, но теряет магнитные свойства при снятии магнитного поля. С повышением температуры магнитные свойства железа ухудшаются и выше 769°С оно практически не поддается намагничиванию (иногда железо в интервале 769—910°С называют &betta;-Fe); γ-Fe не является магнитным материалом.
|
|
|
|
|
Электронная оболочка атома железа валентность 0 |
Электронная оболочка атома железа валентность 2 |
Электронная оболочка атома железа валентность 3 |
|
|
|
|
|
Электронная оболочка атома железа валентность 4 |
Электронная оболочка атома железа валентность 6 |
Электронная оболочка атома железа валентность 8 |
При температуре 769°С происходит перестройка электронной оболочки атома железа, из обычного шестивалентного оно превращается в восьмивалентное. Одна из пар 3d нейтральных экваториальных электронов при нагревании распаривается и 3d электрон с отрицательным 1/2- спином занимает полярное центрально осевое положение. Вокруг него группируются два 3d электрона с спином 3/2+ и один бывший 4s+ электрон. Два торца электронной оболочки атома железа приобретают зеркальную симметрию. Отсюда возникают немагнитные свойства &betta;-Fe и γ-Fe железа.
27 Кобальт.
|
|
|
|
|
|
|
|||
|
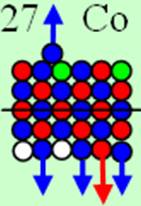
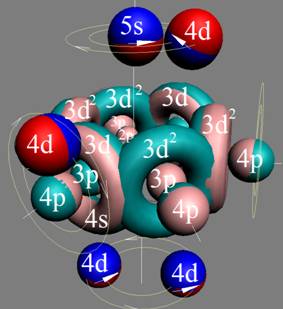
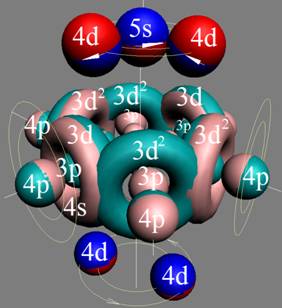
Ядро изотопа кобальт 59Co J=7/2- макс. валентность 5 |
Развёртка протонной оболочки ядра Co |
Электронная оболочка и эл. формула атома кобальта [Ar]4s23d7макс. валентность 5 |
Схема электронной оболочки атома кобальт валентность 5 |
27 Кобальт – Со. Химический элемент с нечётным зарядом имеет только один стабильный изотоп 59Со. Четвёртое углеродное кольцо продолжает достраиваться у ядра атома кобальта. Вторая пара протонов с противоположными спинами, надёжно залегает в боковом положении, уменьшая предельную валентность кобальта до 5. Ядро изотопа имеет не симметричное строение J=7/2-.
Начиная с кобальта происходит свёртывание валентных 3d+ электронов. Каждый новый 3d- электрон образует устойчивую экваториальную не валентную пару с 3d+ электроном. В электронной оболочке атома эти пары занимают оппозитное положение. При этом понижается валентность последующих химических элементов на единицу.
Fe - 6
Со - 5
Ni - 4
Cu - 3
Zn - 2
У кобальта четыре 3d электрона с противоположными спинами попарно и оппозитно залегают на экваториальных не валентных орбитах, понижая предельно возможную валентность до 5. В валентных связях у кобальта участвуют два 4s электрона и три не парных 3d+ электрона.
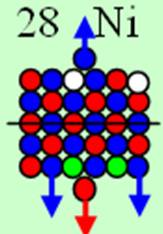
28 Никель.
|
|
|
|
|
|
|
|||
|
Ядро изотопа никель 58Ni J=0+ макс. валентность 4 |
Развёртка протонной оболочки ядра Ni |
Электронная оболочка и эл. формула [Ar]4s23d8 атома никеля валентность 4 |
Схема электронной оболочки атома никеля валентность 4 |
28 Никель – Ni. Химический элемент с чётным зарядом имеет пять стабильных изотопов, самый распространённый 58Ni (67,76%), 60Ni (26,16%), 61Ni (1,25%), 62Ni (3,66%), 64Ni (1,16%). Окончательно достраивается четвёртое углеродное кольцо у никеля., см. рисунок выше.
Шесть 3d электронов с противоположными спинами попарно и оппозитно залегают на экваториальных не валентных орбитах, понижая предельную валентность никеля до 4. В валентных связях у никеля участвуют два 4s электрона и два не парных 3d+ электрона.
29 Медь.
|
|
|
|
|
|
|
|||
|
Ядро изотопа медь 63Cu J = 3/2- макс. валентность 3 |
Развёртка протонной оболочки ядра Cu |
Электронная оболочка и эл. формула [Ar]4s13d10 атома меди валентность 3 |
Схема электронной оболочки атома меди валентность 3 |
29 Медь – Cu. Химический элемент с нечётным зарядом имеет два стабильных изотопа: 63Cu(69,1%) и 65Cu(30,9%). У ядра изотопа атома 63Cu нет одного торцевого 4s+ протона, его место занимает нейтрон. Такое пространственное распределение зарядов оптимально для 29 протонов и объясняет валентность меди 1, обеспечиваемую одним 4s- протоном. Валентности 2 и 3 обеспечивают два 3d торцевых протона ядра атома.
Один 4s+ протон спешит достроить пятый протонный слой, и он занимает свободное вакантное место 3d+ протона, как у ядра атома цинка. У меди достраивается пятое углеродное кольцо в ядре. Но на одном из торцов ядра пара 3d+ и 3d- протонов, ненадёжно залегает в экваториальном положении, Один из протонов 3d+ помнит своё 4s+ происхождение, обеспечивая меди дополнительную валентность 2 и 3.
У меди в порядке заполнения электронной оболочки обнаружен второй после хрома сбой. Вместо положенной формулы [Ar]4s23d9 данные спектроскопии дают такую электронную формулу [Ar]4s13d10.
У меди, на одном торце электронной оболочки, легко распаривается одна экваториальная инертная 3d пара электронов, содержащая один бывший 4s- электрон, делая медь двух и трёхвалентной.
Восемь 3d электронов с противоположными спинами попарно и оппозитно залегают на экваториальных не валентных орбитах, понижая предельную валентность меди до 3. В валентных связях у меди участвуют только один 4s электрон и два 3d оппозитных электрона с противоположными спинами.
|
|
|
|
|
Электронная оболочка атома меди валентность 1 |
Электронная оболочка атома меди валентность 2 |
Электронная оболочка атома меди валентность 3 |
30 Цинк.
|
|
|
|
|
|
|
|||
|
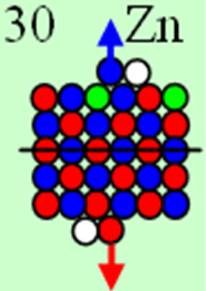
Ядро изотопа цинк 64Zn J = 0+ макс. валентность 2 |
Развёртка протонной оболочки ядра Zn |
Электронная оболочка и эл. формула [Ar]4s23d10 атома цинка валентность 2 |
Схема электронной оболочки. атома цинка валентность 2 |
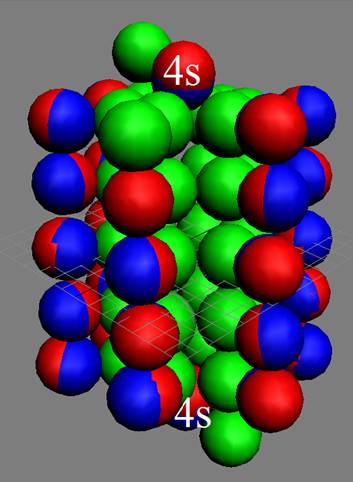
30 Цинк – Zn. Химический элемент с чётным зарядом имеет пять стабильных изотопов, самый распространённый 64Zn (48,89%), 66Zn (27,81%), 67Zn (4,11%), 68Zn (18,57%), 70Zn (0,62%). У ядра атома цинка полная зарядовая симметрия, см рисунок выше. Две пары протонов продолжают строить пятое углеродное кольцо. Валентность 2 обеспечивают два торцевых 4s протона. Бороться с разворотом в валентное положение торцевых протонов помогают два торцевых стабилизирующих запирающих нейтрона. Этим обеспечивается стабильная валентность цинка 2.
Все десять 3d электронов с противоположными спинами попарно и оппозитно залегают на экваториальных не валентных орбитах, понижая предельную валентность цинка до 2. В валентных связях у цинка участвуют только 4s электроны.
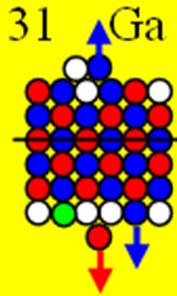
31 Галлий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа галлий 69Ga J = 3/2- макс. валентность 3 |
Развёртка протонной оболочки ядра Ga |
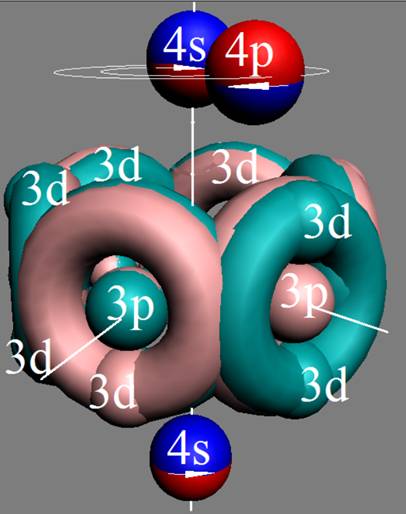
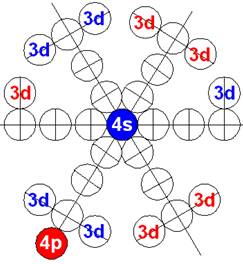
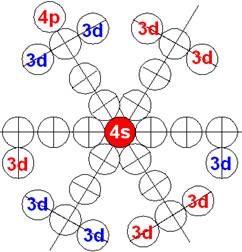
Электронная оболочка и эл. формула [Ar]4s23d104p1 атома галлия валентность 3 |
Схема электронной оболочки атома галлия валентность 3 |
31 Галлий – Ga. Химический элемент с нечётным зарядом имеет два стабильных изотопа 69Ga(60,4%) и 71Ga(39,6%). Ядро галлия с одного торца имеет один стабилизирующий торцевой нейтрон, расположенный около 4р- протона, обеспечивая суммарный ядерный спин J = 3/2- . Строительство пятого углеродного кольца приостанавливается, начинается строительство шестого углеродного кольца.
Запас 3d электронов закончился. На двух 3d электронных орбитах осталось два вакантных места для 4s электронов. Устойчивый фундамент из 3d электронных облаков для 4р электронов возведён. Теперь 4р электроны не могут скатываться на 3d орбиты, все места заняты.
С галлия начинает достраиваться 4р электронный слой-оболочка. Предельную валентность 3 обеспечивает два 4s и один 4р+ электрон.
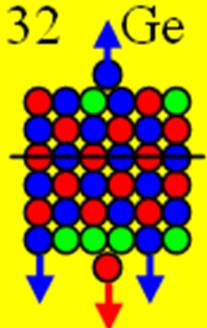
32 Германий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа германий 74Ge J= 0+ макс. валентность 4 |
Развёртка протонной оболочки ядра Ge |
Электронная оболочка и эл. формула [Ar]4s23d104p2 атома германия валентность 4 |
Схема электр-ой оболочки атома германия валентность 4 |
32 Германий – Ge. Химический элемент с чётным зарядом имеет пять стабильных изотопов, самый распространённый 74Ge (36,54%), 70Ge (20,52%), 72Ge (27,43%), 73Ge (7,76%), 76Ge (7,76%). Появляется второй 4р- протон с положительным спином с одного торца ядра атома. Заряд ядра германия 32 чётный, изоспин ядра J= 0+.
Предельную валентность 4 обеспечивают два 4s и два 4р+ электрона.
33 Мышьяк.
|
|
|
|
|
|
|
|||
|
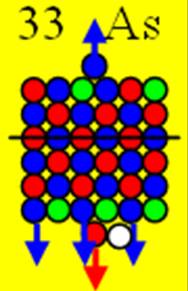
Ядро изотопа мышьяк 75As J = 3/2- макс. валентность 5 |
Развёртка протонной оболочки ядра As |
Электронная оболочка и эл. формула [Ar]4s23d104p3 атома мышьяка валентность 5 |
Схема электронной оболочки атома мышьяка валентность 5 |
33 Мышьяк – As. Химический элемент с нечётным зарядом имеет только один стабильный изотоп 75As. Появляется третий 4р+ протон с положительным спином с одного торца ядра атома.
Из таблицы периодической системы протонной структуры ядер 120 химических элементов можно заметить и сделать следующий вывод: Все три 4р+ протона с положительным спином появляются только со стороны 4s- протона с отрицательным спином. И наоборот все три 4р- протона с отрицательным спином появляются только со стороны 4s+ протона с положительным спином.
Физический смысл происходящего: спин-спиновые взаимодействия протонов в ядре атома. Происходит стихийное самосогласование вращений протонных вихрей. Центральный-полярный 4s протонный вихрь вращается «попутно» 4р протонным вихрям.
Предельную валентность 5 обеспечивают два 4s и три 4р+ электрона.
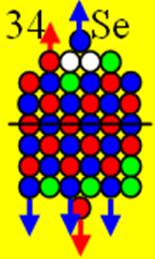
34 Селен.
|
|
|
|
|
|
|
|||
|
Ядро изотопа селен 80Se J =0+ макс. валентность 6 |
Развёртка протонной оболочки ядра Se |
Электронная оболочка и эл. формула [Ar]4s23d104p4 атома селена валентность 6 |
Схема электронной оболочки атома селена валентность 6 |
34 Селен – Se. Химический элемент с чётным зарядом имеет шесть стабильных изотопов, самый распространённый 80Se (49,82%), 74Se (0,87%), 76Se (9,02%), 77Se (7,58%), 78Se (23,52%), 82Se (9,19%). Один торец ядра полностью насыщен 4 шт. валентными протонами. Судя по валентности, на другом торце его ядра появляется первый 4р- протон с отрицательным спином. Начинается строительство седьмого углеродного кольца. Стихийная самоорганизация начинает восстанавливать зарядовое равновесие.
В химических соединениях селен обычно проявляет валентность 2, 4, 6. Предельную валентность 6 обеспечивают два 4s и три 4р+ электрона и один 4р- электрон.
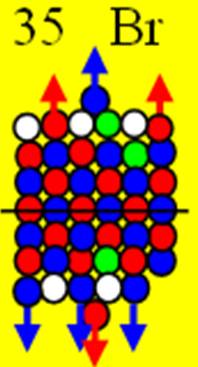
35 Бром.
|
|
|
|
|
|
|
|||
|
Ядро изотопа бом 79Br J = 3/2- валентность7 |
Развёртка протонной оболочки ядра Вr |
Электронная оболочка и эл. формула [Ar]4s23d104p5 атома брома валентность 7 |
Схема электр-ой оболочки атома брома валентность 7 |
35 Бром – Br. Химический элемент с нечётным зарядом имеет два стабильных изотопа 79Br (50,537%), 81Br (49,463%). Появляется второй 4р- протон в седьмом строящимся углеродном слое.
Предельную валентность 7 обеспечивают два 4s и три 4р+ электрона и два 4р- электрона.
.
36 Криптон.
|
|
|
|
|
|
|
|||
|
Ядро изотопак криптон 84Kr J = 0+ валентность 0 |
Развёртка протонной оболочки ядра Kr |
Электронная оболочка и эл. формула [Ar] 4s23d104p6 атома криптона валентность 0 |
Схема электронной оболочки атома криптона валентность 0 |
36 Криптон – Kr. Химический элемент с чётным зарядом имеет шесть стабильных изотопов, самый распространённый 84Kr (56,90%), 78Kr (0,354%), 80Kr (2,27%), 82Kr (11,56%), 83Kr (11,55%), 86Kr (17,37%).
У изотопа 84Kr на торцах ядра атома располагаются два протонных кольца, состоящих из 4р+/- протонов. Это самый устойчивый и самый распространённый в природе изотоп криптона (56,9%). У 86Kr магическое число нейтронов - 50, но он менее распространён в природе, всего 17,37% по сравнению с 84Kr и распространённостью в природе 56,90%. Так что его магический статут сомнителен.
Шестое и седьмое протонное кольцо одновременно достраивается у криптона. Третий 4р- протон заканчивает строительство седьмого протонного кольца. А два 4s протона прочно залегают в пятом углеродном 3d кольце, заполняя его протонами полностью.
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Сечение электронной оболочки атома криптона |
Порядок заполнения протонной болочки ядра атома криптона. |
Электронная оболочка атома криптона вал-сть 2 |
Формально инертный криптон может проявлять валентность 2. Это говорит о том, что два 4s протона в ядре имеют возможность разворачиваться из экваториального положения в полярное валентное положение. Значит, последние торцевые 4р протонные слои, у изотопов криптона, не достроены в них не хватает по одному нейтрону. Эти нейтроны занимают центрально осевые позиции.
Для криптона известны чуть более десятка соединений (в основном это комплексы дифторида криптона KrF2). Недавно список криптонсодержащих молекул пополнился двумя соединениями — HKrCN и HKrF.
При этом электронная оболочка криптона образует четыре замкнутых энергетических слоя по 6 электронов в слое, а в третьем электронном слое сразу 18 электронов. Все 36 электрона четырёх электронных слоев вступают в магнитную связь между собой, образуя 6 цугов по 4 электрона в каждом цуге, и закладывается фундамент для 12 боковых 3d цугов.
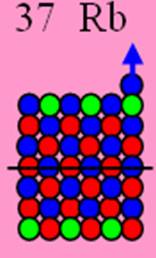
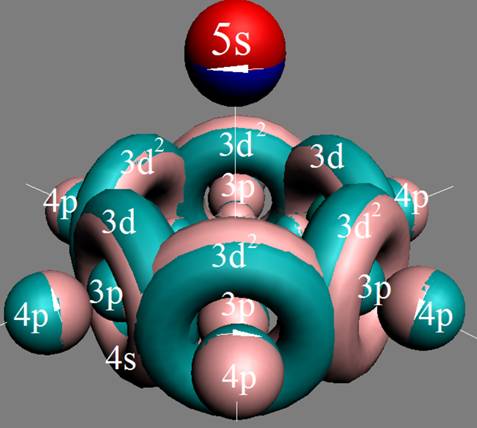
37 Рубидий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа рубидий 85Rb J = 5/2- макс. валентность 1 |
Развёртка протонной оболочки ядра Rb |
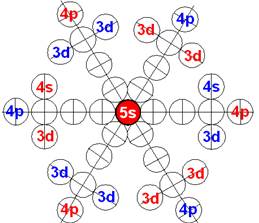
Электронная оболочка и эл. формула [Kr]5s1 атома рубидия макс. валентность 1 |
Схема электронной оболочки атома рубидия валентность 1 |
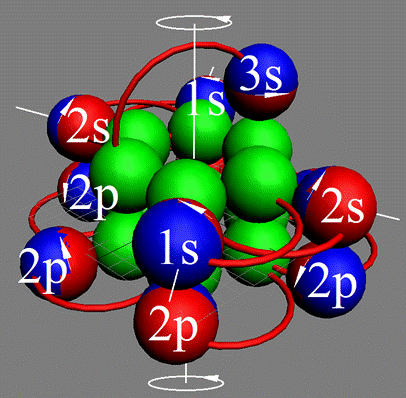
37 Рубидий – Rb. Химический элемент с нечётным зарядом имеет один стабильный изотоп 85Rb(72,15%) и один радиоактивный изотоп 87Rb(27,85%) с периодом полураспада 5х1010лет. Спин J = 5/2- говорит о нецентральном положении 5s- протона.
Вывод: непарные s протоны всегда на торце ядра атома занимают нецентральноосевое положение.
Физический смысл происходящего: первый одиночный s протон вносит дисбаланс в симметричное ядро инертного атома и центробежные силы при вращении неизбежно отбрасывают его на край торца ядра.
Как только появляется второй s протон, с оппозитного торца ядра атома, симметрия восстанавливается, что мы видим на примере следующего элемента Sr стронция.
38 Стронций.
|
|
|
|
|
|
|
|||
|
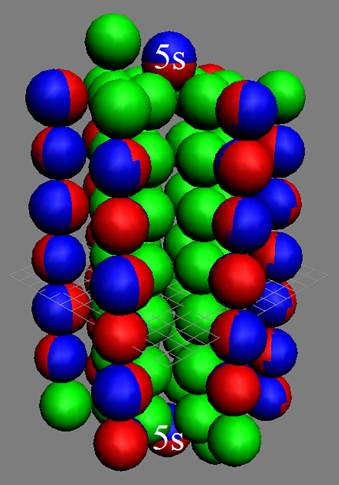
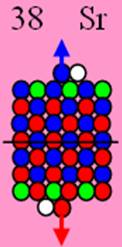
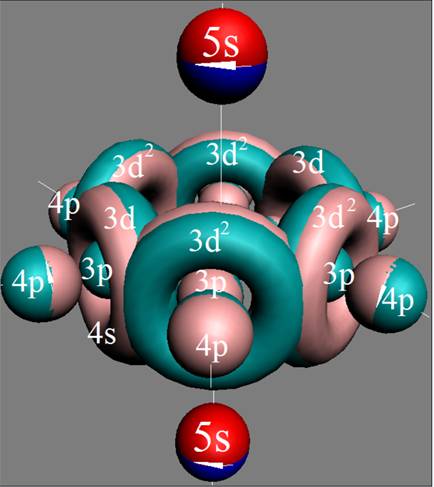
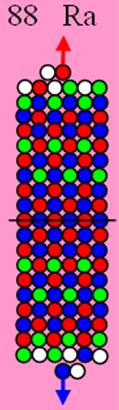
Ядро изотопа стронций 88Sr J = 0+ макс. валентность 2 |
Развёртка протонной оболочки ядра Sr |
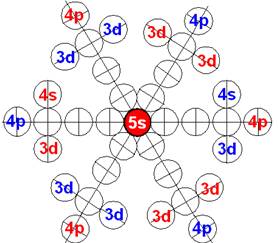
Электронная оболочка и эл. формула [Kr]5s2 атома стронция макс. валентность 2 |
Схема электронной оболочки атома стронция валентность 2 |
38 Стронций – Sr. Химический элемент с чётным зарядом имеет четыре стабильных изотопа, самый распространённый 88Sr (82,56%), 84Sr (0,56%), 86Sr (9,86%), 87Sr (7,02%). Изотоп стронция 88Sr тоже обладает магическим статутом, у него 50 нейтронов.
Два торцевых валентных 5s электрона обеспечивают стронцию стабильную валентность 2.
|
|
|
Сечение электронной оболочки атома стронция Sr |
39 Иттрий.
|
|
|
|
|
|
|
|||
|
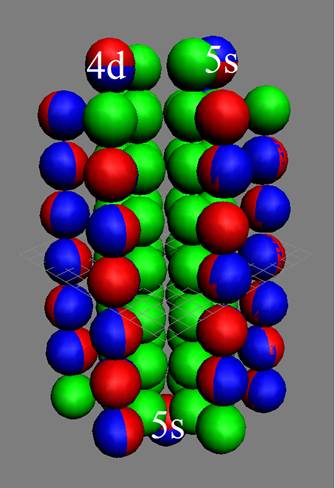
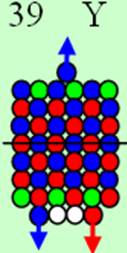
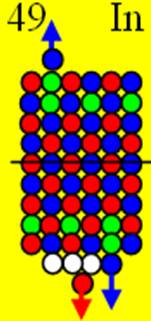
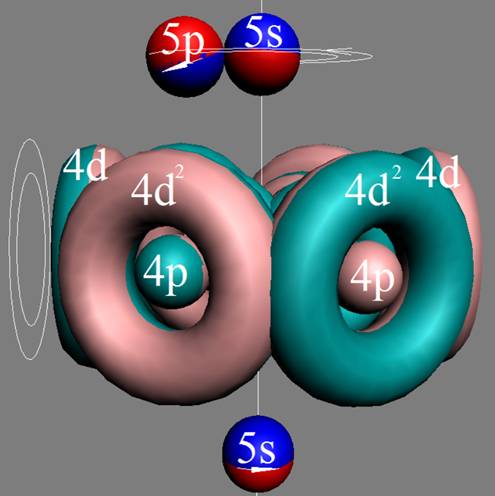
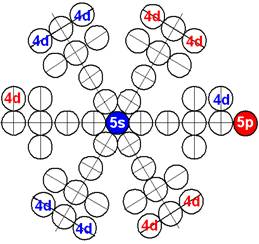
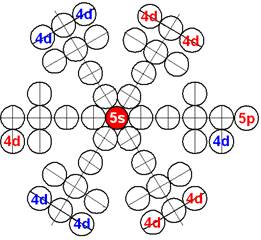
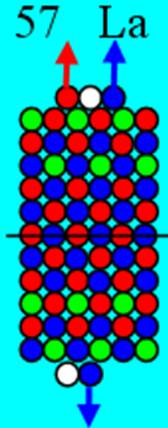
Ядро изотопа иттрий 89Y J = 1/2- макс. валентность+3 |
Развёртка протонной оболочки ядра Y |
Электронная оболочка и эл. формула [Kr]4d15s2 атома иттрия макс. валентность 3 |
Схема электронной оболочки. атома иттрия валентность 3 |
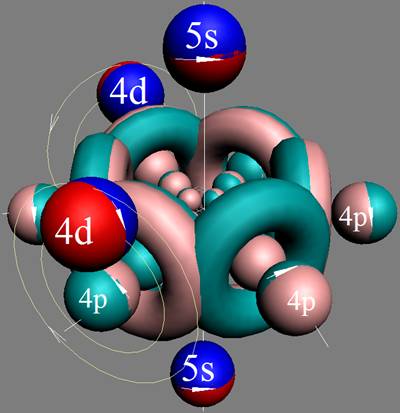
39 Иттрий – Y. Химический элемент с нечётным зарядом имеет только один стабильный изотоп 89Y.
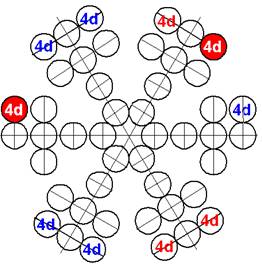
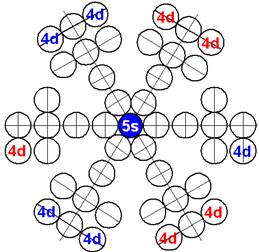
С иттрия начинается строительство «фундамента» для 5р электронных сфер непроницаемости. Между 5р электронными сферами может свободно разместиться шесть парных 4d электронных орбит.
Так появляется первый 4d+ протон. Суммарный спин ядра J = 1/2- обеспечивается тем, что сфера непроницаемости 4d+ электрона имеет примерно одинаковый размер с торцевой 5s+ сферой непроницаемости. Сфера непроницаемости 4d+ электрона мешает занять центрально осевое положение 5s+ сфере непроницаемости. Они, 4d+ и 5s сферы непроницаемости занимают симметричное положение относительно оси вращение ядра изотопа. И 5s+ электрон стягивает 5s+ протон с центрально осевого положения со спином J = 1/2+ в позицию со спином J = 3/2+. Оставшийся в одиночестве другой 5s- протон обеспечивает ядру изотопа 89Y спин J = 1/2-.
Два торцевых валентных 5s электрона и один 4d электрон обеспечивают иттрию валентность 3.
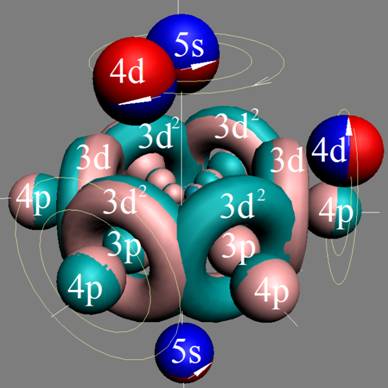
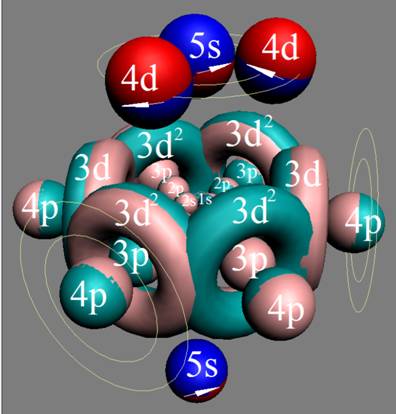
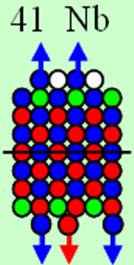
40 Цирконий.
|
|
|
|
|
|
|
|||
|
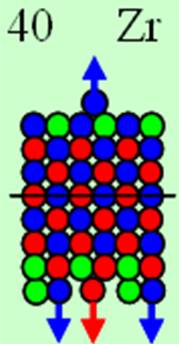
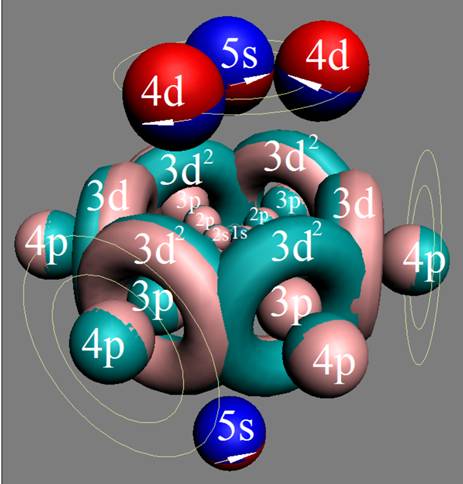
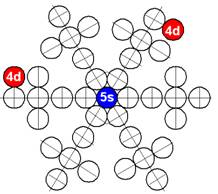
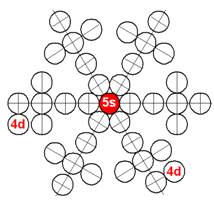
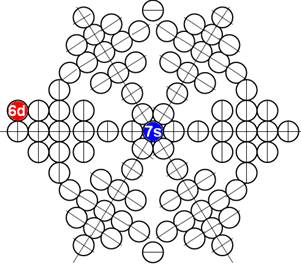
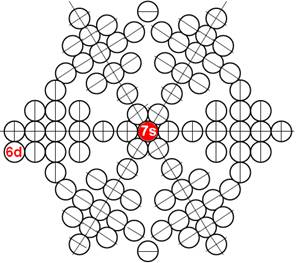
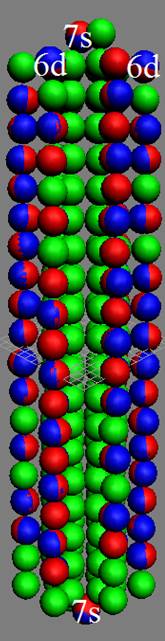
Ядро изотопа цирконий 90Zr J = 0+ макс. валентность 4 |
Развёртка протонной оболочки ядра Zr |
Электронная оболочка и эл. формула [Kr]4d25s2 атома циркония макс. валентность 4 |
Схема эл.онной оболочки атома циркония валентность 4 |
40 Цирконий – Zr. Химический элемент с чётным зарядом имеет пять стабильных изотопов, самый распространённый 90Zr (51,46%), 91Zr (11,23%), 92Zr (17,11%), 94Zr (17,40%), 96Zr (2,80%). У циркония появляется второй 4d+ протон. Суммарный спин ядра J = 0+.
Предельная валентность 4 циркония обеспечивается двумя 5s электронами и двумя 4d+ электронами.
|
|
|
|
|
электронная оболочка атома циркония валентность 2 |
электронная оболочка атома циркония валентность 3 |
электронная оболочка атома циркония валентность 4 |
41 Ниобий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа ниобий 93Nb J = 9/2+ макс. валентность 5 |
Развёртка протонной оболочки ядра Nb |
Электронная оболочка и эл. формула [Kr]4d45s1 атома ниобия макс. валентность 5 |
Схема электронной оболочки атома ниобия валентность 5 |
41 Ниобий – Nb. Химический элемент с нечётным зарядом имеет только один стабильный изотоп 93Nb. У ниобия появляется третье, после хрома и меди, нарушение в строительстве электронной оболочки. Спектральный анализ показывает электронную формулу 5s14d4, а по теории должно быть 5s24d3. Вместо двух 5s электронов у ниобия обнаружен только один 5s электрон.
Почему?
Электроны 5s и 4d имеют практически одинаковую энергию и геометрические размеры сфер непроницаемости, см. таблицу квантования геометрических размеров электронных оболочек 120 химических элементов. У них практически одинаковый радиус сфер непроницаемости и они находятся на практически одинаковом расстоянии от ядра атома. Поэтому, когда появляется третий 4d+ электрон, он предпочитает не тесниться вчетвером на одном торце ядра атома ниобия. Этот электрон стремится восстановить зарядовую симметрию 5р электронной оболочки. Жёстко прикреплённый к нему 4d+ протон появляется на противоположном торце ядра атома. Две сферы непроницаемости 5s+ и 4d+ электронов с одинаковой энергией и одинаковым спином конкурируют за центрально осевое положение 5s+ электрона. В результате оно остаётся вакантным, а 5s+ электрон переходит на 4d+ орбиту.
|
|
|
|
|
|
электронная оболочка атома ниобия валентность 2 |
электронная оболочка атома ниобия валентность 3 |
электронная оболочка атома ниобия валентность 4 |
электронная оболочка атома ниобия валентность 5 |
Как у меди и хрома два валентных торцевых электрона ниобия занимают симметричное положение относительно оси вращения ядра атома. При этом 5s+ электрон стягивает 5s+ протон с центрально осевого положения со спином J = 1/2+ в позицию с спином J = 3/2+. Оставшиеся два не сбалансированных 4d+ протона и один центрально осевой 5s- протон обеспечивает ядру изотопа 93Nb суммарный ядерный спин J = 5/2+ 5/2+ 1/2- = 9/2+.
Предельную валентность ниобия 5 обеспечивают один 4s и четыре 4р+ электрона.
42 Молибден.
|
|
|
|
|
|
|
|||
|
Ядро изотопа молибден98Mo J = 0+ макс. валентность 6 |
Развёртка протонной оболочки ядра Mo |
Электронная оболочка и эл. формула [Kr]4d55s1 атома молибдена макс. валентность 6 |
Схема электронной оболочки атома молибдена валентность 6 |
42 Молибден – Мо. Химический элемент с чётным зарядом имеет семь стабильных изотопов, самый распространённый 98Мо (23,75%), 92Мо (15,86%), 94Мо (9,12%), 95Мо (15,7%), 96Мо (16,5%), 97Мо (9,45%), 100Мо (9,62%).
Точно такая же ситуация как у меди и хрома складывается и у молибдена. Две сферы непроницаемости 5s+ и 4d+ электронов с одинаковой энергией и одинаковым спином конкурируют за центрально осевое положение 5s+ электрона на одном торце ядра атома. В результате оно остаётся вакантным. И мы видим нарушение в строительстве электронной оболочки 5s14d5, а должно быть 5s24d4. Вместо двух 5s электронов у молибдена обнаружен только один 5s электрон. Молибден может принимать валентность 2, 3, 4, 5, 6, но наиболее распространённая валентность 3 и 6. Предельную валентность молибдена 6 обеспечивают один 4s и пять 4р+ электрона.
.
|
|
|
|
Электронная оболочка атома молибдена валентность 3 |
Электронная оболочка атома молибдена валентность 6 |
43 Технеций.
|
|
|
|
|
|
|
|||
|
Ядро изотопа технеций 97Tc J = 9/2+ макс. валентность 7 |
Развёртка протонной оболочки ядра Tc |
Электронная оболочка и эл. формула [Kr]4d55s2 атома технеция макс.валентность 7 |
Схема электронной оболочки атома технеция валентность 7 |
43 Технеций – Тс. Химический элемент с нечётным зарядом не имеет стабильного изотопа. Суммарный спин ядра изотопа 97Тс J = 9/2+ указывает, что оставшиеся два не сбалансированных 4d+ протона и один центрально осевой 5s- протон обеспечивает ядру самого долгоживущего изотопа 97Тс суммарный спин J = 5/2+ 5/2+ 1/2-.= 9/2+.
Отсутствие стабильного изотопа у технеция можно объяснить концентрацией шести протонов одного спина на одном торце ядра. Что является противоестественным явлением.
Максимальная валентность 7, но наиболее распространённая валентность 6. Потому что 5s+ электрон и дав 4d+ электрона на одном из торцов электронной оболочки, одной полярности, и тормозят, мешают друг другу нормально вращаться. Восстанавливается обычный порядок строительства электронной оболочки. Видимо, при одновременной конкуренции трех электронных сфер непроницаемости одной полярности этим достигается оптимальный зарядовый баланс.
44 Рутений.
|
|
|
|
|
|
|
|||
|
Ядро изотопа рутений 102 Ru J = 0+ макс. валентность 8 |
Развёртка протонной оболочки ядра Ru |
Электронная оболочка и эл. формула [Kr]4d75s1 атома рутения макс.валентность 8 |
Схема электронной оболочки атома рутения валентность 8 |
44 Рутений – Ru. Химический элемент с чётным зарядом имеет семь стабильных изотопов, самый распространённый 102Ru (31,61%), 96Ru (5,51%), 98Ru (1,87%), 99Ru (12,72%), 100Ru (12,61%), 101Ru (17,07%), 104Ru (18,58%). Один из торцов ядра рутения имеет строение как у технеция. Второй торец ядра имеет строение как у атома железа.
Наиболее характерная валентность 3 и 4, но экстремальная валентность 8, как у железа. Две пары электронов со спинами + и - симметрично попарно залегают на экваторе и перестают быть валентными. Оставшиеся четыре электрона симметрично перераспределяются по торцам ядра атома рутения. Но с одного торца не хватает одного 5s- электрона. Его место оспаривают два 4d+ электрона, в результате оно остаётся вакантным. И снова в электронной оболочке у рутения обнаруживается нарушение 5s14d7, а должно быть 5s24d6.
RuO4 – очень интересное соединение. В обычных условиях это золотисто-желтые иглообразные кристаллы, которые уже при 25°C плавятся, превращаясь в коричнево-оранжевую жидкость со специфическим запахом, похожим на запах озона. При соприкосновении с малейшими следами большинства органических веществ четырехокись рутения моментально взрывается. Свойство взрываться RuO4 говорит об огромной скрытой энергии, потребовавшейся для получения этой 8 валентности.
|
|
|
|
|
|
Электронная оболочка атома рутения валентность 0 |
Электронная оболочка атома рутения валентность 2 |
Электронная оболочка атома рутения валентность 3 |
Электронная оболочка атома рутения валентность 4 |
Поэтому в таблице периодической системы протонной структуры ядер 120 химических элементов приводится вторая более естественная +6 валентная форма рутения, соответствующая спектральному анализу. При этой валентности одна пара протонов 5s- и 4d+ лежащие на одной вращательной оси, залегают в экваториальном положении, и более не участвует в валентных связях.
|
|
|
|
|
Электронная оболочка атома рутения валентность 6 |
Электронная оболочка атома рутения валентность 7 |
Электронная оболочка атома рутения валентность 8 |
45 Родий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа родий 103Rh J = 1/2- макс. валентность 6 |
Развёртка протонной оболочки ядра Rh |
Электронная оболочка и эл. формула [Kr]4d85s1 атома родия макс.валентность 6 |
Схема электронной оболочки атома родия валентность 6 |
45 Родий – Rh. Химический элемент с нечётным зарядом имеет только один стабильный изотоп 103Rh. Суммарный спин ядра J = 1/2- указывает на отсутствие с одного торца ядра 5s+ протона. Один из торцов ядра родия имеет строение как у технеция и рутения.
О существовании соединений шестивалентного родия в литературе сообщалось неоднократно, однако окончательно это до сих пор не установлено. Наиболее распространённая валентность родия 4.
Высшую степень окисления +6 родий проявляет в гексафториде RhF6, который образуется при прямом сжигании родия во фторе. Соединение неустойчиво. Спектральный анализ показывает нарушение в строительстве электронной оболочки 5s14d8, а должно быть 5s24d7. Вместо двух 5s электронов у родия обнаружено только один 5s электрон. Две сферы непроницаемости 5s+ и 4d+ электронов с одинаковой энергией и одинаковым спином конкурируют за центрально осевое положение 5s+ электрона на одном торце ядра атома.
46 Палладий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа палладий 106Pd J = 0+ валентность 6 |
Развёртка протонной оболочки ядра Pd |
Электронная оболочка и эл. формула [Kr]4d105s0 атома палладия макс. валентность 6 |
Схема электронной оболочки атома палладия валентность 6 |
46 Палладий – Pd. Химический элемент с чётным зарядом имеет шесть стабильных изотопов, самый распространённый 106Pd (27,33%), 102Pd (0,96%), 104Pd (10,97%), 105Pd (22,33%), 108Pd (26,71%), 110Pd (11,81%). У ядра изотопа палладия 106Pd полная зарядовая зеркальная симметрия строения торцов.
Наиболее распространённая валентность палладия 2 и 4 максимально возможная 6. У палладия спектральный анализ вообще не обнаружил 5s электронов и его электронная формула [Kr]4d105s0. Такое явление возникло из за того что ядро палладия стремится к зарядовой симметрии. Торцы ядра достраиваются протонами равномерно, а не по очереди, сначала один торец потом другой торец.
На каждом торце ядра атома палладия в последних протонных кольцах по пять протонов, из них по два протона парных не валентных, «залёгших» навсегда в экваториальной ориентации. Оставшиеся протоны по три на каждом торце ядра атома обеспечивают палладию максимально возможную валентность 6. Эта «лямур де труа», любовь втроем, настолько сильна, что сталкивает 5s протоны из валентного, центрально осевого полярного положение в невалентное, экваториальное 4d положение.
|
|
|
|
|
Электронная оболочка атома палладия валентность 0 |
Электронная оболочка атома палладия валентность 2 |
Электронная оболочка атома палладия валентность 4 |
47 Серебро.
|
|
|
|
|
|
|
|||
|
Ядро изотопа серебро107Ag J = 1/2- валентность 3 |
Развёртка протонной оболочки ядра Ag |
Электронная оболочка и эл. формула [Kr]4d105s1 атома серебра макс. валентность 3 |
Схема электронной оболочки атома серебра валентность 3 |
47 Серебро – Ag. Химический элемент с нечётным зарядом имеет два стабильных изотопа 107Ag (51,35%), 109Ag (48,65%). Суммарный спин ядра J = 1/2- указывает на отсутствие с одного торца ядра 5s+ протона. Оставшийся в одиночестве 5s- протон обеспечивает серебру основную валентность 1. На каждом торце ядра по две пары «залёгших» на экваторе не валентных 4d протонов. И два 4d протона не парных, по одному с каждого торца. Эти два 4d протона обеспечивают валентность серебра 2 и 3.
Спектральный анализ показывает электронную формулу у серебра [Kr]4d105s1, что указывает на отсутствие одного 5s электрона в электронной оболочке атома серебра. Это один 4d+ электрон сталкивает 5s+ электрон с полярной осевой орбиты, так как оба электрона имеют положительный спин. Чтобы не конфликтовать и не тормозить друг друга 5s+ электрон занимает 4d+ орбиту.
48 Кадмий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа кадмий 114Cd J = 0+ валентность 2 |
Развёртка протонной оболочки ядра Cd |
Электронная оболочка и эл. формула [Kr]4d105s2 атома кадмия макс. валентность 2 |
Схема электронной оболочки атома кадмия валентность 2 |
48 Кадмий – Cd. Химический элемент с чётным зарядом имеет семь стабильных изотопов, самый распространённый 114Cd (28,86%), 106Cd (1,215%), 108Cd (0,875%), 110Cd (12,39%), 111Cd (12,75%), 112Cd (24,08%), 116Cd (7,58%). Достроено седьмое протонное кольцо.
С 5s электронами всё в порядке, все в наличии. Они обеспечивают устойчивую валентность 2. Десять 4d электронов создали надёжный фундамент для 5р электронов, заполнив пустующие промежутки между будущими 5р электронными облаками сферами непроницаемости.
Предельную валентность кадмия 2 обеспечивают два 5s электрона.
49 Индий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа индий 115In J= 9/2+ макс. валентность 3 |
Развёртка протонной оболочки ядра In |
Электронная оболочка и эл. формула [Kr]5s24d105p1 атома индия макс. валентность 3 |
Схема электронной оболочки атома индия валентность 3 |
49 Индий – In. Химический элемент с нечётным зарядом имеет только один стабильный изотоп 113In. Начинается строительство десятого углеродного слоя - 5р протонной оболочки ядра и заполнение первым 5р+ электроном электронной 5р оболочки. Суммарный спин ядра изотопа 113In J=5/2+3/2+1/2+ = 9/2+, что указывает на не симметричное расположение 5s протонов. Один 5s протон занимает не центрально осевое положение, его спин J=3/2+.
Предельную валентность индия 3 обеспечивают два 5s и один 5р+ электрон.
50 Олово.
|
|
|
|
|
|
|
|||
|
Ядро изотопа олово 120Sn J = 0+ макс. валентность 4 |
Развёртка протонной оболочки ядра Sn |
Электронная оболочка и эл. формула [Kr]5s24d105p2 атома олова макс. валентность 4 |
Схема электронной оболочки атома олова валентность 4 |
50 Олово – Sn. Химический элемент с чётным зарядом имеет десять стабильных изотопов! Олово рекордсмен по числу устойчивых изотопов, самый распространённый 120Sn (32,97%), 112Sn (0,95%), 114Sn (0,65%), 115Sn (0,34%), 116Sn (14,24%), 117Sn (7,57%), 118Sn (24,01%), 119Sn (8,58%), 122Sn (4,71%), 124Sn (5,98%).
В строящемся десятом углеродном слое появляется второй 5р+ электрон. Предельную валентность олова 4 обеспечивают два 5s и два 5р+ электрона.
|
|
|
|
Электронная оболочка атома олова валентность 2 |
Электронная оболочка атома олова валентность 4 |
51. Сурьма.
|
|
|
|
|
|
|
|||
|
Ядро изотопа сурьма 121Sb J = 5/2+ валентность 5 |
Развёртка протонной оболочки ядра Sb |
Электронная оболочка и эл. формула [Kr]5s24d105p3 атома сурьмы макс. валентность 5 |
Схема электронной оболочки атома сурьмы валентность 5 |
51. Сурьма – Sb. Химический элемент с нечётным зарядом имеет два стабильных изотопа 121Sb (57,25%), 123Sb (42,75%). В десятом углеродном кольце появляется третий 5р+ электрон.
Предельную валентность сурьме 5 обеспечивают два 5s и три 5р+ электрона.
52 Теллур.
|
|
|
|
|
|
|
|||
|
Ядро изотопа теллур 130Te J = 0+ макс. валентность 6 |
Развёртка протонной оболочки ядра Te |
Электронная оболочка и эл. формула [Kr]5s24d105p4 атома теллура макс. валентность 6 |
Схема электронной оболочки атома теллура валентность 6 |
52 Теллур – Те. Химический элемент с чётным зарядом имеет семь стабильных изотопов, самый распространённый 130Те (34,48%), 120Те (0,089%), 122Те (2,46%), 124Те (4,61%), 125Те (6,99%), 126Те (18,71%), 128Те (31,79%). Начинается строительство одиннадцатого углеродного кольца, появляется четвёртый 5р- электрон.
Предельную валентность теллура 6 обеспечивают два 5s три 5р+ и один 5р- электрон.
53 Йод.
|
|
|
|
|
|
|
|||
|
Ядро изотопа йод 127I J = 5/2+ макс. валентность 7 |
Развёртка протонной оболочки ядра I |
Электронная оболочка и эл. формула [Kr]5s24d105p5 атома йода макс. валентность 7 |
Схема электронной оболочки атома йода валентность 7 |
53 Йод – I. Химический элемент с нечётным зарядом имеет только один стабильный изотоп 127I. Появляется пятый 5р-протон в одиннадцатом протонном слое. Суммарный спин ядра изотопа 127I J = 5/2+.
Предельную валентность теллура 7 обеспечивают два 5s три 5р+ и два 5р- электрона.
54 Ксенон.
|
|
|
|
|
|
|
|||
|
Ядро изотопа ксенон 132Xe J = 0+ макс. валентность 0 |
Развёртка протонной оболочки ядра Xe |
Электронная оболочка и эл. формула [Kr] 5s24d105p6 атома ксенона валентность 0 |
Схема электронной оболочки атома ксенона валентность 0 |
54 Ксенон – Xe. Химический элемент с чётным зарядом имеет девять стабильных изотопов, самый распространённый 132Xe (26,89%), 124Xe (0,096%), 126Xe (0,09%), 128Xe (1,919%), 129Xe (26,44%), 130Xe (21,18%), 131Xe (26,89%), 134Xe (10,44%), 136Xe (8,87%).
Шестой 5р- электрон завершает строительство одиннадцатого 5р слоя-оболочки инертного одноатомного газа ксенона. Каждый торец ядра атома ксенона, как и у криптона, заканчивается разряжённым р протонным слоем из трёх р протонов, вместо обычных шести протонов. В торцовых слоях вакантные места трёх протонов занимают два нейтрона, третье место остаётся вакантным. Это вакантное место позволяет разворачиваться в валентное полярное положение 5s протонам, обеспечивая предельную валентность 8, формально инертному газу ксенону. Такая химическая активность газа ксенона объясняется уникальным строением ядра атома.
|
|
|
|
|
|
Электронная оболочка атома ксенона валентность 2 |
Электронная оболочка атома ксенона валентность 4 |
Электронная оболочка атома ксенона валентность 6 |
Электронная об-чка атома ксенона валентность 8 |
Формально инертный газ ксенон слишком активен, для инертных газов, и реагирует даже при нормальных условиях, демонстрируя чуть ли не все возможные степени окисления (+1, +2, +4, +6, +8).
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Электронная оболочка инертного газа ксенона |
Порядок заполнения протонной оболочки ядра атома ксенона |
55 Цезий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа цезий 133Cs J = 7/2+ макс. валентность 1 |
Развёртка протонной оболочки ядра Cs |
Электронная оболочка и эл. формула [Xe]6s1 атома цезия валентность 1 |
Схема электронной оболочки атома цезия валентность 1 |
55 Цезий – Cs. Химический элемент с нечётным зарядом имеет только один стабильный изотоп 133Cs. Пятьдесят пятый 6s+ протон не может занять центрально-осевое положение из-за вращения ядра атома. Его откидывает центробежная сила на периферию торца ядра. Об этом говорит суммарный спин ядра атома, равный J = 3/2-1/2+5/2+=7/2+.
Валентный 6s электрон занимает полярную область и обеспечивает цезию валентность 1.
56 Барий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа барий 138Ba J =0+ макс. валентность 2 |
Развёртка протонной оболочки ядра Ba |
Электронная оболочка и эл. формула [Xe]6s2 атома бария валентность 2 |
Схема электронной оболочки атома бария валентность 2 |
56 Барий – Ва. Химический элемент с чётным зарядом имеет семь стабильных изотопов, самый распространённый 138Ва (71,66%), 130Ва (0,101%), 132Ва (0,097%), 134Ва (2,42%), 135Ва (6,59%), 136Ва (7,81%), 137Ва (11,32%). Следующий пятьдесят шестой 6s- протон исправляет ситуацию. Между торцевыми валентными протонами устанавливается магнитная связь, и они занимают центрально осевое положение. Суммарный спин J =0+ говорит об этом.
Два полярных 6s электрона обеспечивают барию предельную валентность 2.
|
|
|
Сечение электронной оболочки атома бария |
57 Лантан.
|
|
|
|
|
|
|
|||
|
Ядро изотопа лантан 139La J = 7/2+ макс. валентность 3 |
Развёртка протонной оболочки ядра La |
Электронная оболочка и эл. формула [Xe]5d16s2 атома лантана валентность 3 |
Схема электронной оболочки атома лантана валентность 3 |
57 Лантан – La. Химический элемент с нечётным зарядом имеет только один стабильный изотоп 139La (99,911%). У ядра атома лантана начинается строительство двенадцатого протонного слоя. Суммарный спин ядра изотопа 139La J = 3/2+1/2-5/2+=7/2+ говорит о том, что на одном из торцов ядра изотопа один 4d+ протон имеет спин J =5/2+, а 6s+ протон имеет спин J =3/2+, т.е. он не занимает осевое положение.
После формирования замкнутой 5р электронной оболочки ксенона начинается строительство шестой электронной оболочки с поочерёдным появлением двух валентных 6s электронных сфер непроницаемости на оси вращения замкнутой оболочки атома ксенона. Так появляются одновалентный химический элемент цезий Cs55 и двухвалентный барий Ba56. Далее идёт традиционное строительство - оболочки лантана La57 как у скандия Sc21 и у иттрия Y39.
Два полярных 6s электрона и один 5d электрон обеспечивают лантану стабильную валентность 3.
|
|
|
Электронная оболочка лантана валентность 2 |
58 Церий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа церий 140Ce J = 0+ макс. валентность 4 |
Развёртка протонной оболочки ядра Ce |
Электронная оболочка и эл. формула [Xe]4f26s2 атома церия макс. валентность 4 |
Схема электронной оболочки атома церия валентность 4 |
58 Церий – Се. Химический элемент с чётным зарядом имеет четыре стабильных изотопа, самый распространённый 140Се (88,48%), 136Се (0,193%), 138Се (0,25%), 142Се (11,07%). У ядра атома церия продолжается строительство двенадцатого протонного слоя. Ещё один валентный протон обеспечивает церию предельную валентность 4.
Спектральный анализ показывает различные варианты строительства электронной оболочки у церия. Либо (Xe)6s24f2 либо (Xe)6s24f15d1. Это говорит о том, что сфера непроницаемости четвёртого валентного электрона может занимать несколько энергетически удобных положений.
В предыдущем третьем электронном слое-оболочке не было зазора между соседними орбитами 3d электронов. В новом четвёртом электронном слое-оболочке появляется зазор между соседними орбитами 4d электронов. В этом зазоре хватает места для новой энергетически более выгодной орбиты. Так начиная с церия, у атомов появляются орбиты 4f электронов. В этот зазор или щель между орбитами, начиная с церия, проваливаются все последующие новые 5d электроны. Провалившись на более низкий энергетический уровень-орбиту, 5d электрон увеличивает свою энергию связи с протонами ядра и превращается в 4f электрон. Приближение к ядру атома вызывает увеличение скорости вращения электрона и уменьшение радиуса его вращения с 5R до 4R (эффект фигуриста на льду, сводящего раскинутые руки).
Два полярных 6s электрона и два 4f электрона обеспечивают церию предельную валентность 4.
59 Празеодим.
|
|
|
|
|
|
|
|||
|
Ядро изотопа празеодим 141Pr J = 5/2+ макс. валентность 4 |
Развёртка протонной оболочки ядра Pr |
Электронная оболочка и эл. формула [Xe]4f36s2 атома празеодим валентность 4 |
Схема электронной оболочки атома празеодим валентность 4 |
59 Празеодим – Pr. Химический элемент с нечётным зарядом имеет только один стабильный изотоп 141Pr.
Если церий Се58 и в меньшей мере празеодим Pr59 ещё показывают переменную валентность 3 и 4 и соответственно в спектре его можно обнаружить линии как 5d так и 4f, то у последующих химических элементов, до европия Eu63 включительно, этого нет.
Валентные d электроны могут вращаться вокруг полярных валентных s электронов группами до трёх электронов с обоих торцов атома. В отличие от валентных d электронов f электроны могут вращаться вокруг полярных валентных s электронов группами не более двух штук и только с одного торца атома.
У празеодима залегает в экваториальное не валентное положение навсегда третий 4f+ электрон. Два других 4f+ электрона иногда, при определённых условиях, присоединяются к нему, обеспечивая празеодиму переменную валентность 2, 3, 4.
60 Неодим.
|
|
|
|
|
|
|
|||
|
Ядро изотопа неодим 142Nd J = 0+ макс. валентность 4 |
Развёртка протонной оболочки ядра Nd |
Электронная оболочка и эл. формула [Xe]4f46s2 атома неодима валентность 4 |
Схема электронной оболочки атома неодима валентность 4 |
60 Неодим – Nd. Химический элемент с чётным зарядом имеет шесть стабильных изотопов, самый распространённый 142Nd (27,11%), 143Nd (12,17%), 145Nd (8,30%), 146Nd (17,22%), 148Nd (5,72%), 150Nd (5,60%), и один долгоживущий изотоп 144Nd (23,83%) с периодом полураспада 5х1015лет.
Ёмкость разрывов между 4d электронными оболочками ограничена шестью экваториальными 4f орбитами с противоположными спинами. Каждая орбита вмещает по два 4f электрона одного спина.
У неодима залегает в экваториальное не валентное положение навсегда четвёртый 4f+ электрон. Два других валентных 4f+ электрона, вращающихся на околополярных орбитах, обеспечивают неодиму переменную валентность 2, 3, 4.
61 Прометий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа прометий145Pm J = 5/2+ макс. валентность 3 |
Развёртка протонной оболочки ядра Pm |
Электронная оболочка и эл. формула [Xe]4f56s2 атома прометий валентность 3 |
Схема электронной оболочки атома прометий валентность 3 |
61 Прометий – Pm. Химический элемент с нечётным зарядом не имеет стабильных изотопов, самый долгоживущий изотоп 145Pm имеет период полураспада 17,7 года. Радиоактивен.
Если у неодима гарантированно залипают на экваторе два не валентных 4f+ электрона, то у прометия надёжно залипает сразу четыре 4f+ электрона, образуя симметричную электронную оболочку.
Предельная валентность прометия 3 обеспечивают два 6s и один 4f+ электрон.
62 Самарий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа самарий 152Sm J = 0+ макс. валентность 3 |
Развёртка протонной оболочки ядра Sm |
Электронная оболочка и эл. формула [Xe]4f66s2 атома самария валентность 3 |
Схема электронной оболочки атома самария валентность 3 |
62 Самарий – Sm. Химический элемент с чётным зарядом имеет шесть стабильных изотопов, самый распространённый 152Sm (26,63%), 144Sm (3,16%), 148Sm (11,27%), 149Sm (13,82%), 150Sm (7,47%), 154Sm (22,52%), и два долгоживущих изотопа 147Sm (15,07%), 146Sm. Начинает строиться тринадцатый протонный слой.
У самария все шесть 4f+ электрона могут залегать на трёх экваториальных не валентных орбитах, обеспечивая симметричную форму строения 4f электронных оболочек, см. рисунок. Вращаться вокруг 6s+ электрона может один валентный 4f+ электрон, обеспечивая самарию валентность 3, или 2, если 4f электрон выпадает на экватор и становится инертным.
Предельная валентность самария 3 обеспечивают два 6s и один 4f+ электрон.
63 Европий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа европий 153Eu J = 5/2+ макс. валентность 3 |
Развёртка протонной оболочки ядра Eu |
Электронная оболочка и эл. формула [Xe]4f76s2 атома европия валентность 3 |
Схема электронной оболочки атома европия валентность 3 |
63 Европий – Eu. Химический элемент с нечётным зарядом имеет два стабильных изотопа 153Eu (52,18%), 151Eu (47,82%). У европия семь 4f+ электронов. Шесть из них образуют симметричную, хорошо сбалансированную по зарядам, электронную оболочку атома. Седьмой 4f+ остаётся постоянно в валентном положении, занимая постоянную 4f+ орбиту вращаясь под 6s+ электроном.
Появление седьмой постоянной орбиты 4f+ электрона вызывает «разбухание» электронной оболочки. Разбухание электронной оболочки уменьшает междуатомные связи и вызывает падение температуры плавления европия см на графики ниже.
Предельная валентность европия 3 обеспечивают два 6s и один 4f+ электрон.
У s- и p-элементов изменение атомных радиусов как в периодах, так и в подгруппах более ярко, чем у d- и f-элементов, поскольку d- и f-электроны внутренние. Уменьшение радиусов у d- и f-элементов в периодах называется d- и f-сжатием. Следствием f-сжатия является то, что атомные радиусы электронных аналогов d-элементов пятого и шестого периодов практически одинаковы: Zn – Hf 0,160 – 0,159 rатома, нм и Nb – Ta 0,145 – 0,146 rатома, нм.
64 Гадолиний.
|
|
|
|
|
|
|
|||
|
Ядро изотопа гадолиний158Gd J = 0+ макс. валентность 3 |
Развёртка протонной оболочки ядра Gd |
Электронная оболочка и эл. формула [Xe]4f75d16s2 атома гадолиния валентность 3 |
Схема электронной оболочки атома гадолиния валентность 3 |
64 Гадолиний – Gd. Химический элемент с чётным зарядом имеет шесть стабильных изотопов, самый распространённый 158Gd (24,87%),154Gd (2,15%), 155Gd (14,73%), 156Gd (20,47%), 157Gd (15,68%), 160Gd (21,9%) и два долгоживущих изотопа 152Gd (0,20%), 150Gd. У гадолиния уникально высокое сечение захвата 46000барн, а у изотопа 157 150000барн. Он ферромагнетик более сильный, чем никель и кобальт. Эти уникальные свойства становятся понятны, если внимательно приглядеться к строению изотопа гадолиния 158Gd и его электронной оболочки. Два его торцевых валентных 6s протона возвышаются над торцами с явным дефицитом нейтронов, обеспечивая свободные магнитные площадки для захвата пролетающих мимо нейтронов и протонов. На положительном магнитном торце ядра изотопа 6 вакантных мест для нуклонов, на отрицательном магнитном торце ещё 6 вакантных мест для захвата нуклонов. Два магнитно несбалансированных седьмой 4f+ и один 5d+ протона с их электронами обеспечивают высокие ферримагнитные свойства.
Гадолиний имеет нарушение в порядке заполнения электронной оболочки, вместо (Хе)6s24f8 у гадолиния появляется один электрон на 5d оболочке и электронная оболочка выглядит так: (Хе)6s24f75d1.
Постоянная валентность 3 обеспечивается двумя 6s электронами и 5d+ электроном.
Они, 5d электроны, не могут появляться, пока не заполнен хотя бы один разрыв между будущими 6р электронными облаками.
Но ёмкость разрывов между 4р электронными оболочками ограничена шестью 4d+ орбитами, по три орбиты с каждого торца электронного облака с одинаковым спином J=1/2. У изотопа гадолиния 158Gd происходит полное заполнение шести позиций со спином J=1/2, седьмой валентный 5d+ электронный вихрь залип на 6s- электронном вихре, обеспечивая валентность 3.
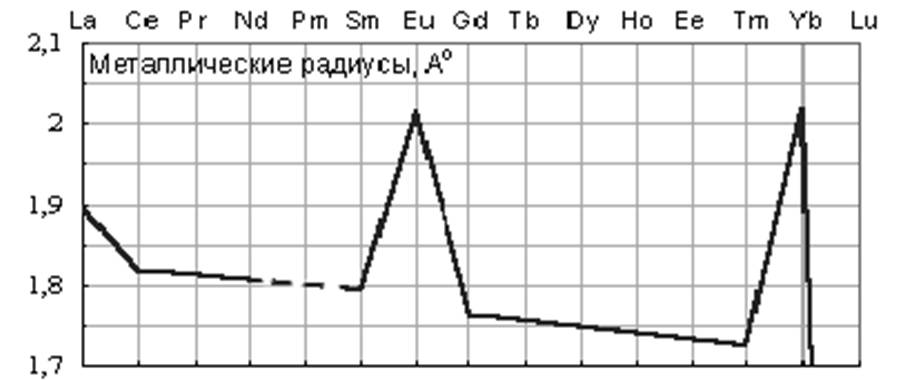
Зависимость орбитального радиуса (радиуса внешних орбиталей) f-элементов 6-го периода от заряда ядра.
Из графика металлических радиусов видно, что лантаноиды, проявляющие валентность 2, европий и иттербий, имеют максимальные радиусы, и минимальную
температуру плавления.
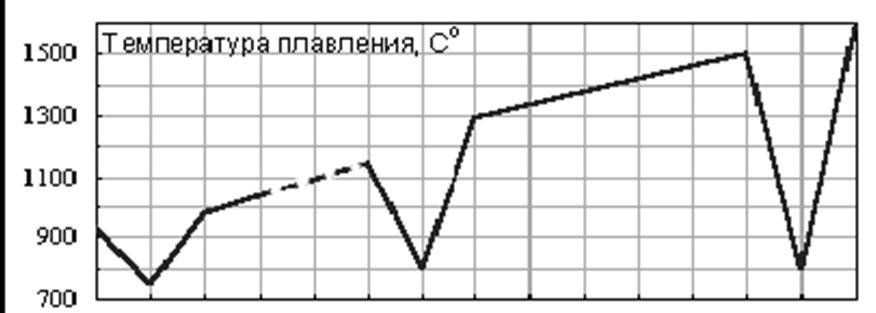
65 Тербий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа тербий 159Tb J = 3/2+ макс. валентность 4 |
Развёртка протонной оболочки ядра Tb |
Электронная оболочка и эл. формула [Xe]4f96s2 атома тербия валентность 4 |
Схема электронной оболочки атома тербия валентность 4 |
65 Тербий – Tb. Химический элемент с нечётным зарядом имеет только один стабильный изотоп 159Tb. Стабилизационный нейтрон, около 6s протона, придаёт ядру изотопу тербия 159Tb суммарный ядерный спин J = 3/2+.
Последующие электронные оболочки химических элементов №№ 65-70 достраиваются только электронами с отрицательным спином -1/2. У тербия переменная валентность 3, 4, тоже возникает из-за наличия на торцах ядра атома двух 4f протонов со спинами (+) и (-). Из девати 4f электронов восемь электронов симметрично намертво «залегли» на экваториальных орбитах и перестали быть валентными.
Предельную валентность тербия 4 обеспечивают два 6s и два 4f электрона.
66 Диспрозий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа диспрозий164Dy J = 0+ макс. валентность 4 |
Развёртка протонной оболочки ядра Dy |
Электронная оболочка и эл. формула [Xe]4f106s2 атома диспрозия валентность 4 |
Схема электронной оболочки атома диспрозия валентность 4 |
66 Диспрозий – Dy. Химический элемент с чётным зарядом имеет семь стабильных изотопов, самый распространённый 164Dy (28,18%), 156Dy (0,0524%), 158Dy (0,0902%), 160Dy (2,294%), 161Dy (18,88%), 162Dy (25,53%), 163Dy (24,97%). Начинается строительство четырнадцатого протонного слоя.
У диспрозия переменная валентность 3, 4, возникает из-за наличия на торцах ядра атома двух 4f протонов со спинами (+) и (-) и двух 6s протонов. Симметрия, однако! Из десяти 4f электронов восемь электронов симметрично намертво «залегли» на экваториальных орбитах и перестали быть валентными.
Предельную валентность диспрозия 4 обеспечивают два 6s и два 4f электрона.
67 Гольмий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа гольмий 165Ho J = 7/2- макс. валентность 3 |
Развёртка протонной оболочки ядра Ho |
Электронная оболочка и эл. формула [Xe]4f116s2 атома гольмия валентность 3 |
Схема электронной оболочки атома валентность |
67 Гольмий – Но. Химический элемент с нечётным зарядом имеет только один стабильный изотоп 165Но.
Из одиннадцати 4f электронов у гольмия десять электронов симметрично намертво «залегли» на экваториальных орбитах и перестали быть валентными. Симметрия, однако!
Избыточный «лишний» для симметрии одиннадцатый 4f+ электрон и два 6s электрона обеспечивают стабильную валентность гольмия 3.
68 Эрбий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа эрбий 166Er J = 0+ макс. валентность 3 |
Развёртка протонной оболочки ядра Er |
Электронная оболочка и эл. формула [Xe]4f126s2 атома эрбия валентность 3 |
Схема электронной оболочки атома эрбия валентность 3 |
68 Эрбий – Er. Химический элемент с чётным зарядом имеет шесть стабильных изотопов, самый распространённый 166Er (27,07%), 162Er (0,136%), 164Er (1,56%), 167Er (22,94%), 168Er (27,07%), 170Er (14,88%). Закончено строительство десятого протонного слоя.
Двенадцатый, не спаренный 4f+ электрон и два 6s электрона, обеспечивают стабильную валентность эрбию 3.
69 Тулий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа тулий 169Tm J=1/2+ макс. валентность 3 |
Развёртка протонной оболочки ядра Tm |
Электронная оболочка и эл. формула [Xe]4f136s2 атома тулия валентность 3 |
Схема электронной оболочки атома тулия валентность 3 |
69 Тулий – Tu. Химический элемент с нечётным зарядом имеет только один стабильный изотоп 169Tu. Суммарный ядерный спин туллия J=1/2+ указывает на отсутствие одного 6s- протона на оси вращения ядра атома. Как натрий, калий, рубидий, изотоп тулия имеет на торце ядра валентный 6s- протон со смещением от центра симметрии ядра (J = 5/2-). Его уравновешивает тринадцатый 4f- протон и нейтрон. Закончено строительство одиннадцатого протонного слоя. Торцевой 4f+ протон иногда разворачивается в экваториальное не валентное положение, обеспечивая туллию валентность 2, обычная валентность 3.
У тулия шесть 4f- электронов и шесть 4f+ электронов они залипают симметрично попарно над 4d+ орбитами. Образуется симметричная, хорошо сбалансированная по зарядам электронная оболочка атома. Седьмой 4f+ электрон остаётся постоянно в валентном положении, занимая постоянную 4f+ орбиту вращаясь под 6s+ электроном.
70 Иттербий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа иттербий174Yb J = 0+ макс. валентность 3 |
Развёртка протонной оболочки ядра Yb |
Электронная оболочка и эл. формула [Xe]4f146s2 атома иттербия валентность 3 |
Схема электронной оболочки атома иттербия валентность 3 |
70 Иттербий – Yb. Химический элемент с чётным зарядом имеет семь стабильных изотопов, самый распространённый 174Yb (31,84%), 168Yb (0,140%), 170Yb (3,03%), 171Yb (14,31%), 172Yb (21,82%), 173Yb (16,13%), 176Yb (12,73%). У иттербия появляется последний четырнадцатый 4f– протон.
У иттербия семь 4f+ электронов и семь 4f- электронов. Эти двенадцать 4f+ электронов залипают попарно над 4d+ орбитами. Образуется хорошо сбалансированная по зарядам, симметричная электронная оболочку атома. Тринадцатый и четырнадцатый 4f электроны остаются постоянно на полярных орбитах, вращаясь под торцевыми валентными 6s электронами. Но валентным бывает только один 4f+ электрон, вероятно, проявляется небольшая разница в энергиях 4f+ и 4f- электронов.
Появление четырнадцатой постоянной орбиты 4f- электрона вызывает «разбухание» электронной оболочки атома иттербия. Разбухание электронной оболочки уменьшает междуатомные связи и вызывает падение температуры плавления тулия см на графики выше.
Два 4f протона часто симметрично залипают, обеспечивая иттербию валентность 2, обычная валентность 3.
71 Лютеции.
|
|
|
|
|
|
|
|||
|
Ядро изотопа лютеций175Lu J = 7/2- макс. валентность 3 |
Развёртка протонной оболочки ядра Lu |
Электронная оболочка и эл. формула [Xe]4f145d16s2 атома лютеция валентность 3 |
Схема электронной оболочки атома лютеция валентность 3 |
71 Лютеции – Lu. Химический элемент с нечётным зарядом имеет только один стабильный изотоп 175Lu (97,41%) и один долгоживущий 176Lu (2,59%) с периодом полураспада 2,4х1010 лет. С лютеция начинает застраиваться пятнадцатый протонный 5d слой. Первый 5d- протон появляется со стороны 6s+ протона, обеспечивая совместно с 6s протонами лютецию валентность 3.
У лютеция появляется устойчивая 5d электронная орбита. Получив «обрамление» из 4f орбит вокруг всего атома 5d электрону более некуда сваливаться. Это единственно возможная для 71 электрона энергетически выгодная орбита.
Предельную валентность лютецию 3 обеспечивают два 6s и один 5d+ электрон.
72 Гафний.
|
|
|
|
|
|
|
|||
|
Ядро изотопа гафний 180Hf J = 0+ макс. валентность 4 |
Развёртка протонной оболочки ядра Hf |
Электронная оболочка и эл. формула [Xe]4f145d26s2 атома гафния валентность 4 |
Схема электронной оболочки атома гафния валентность 4 |
72 Гафний – Hf. Химический элемент с чётным зарядом имеет пять стабильных изотопов, самый распространённый 180Hf (35,22%), 176Hf (5,21%), 177Hf (18,56%), 178Hf (27,1%), 179Hf (13,75%), и два радиоактивных долгоживущих изотопа 174Hf (0,163%) 182Hf. Два 5d- протона липнут к 6s+ протону с одного торца ядра атома, обеспечивая максимальную валентность 4.
Предельную валентность гафнию 4 обеспечивают два 6s и два 5d+ электрона.
73 Тантал.
|
|
|
|
|
|
|
|||
|
Ядро изотопа тантал 181Ta J=7/2+ макс. валентность 5 |
Развёртка протонной оболочки ядра Ta |
Электронная оболочка и эл. формула [Xe]4f145d36s2 атома тантала валентность 5 |
Схема электронной оболочки атома тантала валентность 5 |
73 Тантал – Та. Химический элемент с нечётным зарядом имеет только один стабильный изотоп 181Та (99,9877%) и один долгоживущий 180Та (0,0123%). Третий 5d- протон заполняет все вакантные места для 5d- протонов на одном торце ядра атома тантала. Суммарный ядерный спин изотопа тантала 181Ta J = 5/2+3/2+1/2- = 7/2+ указывает на не симметричное строение ядра атома.
Предельную валентность танталу 5 обеспечивают два 6s и три 5d+ электрона.
74 Вольфрам.
|
|
|
|
|
|
|
|||
|
Ядро изотопа вольфрам184W J = 0+ макс. валентность 6 |
Развёртка протонной оболочки ядра W |
Электронная оболочка и эл. формула [Xe]4f145d46s2 атома вольфрама валентность 6 |
Схема электронной оболочки атома вольфрама валентность 6 |
74 Вольфрам – W. Химический элемент с чётным зарядом имеет пять стабильных изотопов, самый распространённый 184W (30,64%), 180W (0,135%), 182W (26,41%), 183W (14,4%), 186W (28,41%). У вольфрама начинает застраиваться 5d+ протонами второй торец ядра атома.
Предельную валентность вольфраму 6 обеспечивают два 6s и четыре 5d+ электрона.
75 Рений.
|
|
|
|
|
|
|
|||
|
Ядро изотопа рений 187Re J = 5/2+ макс. валентность 7 |
Развёртка протонной оболочки ядра Re |
Электронная оболочка и эл. формула [Xe]4f145d56s2 атома рения валентность 7 |
Схема электронной оболочки атома рения валентность 7 |
75 Рений – Re. Химический элемент с нечётным зарядом имеет только один стабильный изотоп 185Re(37,07%) и один долгоживущий 187Re(62,93%) с периодом полураспада 1011лет. Суммарный ядерный спин изотопа рений 187Re J = 5/2+ указывает на не симметричное строение ядра атома.
В валентных связях могут принимать участие два 6s протона на торцах ядра и пять 5d протонов, Торцевые 5d протоны могут занимать две разные осевые ориентации, инертную экваториальную или валентную приполярную, обеспечивая разную валентность рению от 3 до 7. Валентность 1 и 2 обеспечивают 6s протоны, а валентности 3, 4, 5, 6, 7 обеспечивают 5d протоны. Если ось вращения протона параллельна оси вращения ядра атома, то он валентный, если ось вращения протона перпендикулярна оси вращения ядра атома, то он инертный.
Предельную валентность рению 7 обеспечивают два 6s и пять 5d+ электрона.
76 Осмий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа осмий 192Os J = 0+ макс. валентность 8 |
Развёртка протонной оболочки ядра Os |
Электронная оболочка и эл. формула [Xe]4f145d66s2 атома осмия валентность 8 |
Схема электронной оболочки. атома осмия валентность 8 |
76 Осмий – Os. Химический элемент с чётным зарядом имеет семь стабильных изотопов, самый распространённый 192Os (41,0%), 184Os (0,018%), 186Os (1,59%), 187Os (1,64%), 188Os (13,3%), 189Os (16,1%), 190Os (26,4%). Как железо, рутений и хассий, осмий может быть в редком, предельно возможном восьмивалентном состоянии. В этом ему помогает шестой, с противоположным спином 5d+ протон.
Электрон этого протона, имея противоположное вращение, строит вокруг себя тройку валентных электронов два 5d+ электрона и один 6s+ протон.
Предельную валентность осмию 8 обеспечивают два 6s пять 5d+ электрона и один 5d- электрон.
77 Иридий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа иридий 193Ir J = 3/2+ макс. валентность 6 |
Развёртка протонной оболочки ядра Ir |
Электронная оболочка и эл. формула [Xe]4f145d76s2 атома иридия валентность 6 |
Схема электронной оболочки. атома иридия валентность 6 |
77 Иридий – Ir. Химический элемент с нечётным зарядом имеет два стабильных изотопа 193Ir (62,7%) и 191Ir (37,3%). Перегруженная валентными торцевыми протонами система зарядов начинает упрощаться. Три 5d- протона иридия навсегда залегают в экваториальной не валентной ориентации.
Связанные с ними электроны повторяют их ориентацию. Эти три 5d+ электрона имеют спин одного знака с 6s+ электроном. При контактах они тормозятся об 6s+ электрон и не могут удержаться в валентном приполярном положении. Им энергетически более выгодно находиться на экваториальной не валентной орбите.
Предельную валентность иридию 6 обеспечивают два 6s три 5d+ электрона и один 5d- электрон.
78 Платина.
|
|
|
|
|
|
|
|||
|
Ядро изотопа платина 195Pt J = 1/2- макс. валентность 6 |
Развёртка протонной оболочки ядра Pt |
Электронная оболочка и эл. формула [Xe]4f145d96s1 атома платины валентность 6 |
Схема электронной оболочки атома платины валентность 6 |
78 Платина – Pt. Химический элемент с чётным зарядом имеет четыре стабильных изотопа, самый распространённый 195Pt (33,8%), 194Pt (32,9%), 196Pt (25,2%), 198Pt (7,19%) и два долгоживущих изотопа 190Pt (0,0127%), и 192Pt (0,78%). Суммарный ядерный спин J = 1/2- изотопа платина 195Pt указывает на отсутствие центрально осевого 6s протона на одном из торцов ядра.
Это вызывает нарушение в строении электронной оболочки платины, отсутствует один 6s электрон, и дополнительно вместо него появляется лишний 5d электрон. Из схемы строения электронной оболочки атома платины видно, что такое расположение электронов, на пятом энергетическом уровне, наиболее симметрично.
Предельную валентность платины 6 обеспечивает один 6s и пять 5d+ электронов.
79 Золото.
|
|
|
|
|
|
|
|||
|
Ядро изотопа золото 197Au J = 3/2+ макс. валентность 3 |
Развёртка протонной оболочки ядра Au |
Электронная оболочка и эл. формула [Xe]4f145d106s1 атома золота валентность 3 |
Схема электронной оболочки атома золота валентность 3 |
79 Золото – Au. Химический элемент с нечётным зарядом имеет только один стабильный изотоп 197Au. Суммарный ядерный спин J = 3/2+ изотопа платина золото 197Au указывает на отсутствие одного нейтрона на одном из торцов ядра.
Спектральный анализ показывает электронную формулу у золота [Xe]4f145d106s1, что указывает на отсутствие одного 5s электрона в электронной оболочке атома золота. Это один 5d+ электрон сталкивает 6s+ электрон с полярной осевой орбиты, так как оба электрона имеют положительный спин. Чтобы не конфликтовать и не тормозить друг друга 6s+ электрон занимает 5d+ орбиту.
Предельную валентность золота 3 обеспечивает один 6s- и два 5d+ электрона.
80 Ртуть.
|
|
|
|
|
|
|
|||
|
Ядро изотопа ртуть 202Hg J = 0+ макс. валентность 2 |
Развёртка протонной оболочки ядра Hg |
Электронная оболочка и эл. формула [Xe]4f145d106s2 атома ртути валентность 2 |
Схема электронной оболочки атома ртути валентность 2 |
80 Ртуть – Hg. Химический элемент с чётным зарядом имеет семь стабильных изотопов, самый распространённый 202Hg (29,8%), 196Hg (0,146%), 198Hg (10,02%), 199Hg (16,84%), 200Hg (23,13%), 201Hg (13,22%), 204Hg (6,85%). Одновременно заканчивается строительство двух нейтронных «гаек» слоёв-оболочек - шестнадцатой и семнадцатой. В валентных связях участвуют только два 6s торцевых протона. Максимальная валентность 2 обеспечивают два 6s электрона.
Но в особых условиях при температуре 4оК, полярные 6s электроны опускаются на более низкую 5s орбиту и появляется возможность возбудить глубоко лежащие 4f электроны, что приводит к возможности существования соединений ртути с экстремальной валентностью 4. Так, кроме малорастворимого Hg2F2 и разлагающегося водой HgF2 существует и HgF4, получаемый при взаимодействии атомов ртути и смеси неона и фтора при температуре 4оК.
Ртуть – диамагнетик, как инертные газы, графит ит.д. Диамагнетизм говорит о том, что электронная оболочка у ртути имеет аналогичное строение, как у инертных газов и графита. Видимо, валентные торцевые 6s протоны легко разворачиваются на бок, в экваториальное инертное положение. В результате 6s электроны не проявляют энтузиазма к участию в образовании кристаллической решетки, и при обычных условиях ртуть - жидкость.
|
|
|
|
Электронная оболочка атома ртути валентность 4 |
Развёртка протонной оболочки ядра Hg |
81 Таллий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа таллий 205Tl J = 1/2+ макс. валентность 3 |
Развёртка протонной оболочки ядра Tl |
Электронная оболочка и эл. формула [Xe]4f145d106s26p1 атома таллия валентность 3 |
Схема электронной оболочки атома таллия валентность 3 |
81 Таллий – Tl. Химический элемент с нечётным зарядом имеет два стабильных изотопа 205Tl (70,50%) и 203Tl (29,50%). С таллия начинают заполняться 6р вакантные места в торцевых «нейтронных гайках». Суммарный спин ядра J = 1/2+ говорит о том, что на одном торце ядра 6s протон не занимает центрально осевое положение, 6s и 6р протоны занимают оппозитное положение, и суммарный спин ядра определяется центрально осевым 6s протоном.
Предельную валентность таллия 3 обеспечивает два 6s и один 6р+ электрон.
82 Свинец.
|
|
|
|
|
|
|
|||
|
Ядро изотопа свинец 208Pb J = 0+ макс. валентность 4 |
Развёртка протонной оболочки ядра Pb |
Электронная оболочка и эл. формула [Xe]4f145d106s26p2 атома свинца валентность 4 |
Схема электронной оболочки атома свинца валентность 4 |
82 Свинец – Pb. Химический элемент с чётным зарядом имеет четыре стабильных изотопа, самый распространённый 208Pb (52,3%), 204Pb (1,48%), 206Pb (23,6%), 207Pb (22,6%). Второй 6р+ протон придаёт предельную валентность свинцу 4. На обоих торцах ядра «накручены» по две «нейтронные гайки». Это последний стабильный химический элемент, все последующие химические элементы не имеют стабильных изотопов.
Предельную валентность свинца 4 обеспечивают два 6s и два 6р+ электрона.
83 Висмут.
|
|
|
|
|
|
|
|||
|
Ядро изотопа висмут 209Bi J = 9/2- макс. валентность 5 |
Развёртка протонной оболочки ядра Bi |
Электронная оболочка и эл. формула [Xe]4f145d106s26p3 атома висмута валентность 5 |
Схема электронной оболочки атома висмута валентность 5 |
83 Висмут – Bi. Химический элемент с нечётным зарядом имеет только один долгоживущий изотоп 209Bi. Природный висмут состоит из одного изотопа 209Bi, который считался самым тяжёлым из существующих в природе стабильных изотопов. Однако в 2003 году было экспериментально доказано, что он является альфа-радиоактивным с периодом полураспада 1,9±0,2×1019 лет. Таким образом, все известные изотопы висмута радиоактивны. Силы кулоновского отталкивания у висмута достигли такого уровня, что «нейтронные гайки» на торцах ядра атома уже не способны бесконечно долго сохранять целостность атома. Суммарный спин ядра J = 5/2-3/2-1/2-=9/2- говорит о том, что на одном торце ядра 6s протон не занимает центрально осевое положение.
Предельную валентность висмута 5 обеспечивают два 6s и три 6р+ электрона.
84 Полоний.
|
|
|
|
|
|
|
|||
|
Ядро изотопа полоний 210Po J = 0+ макс. валентность 6 |
Развёртка протонной оболочки ядра Po |
Электронная оболочка и эл. формула [Xe]4f145d106s26p4 атома полония валентность 6 |
Схема электронной оболочки атома полония валентность 6 |
84 Полоний – Ро. Химический элемент с чётным зарядом полоний открывает ряд радиоактивных нестабильных химических элементов, не имеющих стабильных изотопов. Самый долгоживущий изотоп полония 210Ро имеет период полураспада 138,401 дней. При таком количестве протонов и их спиновой ориентацией природе не удалось создать стабильный изотоп полония. Хотя если разобраться, то полоний можно представить как набор из 14 замкнутых углеродных колец (14слоёв х 6протонов = 84протона). Четвертый 6р- протон придаёт предельную валентность полонию 6.
Предельную валентность полония 6 обеспечивают два 6s три 6р+ и один 6р- электрон.
85 Астат.
|
|
|
|
|
|
|
|||
|
Ядро изотопа астат 211At J = 9/2- макс. валентность 7 |
Развёртка протонной оболочки ядра At |
Электронная оболочка и эл. формула [Xe]4f145d106s26p5 атома астата валентность 7 |
Схема электронной оболочки атома астата валентность 7 |
85 Астат – At. Химический элемент с нечётным зарядом астат радиоактивен и вообще не имеет долгоживущих изотопов. Пятый 6р- протон придаёт предельную валентность астату 7. Суммарный спин изотопа астат 211At J = 9/2- говорит о его несбалансированном строении ядра.
Предельную валентность астата 7 обеспечивают два 6s три 6р+ и два 6р- электрона.
86 Радон.
|
|
|
|
|
|
|
|||
|
Ядро изотопа радон 222Rn J = 0+ валентность 0, 2, 4, 6, 8. |
Развёртка протонной оболочки ядра Rn |
Электронная оболочка и эл. формула [Xe]4f145d106s26p6 атома радона валентность 0, 2, 4, 6, 8. |
Схема электронной оболочки атома радона валентность 0, 2, 4, 6, 8. |
86 Радон – Rn. Химический элемент с чётным зарядом радон радиоактивен и не имеет долгоживущих изотопов. Период полураспада самого долгоживущего изотопа 222Rn 3,8229 дней. Суммарный спин изотопа 222Rn J = 0+ говорит о симметричном строении ядра. По своему строению ядра радон Rn очень похож на ядра атомов железа Fe, рутения Ru, хассия Hs. Все эти химические элементы способны принимать предельно возможную для химических элементов валентность 8.
Формально радон газ инертный, фактически весьма химически активен и может принимать валентность 0, 2, 4, 6, 8. см. рис. ниже.
|
Валентные формы электронной оболочки газа радона |
|
|
|
|
|
Валентность 0, два внесистемных 6s электрона лежат на экваториальной орбите |
|
|
|
|
|
валентность 2 |
валентность 4 |
|
|
|
|
валентность 6 |
валентность 8 |
Обычно до радона, при завершении строительства энергетической оболочки атома, полярные s электроны достраивали собой либо внутренний 1s электронный слой-орбиту, как у гелия, неона и аргона. Либо 3d и 4d электронный слой-орбиту как у криптона и ксенона. Появление 4f энергетического слоя-орбиты с 14 электронами путает природной самоорганизации все карты. Теперь 6s электроны не могут встраиваться в 5d электронный слой-орбиту, два вакантных места на этой 5d орбите заняты седьмыми и четырнадцатыми 4f электронами.
Для разрешения кризиса в согласовании строительства сатурнианской электронной оболочки и строительства столбчатого ядра все химические элементы от радона и далее получают по два 6s протонных слоя состоящих всего из одного протон и одиннадцати нейтронов!
А электронная оболочка от радона и далее приобретает два внешних внесистемных 6s электрона на новой пятой оси симметрии. Повторяется обратная ситуация когда первые три инертных газа гелий, неон и аргон строили свою «внутреннюю» 1s электронную оболочку. Теперь все 6s. 7s и 8s электроны у инертных газов радона, 118 инертного химического элемента и 120 последнего химического элемента будут достраивать «внешнюю» 6s электронную оболочку.
Из строения ядра видно, почему радон химически активен см. рис. Его торцовые полярные 6s протоны имеют спин противоположный спину торцовых 6p протонов. Это позволяет торцовым 6p протонам, в возбуждённом состоянии электронной оболочки, разворачиваться из экваториальной ориентации в полярную ориентацию.
|
6s |
n |
5d |
4f |
n |
4d |
n |
3d |
2p |
3s |
3p |
3d |
4p |
4d |
5p |
4f |
5d |
6p |
6s |
|
6p |
5d |
4f |
5p |
4d |
4p |
3d |
3p |
2s |
2p |
3d |
n |
4d |
n |
4f |
5d |
n |
||
|
n |
5d |
4f |
n |
5s |
n |
4s |
2p |
1s |
3p |
3d |
4p |
4d |
5p |
4f |
4f |
6p |
||
|
6p |
5d |
4f |
5p |
4d |
4p |
3d |
3p |
3s |
2p |
3d |
n |
4d |
n |
4f |
5d |
n |
||
|
n |
5d |
4f |
n |
4d |
n |
3d |
2p |
2s |
3p |
3d |
4p |
4d |
5p |
4f |
5d |
6p |
||
|
6p |
4f |
4f |
5p |
4d |
4p |
3d |
3p |
1s |
2p |
4s |
n |
5s |
n |
4f |
5d |
n |
||
|
Порядок заполнения протонной оболочки ядра атома радона |
||||||||||||||||||
87 Франций.
|
|
|
|
|
|
|
|||
|
Ядро изотопа франций 223Fr J = 3/2- макс. валентность 1 |
Развёртка протонной оболочки ядра Fr |
Электронная оболочка и эл. формула [Rn]7s1 атома франция валентность 1 |
Схема электронной оболочки атома франция валентность 1 |
87 Франций – Fr. Химический элемент с нечётным зарядом, самый долгоживущий изотоп 223Fr имеет период полураспада 22минуты. Первый валентный торцевой 7s протон появляется у франция. Суммарный спин ядра J = 3/2- говорит о не центрально осевом расположении 7s протона.
Предельную валентность франция 1 обеспечивает один 7s электрон.
88 Радий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа радий 226Ra J = 0+ макс. валентность 2 |
Развёртка протонной оболочки ядра Ra |
Электронная оболочка и эл. формула [Rn]7s2 атома радия валентность 2 |
Схема электронной оболочки атома радия валентность 2 |
88 Радий – Ra. Химический элемент с чётным зарядом самый долгоживущий изотоп 226Ra имеет период полураспада 1600 лет. Второй валентный 7s протон обеспечивает предельную валентность радия 2.
Предельную валентность радия 2 обеспечивается двумя 7s электронами.
|
|
|
Сечение электронной оболочки атома радия |
89 Актиний.
|
|
|
|
|
|
|
|||
|
Ядро изотопа актиний 227Ac J = 3/2- макс. валентность 3 |
Развёртка протонной оболочки ядра Ac |
Электронная оболочка и эл. формула [Rn]6d17s2 атома актиния валентность 3 |
Схема электронной оболочки атома актиния валентность 3 |
89 Актиний – Ас. Химический элемент с нечётным зарядом самый долгоживущий изотоп 227Ас имеет период полураспада 21,6 года. Суммарный спин J = 3/2- у ядра изотопа 227Ac указывает на не симметричное строение.
Актиний открывает вторую, после лантаноидов, группу химических элементов, у которых сначала строится электронная 5f оболочка. Но сначала вместо 5f электронов у первых шести актиноидов с №89 по №94 появляется 6d электрон. Почему?
Внимательно посмотрим на строение последней 6р электронной оболочки атома радона. На ней мы видим две оппозитные площадки, образованные четырьмя орбитами и сферами непроницаемости электронных облаков, 5d, f4, 6р, 7s. Каждое из двух 5d+ и 5d- электронных орбит окружает три электронных орбиты f4, 6р, 7s с противоположным знаком спина. Поэтому вновь появившееся 6d+ электронная орбита, как бильярдный шар в лузу, неизбежно садится на 5d+ электронное облако, где его нежно с трёх сторон фиксируют f4-, 6р-, 7s- электронными орбитами. Эта орбита настолько устойчива, что сохраняется у восьми электронных оболочек химических элементов содержащих 5f электроны (Ас, Тh, Ра, U, Np, Pu, Cm, Bk).
Если 6d+ электрон становится валентным, то он по квантованному радиусу 36R поднимается из экваториального инертного положения в приполярное валентное.
Предельную валентность актиния 3 обеспечивают два 7s и один 6d электрон.
90 Торий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа торий 232Th J = 0+ макс. валентность 4 |
Развёртка протонной оболочки ядра Th |
Электронная оболочка и эл. формула [Rn]6d27s2 атома тория валентность 4 |
Схема электронной оболочки атома тория валентность 4 |
90 Торий – Th. Химический элемент с чётным зарядом самый долгоживущий изотоп 232Th имеет период полураспада 1,39х1010 лет. Суммарный спин J =0+ говорит о симметричном строении ядра, что обеспечивает относительную устойчивость тория.
У тория появляется второй 6d+ электрон, который занимает вторую оппозитную площадку.
Предельную валентность тория 4 обеспечивают два 7s и два 6d электрона.
91 Протактиний.
|
|
|
|
|
|
|
|||
|
Ядро изотопа протактиний231Pa J = 3/2- макс. валентность 5 |
Развёртка протонной оболочки ядра Pa |
Электронная оболочка и эл. формула [Rn]5f26d17s2 атома протактиния валентность 5 |
Схема электронной оболочки атома протактиния валентность 5 |
91 Протактиний – Ра. Химический элемент с нечётным зарядом самый долгоживущий изотоп 231Ра имеет период полураспада 3,43х104 лет.
Наконец появилось сразу два 5f электрона, но исчез один 6d- электрон. Почему исчез один 6d- электрон?
Ещё раз внимательно посмотрим на строение последней 6р электронной оболочки атома радона. Можно ли построить сбалансированную оболочку из трёх электронных облаков, два из которых 6d. Нет! А из двух 5f+ электронов и одного 6d+ электрона легко! Получается равносторонний треугольник в экваториальной плоскости.
Предельную валентность протактиния 5 обеспечивают два 7s один 6d+ и два 5f+ электрона.
92 Уран.
|
|
|
|
|
|
|
|||
|
Ядро изотопа уран 238U J = 0+ макс. валентность 6 |
Развёртка протонной оболочки ядра U |
Электронная оболочка и эл. формула [Rn]5f36d17s2 атома урана валентность 6 |
Схема электронной оболочки атома урана валентность 6 |
92 Уран – U Химический элемент с чётным зарядом имеет три самых долгоживущих изотопа 238U (99,2739%), 235U (0,7205%), 234U (0,0056%). Суммарный спин J=0+ говорит о симметричном строении ядра, что обеспечивает относительную устойчивость урана. Начинается застройка 5f- протонами второго торца атома урана или двадцатого протонного слоя.
Все известные изотопы трансурановых элементов имеют период полураспада значительно меньший, чем возраст Земли. Поэтому известные трансурановые элементы практически отсутствуют в природе и получаются искусственно.
Элементы с Z > 92 в естественных условиях не обнаружены. Более тяжелые элементы, например, плутоний Pu94, могут нарабатываться в ядерных реакторах, однако элементы тяжелее фермия Fm100 можно получить только на ускорителях путем бомбардировок мишени тяжелыми ионами.
Одно 6d+ электронное облака и три 5f+ электронных облака образуют симметричный в экваториальной плоскости зарядовый четырёхугольник.
Предельную валентность урана 6 обеспечивают два 7s один 6d+ и три 5f+ электрона.
93 Нептуний.
|
|
|
|
|
|
|
|||
|
Ядро изотопа нептуний237Np J = 5/2+ макс. валентность 7 |
Развёртка протонной оболочки ядра Np |
Электронная оболочка и эл. формула [Rn]5f46d17s2 атома нептуния валентность 7 |
Схема электронной оболочки атома нептуния валентность 7 |
93 Нептуний – Np. Химический элемент с нечётным зарядом самый долгоживущий изотоп 237Np имеет период полураспада 2,2х106лет. Одно 6d+ электронное облако и четыре 5f+ электронных облака образуют в экваториальной плоскости зарядовый несимметричный пятиугольник.
Химические элементы от нептуния Np93 до лоуренсия Lr103. синтезируют в ядерных реакциях из урана или некоторых других тяжелых элементов. Поэтому более корректно считать, что эти элементы были получены, а не открыты. Все трансурановые элементы радиоактивны.
Химические свойства лёгких трансурановых актиноидов, получаемых в весовых количествах, изучены более или менее полно; трансфермиевые элементы (Md, No, Lr и так далее) изучены слабо в связи с трудностью получения и коротким временем жизни. Кристаллографические исследования, изучение спектров поглощения растворов солей, магнитных свойств ионов и других свойств показали, что элементы с п. н. 93—103 — аналоги лантаноидов.
Предельную валентность нептуния 7 обеспечивают два 7s один 6d+ и четыре 5f+ электрона.
94 Плутоний.
|
|
|
|
|
|
|
|||
|
Ядро изотопа плутоний240Pu J = 0+ макс. валентность 7 |
Развёртка протонной оболочки ядра Pu |
Электронная оболочка и эл. формула [Rn]5f56d17s2 атома плутония валентность 7 |
Схема электронной оболочки атома плутония валентность 7 |
94 Плутоний – Pu, Химический элемент с чётным зарядом плутоний из всех трансурановых элементов, нашел наибольшее применение. Изотоп плутония 239Pu применяется как взрывчатый компонент ядерного оружия и как топливо в ядерной энергетике.
Электронная. формула атома плутония [Rn]5f67s2 по другим источникам [Rn]5f56d17s2 Плутоний имеет валентности 3, 4, 5, 6, редко 2 и 7. Для восьмой валентной электронной оболочки, не согласованной по спинам, не находится места на полюсе и она падает на экватор. Где садится на 5d+ электронное облако, наиболее удобно расположенное. Так появляется симметричный зарядовый шестиугольник на экваториальной плоскости. Валентность 7 редкая т. к. нейтральное ядро получается несимметричным. Симметричное строение не валентного ядра обеспечивается при падении на экватор 2, 3, 4, 5f+ электронных оболочек. При этом возникают более частые валентные состояния плутония 6, 5, 4.
Тепло, производимое благодаря распаду ядер плутония и испусканию ими альфа-частиц, делает плутоний тёплым на ощупь. Тепловая мощность составляет 1,92 Вт/кг (теплота обмена веществ у взрослого человека составляет меньшую тепловую мощность).
Удельное сопротивление плутония при комнатной температуре очень велико для металла, 150 мкОм·см, и эта особенность усиливается с понижением температуры, что для металлов не свойственно. Эта тенденция продолжается вплоть до 100 K.
В отличие от большинства материалов плотность плутония увеличивается при нагревании в диапазоне температур от 310 до 480 °C до температуры плавления на 2,5 %, в то время как у обычных металлов наблюдается уменьшение плотности при повышении температуры.
Ближе к точке плавления жидкий плутоний имеет очень высокий показатель поверхностного натяжения и самую высокую вязкость среди других металлов. Температура кипения плутония в пять раз больше температуры плавления.
Предельную валентность плутония 7 обеспечивают два 7s один 6d+ и четыре 5f+ электрона.
95 Америций.
|
|
|
|
|
|
|
|||
|
Ядро изотопа америций243Am J = 5/2+ макс. валентность 3 |
Развёртка протонной оболочки ядра Am |
Электронная оболочка и эл. формула [Rn]5f77s2 атома америция валентность 3 |
Схема электронной оболочки атома америция валентность 3 |
95 Америций – Am. Химический элемент с нечётным зарядом изотоп 241Am с периодом полураспада 470 лет получается при интенсивной нейтронной бомбардировке плутония. Один 5f боковой протон в последнем слое-оболочке придаёт изотопу америция 243Am суммарный спин ядра J = 5/2+.
Америций используют во многих химических исследованиях. В настоящее время его получают в граммовых количествах. Америций светится в темноте.
В спектре америция отсутствует 6d электрон. Почему?
Шесть электронных орбит 5f+ рухнули с полюсов на экватор, пристыковавшись к шести 4f+ электронным оболочкам. В экваториальной плоскости образовалась очень симметричная шестиугольная зарядовая фигура, для зарядовой симметрии 6d электрон не нужен. Для седьмой 5f+ электронной оболочки не хватило места, и она сиротливо одинокая прилепилась к 7s+ электронной оболочке, обеспечивая америцию валентность 3.
Предельную валентность америция 3 обеспечивают два 7s и один 5f+ электрон.
96 Кюрий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа кюрий 246Cm J = 0+ валентность 4 |
Развёртка протонной оболочки ядра Cm |
Электронная оболочка и эл. формула [Rn]5f76d17s2 атома кюрия валентность 4 |
Схема электронной оболочки атома кюрия валентность 4 |
96 Кюрий – Cm. Химический элемент с чётным зарядом изотоп 242Cm (период полураспада 162,5 сут) и 244Cm (период полураспада 17,6 года) получаются и при нейтронной бомбардировке.
В спектре излучения кюрия опять появляется 6d электрон. Почему?
Потому что в экваториальной плоскости электронной оболочки только шесть вакантных мест для 5f+ электронов, и все они заняты. Седьмой 5f+ электрон прилепился к 7s+ электрону. Новый 6d+ электрон добавляет к стабильной валентности кюрия 3 переменную валентность 4, а базируется 6d+ электронное облако, в не валентном положении, как и положено ему, на 5d+ электронном облаке.
Предельную валентность кюрия 4 обеспечивают два 7s один 5f+ и один 6d+ электрон.
97 Берклий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа берклий 247Bk J = 3/2+ валентность 4 |
Развёртка протонной оболочки ядра Bk |
Электронная оболочка и эл. формула [Rn]5f86d17s2 атома берклия валентность 4 |
Схема электронной оболочки атома берклия валентность 4 |
97 Берклий – Bk Химический элемент с нечётным зарядом получается при бомбардировке 241Am ионами гелия. Изотоп 249Bk (период полураспада 314 сут) был выделен в весовых количествах. Элемент может быть получен при длительной бомбардировке плутония нейтронами.
В спектре берклия при разных условиях то обнаруживается, то пропадает 6d электрон. Вновь появляющийся 5f- протон образуют в 5f+ слое первую связанную пару 5f электронов. В случае пропадания 6d+ электрона, появившийся вместо него второй 5f- электрон, образует вторую связанную пару 5f электронов. Предельная валентность берклия 4. Недостающий 6-ой нейтрон на одном из торцов ядра придаёт изотопу берклия 247Bk суммарный спин ядра J = 3/2+.
Предельную валентность берклия 4 обеспечивают два 7s один 5f+ и один 6d+ электрон.
98 Калифорний.
|
|
|
|
|
|
|
|||
|
Ядро изотопа калифорний251Cf J = 1/2+ валентность 4 |
Развёртка протонной оболочки ядра Cf |
Электронная оболочка и эл. формула [Rn]5f107s2 атома калифорния валентность 4 |
Схема электронной оболочки атома калифорния валентность 4 |
98 Калифорний – Cf Химический элемент с чётным зарядом впервые получен при бомбардировке микрограммовых количеств кюрия 242Cm ионами гелия. Калифорний в виде смеси изотопов 249Cf, 250Cf, 251Cf, 252Cf выделен в весовых количествах после длительной нейтронной бомбардировки плутония.
В спектре калифорния 6d+ электрона уже нет. Второй 5f- протон образует вторую в 5f+ слое симметричную пару протонов с другого торца ядра атома. Нужды в 6d+ электроне уже нет. Электроны 5f- образуют две связанные инертные пары 5f электронов в плоскости экватора электронной оболочки. У калифорния, десятый 5f- электрон находится на полярной валентной орбите, а восьмой и десятый 5f- электрон занимает нейтральную экваториальную 5f орбиту.
Два валентных 5f электронов и два 7s электрона обеспечивает предельную валентность калифорния 4.
99 Эйнштейний.
|
|
|
|
|
|
|
|||
|
Ядро изотопа энштейний252Es J = (5-) макс. валентность 4 |
Развёртка протонной оболочки ядра Es |
Электронная оболочка и эл. формула [Rn]5f117s2 атома энштейния валентность 4 |
Схема электронной оболочки атома энштейния валентность 4 |
99 Эйнштейний – Es. Химический элемент с нечётным зарядом наиболее долгоживущий изотоп 252Es имеет период полураспада 471,7 суток. Весь имеющийся запас эйнштейния Es99, полученный путем облучения в ядерных реакторах к 1995 г., составлял около 10-12г.
На противоположных торцах ядра изотоп эйнштейния 252Es имеет два не сбалансированных протона каждый со спином J = 5/2+ . Суммарно это придаёт изотопу энштейния 252Es суммарный ядерный спин J = 5+. Электронная оболочка содержит три пары 5f+ электронов. Всего в экваториальной оболочке девять инертных 5f электронов.
Два 5f электрона валентных, прилепившихся к двум полярным 7s электронам, на полюсах атома обеспечивают предельную валентность эйнштейния 4.
100 Фермий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа фермий 256Fm J = 0+ макс. валентность 3 |
Развёртка протонной оболочки ядра Fm |
Электронная оболочка и эл. формула [Rn]5f127s2 атома фермия валентность 3 |
Схема электронной оболочки атома фермия валентность 3 |
100 Фермий – Fm. Химический элемент с чётным зарядом самым долгоживущим изотопом фермия является 257Fm (период полураспада около 80 суток).
Сразу два 5f- протона залегают на экваториальных орбитах, оставляя только один 5f- валентный протон, обеспечивая фермию предельную валентность 3. На одном торце ядра атома сформировался протонный слой, отделённый от радонового ядра нейтронной разгрузочной прокладкой. На втором торце ядра остаётся только один не связанный парой валентный протон 5f-.
Во внешней электронной оболочке осталась только одна вакансия для 5f- электрона. Предельную валентность фермия 3 обеспечивают два 7s и один 5f+ электрон.
101 Менделевий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа менделевий258Md J = 3/2- макс. валентность 3 |
Развёртка протонной оболочки ядра Md |
Электронная оболочка и эл. формула [Rn]5f137s2 атома менделевия валентность 3 |
Схема электронной оболочки атома менделевия валентность 3 |
101 Менделевий – Md. Химический элемент с нечётным зарядом изотоп 258Md был получен в 1967 при бомбардировке ничтожных количеств 253Es ионами гелия в 152-сантиметровом циклотроне в Беркли. Первая идентификация элемента была удивительна, так как в опытах было получено всего 1 или 2 атома элемента. Оказалось, что он имеет исключительно большой период полураспада - 2 месяца.
Элементы до фермия включительно образуются в ядерных реакторах в результате захвата нейтронов и последующего бета-распада.. Трансфермиевые химические элементы, начиная с менделевия 101Md, образуются только в результате слияния ядер.
В ядре сформировался второй протонный слой, отделённый от радонового ядра второй нейтронной разгрузочной прокладкой. Во внешней электронной оболочке не осталось больше вакансий для 5f- электронов. Она состоит из шести связанных пар 5f электронов.
Не связанный тринадцатый 5f+ электрон и два 7s электрона обеспечивают предельную валентность менделевия 3.
102 Нобелий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа нобелий 259No J = 2- макс. валентность 3 |
Развёртка протонной оболочки ядра No |
Электронная оболочка и эл. формула [Rn]5f147s2 атома нобелия валентность 3 |
Схема электронной оболочки атома нобелия валентность 3 |
102 Нобелий – No Химический элемент с чётным зарядом получают как в реакции 242Pu + 18O, так и в реакции 208Pb + 48Ca. В линейном ускорителе тяжелых ионов (Калифорнийский университет в Беркли) был получен изотоп с массовым числом 254No и периодом полураспада 55 сек.
Аналог иттербия имеет предельную валентность 3. Внешняя электронная оболочка состоит из шести связанных пар 5f электронов и двух 5f электронов, прилепившихся оппозитно на приполярных орбитах. В дальнейшем, у Коперниция они дополнят 6d электронную оболочку.
Появление четырнадцатого 5f- электрона на полярной оси не делает нобелий четырёх валентным. Наоборот дополнительная электромагнитная связь между приполярными 5f+ и 5f- электронами делает эти электроны менее подвижными. Они не склонны вступать в электромагнитные химические связи. Поэтому нобелий в основном двухвалентный и очень редко проявляет трёхвалентное состояние.
103 Лоуренсий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа лоуренсий 264Lr J = 0+ макс. валентность 3 |
Развёртка протонной оболочки ядра Lr |
Электронная оболочка и эл. формула [Rn]5f146d17s2 атома лоуренсия валентность 3 |
Схема электронной оболочки атома лоуренсия валентность 3 |
103 Лоуренсий – Lr. Химический элемент с нечётным зарядом был получен бомбардировкой калифорния ионами бора в линейном ускорителе тяжелых ионов в Беркли. Полученный изотоп (либо 258Lr, либо 259Lr) имел период полураспада 8 с. Это завершающий элемент ряда актиноидов. Начинается заполнение двенадцати вакантных мест десятью 6d электронами и двумя 5f электронами (у Коперниция они перейдут в разряд 6d электронов). Первый 6d- протон и связанный с ним электрон располагается со стороны 7s+ протона.
Предельную валентность лоуренсия 3 обеспечивают два 7s и один 6d+ электрон.
104 Резерфордий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа резерфордий265Rf J = 3/2- макс. валентность 4 |
Развёртка протонной оболочки ядра Rf |
Электронная оболочка и эл. формула [Rn]5f146d27s2 атома резерфордия валентность 4 |
Схема электронной оболочки атома резерфордия валентность 4 |
104 Резерфордий – Rf Химический элемент с чётным зарядом был синтезирован по ядерной реакции
24294Pu + 2210Ne = 259104 Rf + 510n.
Период полураспада двух наиболее стабильных из известных изотопов составляет около 10 и 13 часов (266Rf и 265Rf соответственно). Синтезировано более 10 нуклидов резерфордия с массовыми числами 253—262 Резерфордий — первый трансактиноидный элемент, его предсказанные химические свойства близки к гафнию. Появился второй 6d- протон с на одном торце ядра атома резерфордия.
Предельную валентность резерфордия 4 обеспечивают два 7s и два 6d+ электрона.
105 Дубний
|
|
|
|
|
|
|
|||
|
Ядро изотопа дубний 268Db J = 1/2- макс. валентность 5 |
Развёртка протонной оболочки ядра Db |
Электронная оболочка и эл. формула [Rn]5f146d37s2 атома дубний валентность 5 |
Схема электронной оболочки атома дубний валентность 5 |
105 Дубний – Db Химический элемент с нечётным зарядом был синтезирован путём бомбардировки ядер 243Am ионами 22Ne и в реакции 249Cf+15N→260Db+4n
У дубния появился третий 6d- протон, больше вакантных мест с этой стороны торца ядра атома для 6d- протонов нет.
Предельную валентность дубния 5 обеспечивают два 7s и три 6d+ электрона.
106 Сиборгий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа сиборгий272Sg J = 0+ макс. валентность 6 |
Развёртка протонной оболочки ядра Sg |
Электронная оболочка и эл. формула [Rn]5f146d47s2 атома сиборгия валентность 6 |
Схема электронной оболочки атома сиборгия валентность 6 |
106 Сиборгий – Sg Химический элемент с чётным зарядом был синтезирован путём бомбардировки ядер 249C ионами 18O. Наиболее устойчивый изотоп 265Sg имеет период полураспада 21 с.
У сиборгия появился четвёртый 6d- протон с противоположного торца ядра атома. Предельная валентность сиборгия 6. Предполагают, что сиборгий должен быть аналогом вольфрама и молибдена и его высший фторид SgF6 будет летуч.
Продвижение в область элементов тяжелее 106 стало возможным после открытия т.н. реакций «холодного слияния». В этих реакциях в качестве мишенного материала используются "магические" ядра стабильных изотопов - 208РЬ (Z=82, N=126) или 209Bi (Z=83, N=126), которые бомбардируются ионами тяжелее аргона. В процессе слияния высокая энергия связи нуклонов в "магическом" ядре-мишени приводит к поглощению энергии при перестройке двух взаимодействующих ядер в тяжёлое ядро суммарной массы, реакция 249Cf+18O→263106+4n.
Предельную валентность сиборгия 6 обеспечивают два 7s и четыре 6d+ электрона.
107 Борий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа борий 273Bh J=0+ макс. валентность 7 |
Развёртка протонной оболочки ядра Bh |
Электронная оболочка и эл. формула [Rn]5f146d57s2 атома бория валентность 7 |
Схема электронной оболочки атома бория валентность 7 |
107 Борий – Bh Химический элемент с нечётным зарядом был синтезирован в результате реакции «холодного» слияния ядер 209Bi и 54Cr. Существуют нуклиды бория с массовыми числами 261Bh (период полураспада Т1/2 11,8 мкс) и 262Bh (период полураспада менее 1 мс). У бория появился пятый 6d- протон. В заметных количествах Bh не получен, поэтому его свойства не изучены. Вероятно борий по химическим свойствам похож на рений.
Предельную валентность бория 7 обеспечивают два 7s и пять 6d+ электрона.
108 Хассий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа хассий 274Hs J = 0+ макс. валентность 8 |
Развёртка протонной оболочки ядра Hs |
Электронная оболочка и эл. формула [Rn]5f146d67s2 атома хассия валентность 8 |
Схема электронной оболочки атома хассия валентность 8 |
108 Хассий – Hs Химический элемент с чётным зарядом был синтезирован в результате бомбардировки свинцовой (208Pb) мишени пучком ионов 58Fe. В результате эксперимента были синтезированы 3 ядра 265Hs. Наиболее долгоживущий нуклид 265Hs (период полураспада 0,002 с). У хассия появился шестой 6d+ протон, он имеет противоположный J (-) спин.
Предельную валентность 8 (как у осмия, рутения, железа) обеспечивает 6d- электрон, он заменяет собой 7s+ электрон. Находясь в центре, на оси вращения электронной оболочки, 6d- электрон окружен двумя 6d+ электронами и 7s+ электроном, в такой позиции электроны не тормозят вращение друг друга. Но обычно хассий проявляет валентность 6, потому, что парочка валентных протонов, 6d+ протон и 6d- протон, «залегают на бок» и их электроны из приполярной орбиты опускаются, залегают на экваториальных орбитах и становятся химически инертными
Предельную валентность хассия 8 обеспечивают два 7s пять 6d+ и один 6d- электрон.
109 Мейтнерий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа мейтнерий273Mt J = 2/3- макс. валентность 5 |
Развёртка протонной оболочки ядра Mt |
Электронная оболочка и эл. формула [Rn]5f146d77s2 атома мейтнерия валентность 5 |
Схема электронной оболочки атома мейтнерия валентность 5 |
109 Мейтнерий – Mt Химический элемент с нечётным зарядом был синтезирован в результате реакции 209Bi+58Fe → 266Mt+n, при облучении мишени из 209Bi ускоренными до больших скоростей ионами 58Fe. По продукту a-распада 262Bh идентифицировано три атома мейтнерия.
У мейтнерия появился седьмой 6d- протон и сразу две пары 6d протонов «залегают на бок» и их электроны, упав на экватор электронного облака, становятся инертными.
Предельную валентность 5, как у кобальта, мейтнерию обеспечивают оставшиеся на торцах четыре 6d+ и два 7s электрона.
110. Дармштадтий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа дармштадий278Ds J = 0+ макс. валентность 6 |
Развёртка протонной оболочки ядра Ds |
Электронная оболочка и эл. формула [Rn] 5f146d97s1 атома дармштадия валентность 6 |
Схема электронной оболочки атома дармштадия валентность 6 |
110. Дармштадтий – Ds Химический элемент с чётным зарядом был синтезирован в результате ядерных реакций 59Co + 209Bi = 267Ds + n, а также в результате α-распада изотопов коперниция 283Cn и 285Cn. Получено всего несколько атомов элемента. 267Ds. По оценке, время жизни ядер 267Ds около 1 микросекунды. Немного более устойчивые ядра элемента 269Ds ядер и 273Ds.
У дармштадтия появился восьмой 6d+ протон. И как все благородные металлы в этой группе, у него вероятно будут обнаружены нарушения в строении электронной оболочки, вместо [Rn]5f146d87s2 по теории, мы на практике должны увидеть [Rn]5f146d97s1.
Почему?
Если взглянуть на рисунок строения ядра изотопа 278Ds, то мы можем заметить на одном из торцов ядра два протона с противоположным спином. Это 7s- протон и 6d- протон. Это отражается на строении внешней электронной оболочки. У 7s+ и 6d+ электронов облака имеют очень близкие размеры и энергии. Они конкурируют между собой за экваториальную центрально осевую позицию.
Предельную валентность дармштадтия 6 обеспечивают один 7s и пять 6d+ электрон.
111 Рентгений.
|
|
|
|
|
|
|
|||
|
Ядро изотопа рентгений283Rg J = 3/2- макс. валентность 3 |
Развёртка протонной оболочки ядра Rg |
Электронная оболочка и эл. формула [Rn] 5f146d107s1 атома рентгения валентность 3 |
Схема электронной оболочки атома рентгения валентность 3 |
111 Рентгений – Rg Химический элемент с нечётным зарядом благородный металл, химический аналог меди, серебра и золота. Синтезирован в результате реакции 209Bi + 64Ni = 272Rg + n. Рентгений272Rg изотоп с периодом полураспада всего 1,5 мс, по другим ядерным реакциям были получены изотопы 279Rg (период полураспада 170 мс) и 280Rg (3,6 с). Все изотопы рентгения распадаются с выделением альфа-частицы. Наиболее долгоживущий изотоп имеет атомную массу 281 и период полураспада ≈20 секунд. Так как активность благородных металлов снижается с ростом порядкового номера, то предполагается, что рентгений ещё менее активен чем золото, и таким образом, является самым химически инертным металлом. Плотность рентгения может быть чрезвычайно высокой — он может быть существенно тяжелее, чем осмий.
У рентгения появился девятый 6d+ протон, и сразу две пары протонов с противоположным спином ориентируются на экватор и перестают быть валентными. Это понижает предельную валентность рентгения до 3. У рентгения появление девятого 6d+ протона вызывает достройку одного торцового протонного слоя.
Рентгений последний благородный металл, и как у всех благородных металлов в побочной группе, он, предположительно, имеет нарушение в порядке заполнения электронной оболочки. Вместо. теоретически [Rn]5f146d97s2 мы, предположительно, увидим [Rn] 5f146d107s1.
Почему? Если взглянуть на рисунок строения ядра изотопа рентгения 283Rg, то мы можем заметить на одном из торцов ядра два протона с одинаковым спином. Это 7s- протон и 6d- протон. Это отражается на строении внешней электронной оболочки. У 7s+ и 6d+ электронов облака имеют очень близкие размеры и энергии. Они конкурируют между собой за полярную центрально осевую позицию. И 6d+ электрон сталкивает 7s+ электрон с полярной осевой орбиты, так как оба электрона имеют положительный спин. Чтобы не конфликтовать и не тормозить друг друга 7s+ электрон занимает 6d+ орбиту.
Предельную валентность рентгения 3 обеспечивают один 7s- и два 6d+ электрона.
112 Коперниций.
|
|
|
|
|
|
|
|||
|
Ядро изотопа коперниций284Cn J = 0+ макс. валентность 2 |
Развёртка протонной оболочки ядра Cn |
Электронная оболочка и эл. формула [Rn]5f146d107s2 атома коперниция макс. валентность 2 |
Схема электронной оболочки атома коперниция валентность 2 |
112 Коперниций – Cn. Химический элемент с чётным зарядом. Два ядра 277Cn были получены путём реакций ускоренных атомных ядер цинка 70Zn на мишени из свинца 208Pb в ускорителе тяжёлых ионов.
У коперниция появился последний десятый 6d+ протон, он в паре с 5f- протоном с противоположным спином достраивает второй торцовый протонный слой. Оставшиеся два 7s протона обеспечивает предельную валентность коперниция 2.
У коперниция, как и у ртути, появляется возможность, при температуре близкой к абсолютному нулю возбудить устойчивую 5f электронную оболочку, что приводит к возможности существования соединений коперниция c валентностью 4. При очень низкой температуре два полярных валентных 7s электрона могут опускаться на 5f энергетический уровень. При этом два 5f электрона на полярных орбитах так же могут стать валентными.
Седьмому электронному слою недостаёт только шести 7р электронов до полной достройки 7 электронной оболочки. Два бывших полярных 5f электрона связанны с 6d электронами и залегают на экваториальных не валентных орбитах.
Предельную валентность коперниция 2 обеспечивают два 7s электрона.
|
|
|
|
Электронная оболочка коперниция Cn в четырёх валентном состоянии. |
Развёртка протонной оболочки ядра Cn валентность 4 |
113 Унунтрий (Японий).
|
|
|
|
|
|
|
|||
|
Ядро изотопа унунтрий287Uut J = 1/2+ макс. валентность 3 |
Развёртка протонной оболочки ядра Uut |
Электронная оболочка и эл. формула [Rn]5f146d107s27р1 атома унунтрия макс. валентность 3 |
Схема электронной оболочки атома унунтрия валентность 3 |
113 Унунтрий – Uut Химический элемент с нечётным зарядом имеет временное систематическое название унунтрий. В результате бомбардировки мишени из америция ионами кальция были синтезированы изотопы унунпентия Uup: три ядра 288Uup и одно ядро 287Uup. Все четыре ядра в результате α-распада превратились в изотопы унунтрия (284Uut и 283Uut). Металл, аналог таллия.
У унунтрия первый 7р- протон появляется со стороны 7s+ протона и добавляет унунтрию валентность 3.
Предельную валентность унунтрия 3 обеспечивают два 7s и один 7р электрон.
114 Флеровий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа флеровий 289Uug J = 7/2+ макс. валентность 4 |
Развёртка протонной оболочки ядра Uug |
Электронная оболочка и эл. формула [Rn]5f146d107s27р2 атома флеровия макс. валентность 4 |
Схема электронной оболочки атома флеровия валентность 4 |
114 Флеровий – Fl Химический элемент с чётным зарядом был получен бомбардировкой ядер кюрия Cm ядрами кальция Са, что приводило к образованию элемента №116 ливермория Lv, который в результате быстрого α-распада превращался во флеровий 286Fl. Флеровий 286Fl также был получен и альтернативным способом - бомбардировкой плутония ядрами кальция. Получено было только около трех атомов флеровия 286Fl
244Pu + 48Ca ![]() 289Fl + 31n
289Fl + 31n
244Pu + 48Ca ![]() 288Fl + 41n
288Fl + 41n
Элемент распадается, испуская -частицы, и превращается в коперниций Cn. Период полураспада составляет около 30 секунд для 289F и 2-х секунд для 288F .
Два 7р+ электрона и два 7s электрона обеспечивает флеровию предельную валентность 4.
115 Унунпентий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа унунпентий 91Uup J = 0+ макс. валентность 5 |
Развёртка протонной оболочки ядра Uup |
Электронная оболочка и эл. формула [Rn]5f146d107s27р3 атома унунпентия валентность 5 |
Схема электронной оболочки атома унунпентия валентность 5 |
115 Унунпентий – Uup Химический элемент с нечётным зарядом имеет временное систематическое название унунпентий. Унунпентий был получен бомбардировкой мишени из америция Am ионами кальция Ca. Были синтезированы изотопы: три ядра 288Uup и одно ядро 287Uup.
243Am + 48Ca => 288Uup + 3n;
243Am + 48Ca => 287Uup + 4n;
Наиболее стабильным является изотоп 288Uup (период полураспада оценивается в 87 мс).
Третий 7р+ электрон унунпентия заполняет все вакантные места вокруг 7s- электрон. Электронные 7р+ облака образуют в экваториальной плоскости равносторонний треугольник.
Предельную валентность унунпентия 5 обеспечивают два 7s и три 7р электрона.
116 Ливерморий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа ливерморий293Lv J = 1- макс. валентность 6 |
Развёртка протонной оболочки ядра Uuh |
Электронная оболочка и эл. формула [Rn]5f146d107s27р4 атома ливермория валентность 6 |
Схема электронной оболочки атома ливермория валентность 6 |
116 Ливерморий – Lv. Химический элемент с чётным зарядом ливерморий. 292Lv был получен в результате бомбардировки мишени из кюрия Cm ионами кальция Са.
Четвёртый 7р- электрон с противоположным спином появляется у ливермория со стороны 7s+ электрона.
Предельную валентность ливермория 6 обеспечивают два 7s и четыре 7р электрона.
117 Унунсептий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа унунсептий 292Uus J = 0+ валентность 7 |
Развёртка протонной оболочки ядра Uus |
Электронная оболочка и эл. формула [Rn]5f146d107s27р5 атома унунсептий валентность 7 |
Схема электронной оболочки атома унунсептий валентность 7 |
117 Унунсептий – Uus Химический элемент с нечётным зарядом имеет временное систематическое название унунсептий. Унунсептий был синтезирован бомбардировкой мишени из берклия 249Bk ионами кальция 48Са. В результате было зафиксировано шесть ядер нового элемента — пять 293Uus и одно 294Uus.
Пятый 7р- электрон у унунсептий появляется со стороны 7s+ электрона. Последний среди химических элементов галоген.
Предельную валентность унунсептий 7 обеспечивают два 7s и пять 7р электрона.
118 Унуноктиум.
|
|
|
|
|
|
|
|||
|
Ядро изотопа унуноктиум 294Uuc J = 0+ валентность 8. |
Развёртка протонной оболочки ядра Uuc |
Электронная оболочка и эл. формула [Rn]5f146d107s27р6 атома унуноктиум валентность 0, 2, 4, 6, 8. |
Схема эл. оболочки атома унуноктиум валентность 0, 2, 4, 6, 8. |
118 Унуноктиум – Uuo Химический элемент с чётным зарядом имеет временное систематическое название унуноктиум. Унуноктиум последний в природе формально инертный газ.
Шестой 7р протон заканчивает строительство второго торцевого 7р слоя-оболочки. Этот слой располагается с одного из торцов ядра атома. В отличии от радона, радиоактивный распад унуноктиума идёт почти мгновенно. Период полураспада изотопа унуноктиума 294Uuc 1,8мс! Миллисекунда - это одна тысячная секунды.
По своему строению ядра унуноктиум Uuc очень похож на строение ядра атомов железа Fe, рутения Ru, хассия Hs, Хе и радона Rn. Все эти химические элементы способны принимать предельно возможную для химических элементов валентность 8.
В отличии от радона в ядре унуноктиума не полный комплект нейтронов на торцевых 7р слоях-оболочках На это указывает слишком малый атомный вес изотопа унуноктиум 294Uuc. Для того чтобы 7s протоны гарантированно занимали центрально осевое положение не хватает двух нейтронов. Но более устойчивый изотоп унуноктиум 296Uuc с центрально осевым положением 7s протонов пока ещё не синтезирован.
Строение внешней электронной оболочки унуноктиума повторяет строение электронной оболочки радона. Последними, с полярной валентной орбиты, на инертную экваториальную орбиту падают 7s электроны. Им нет места на недостроенных 6d электронных орбитах, уже занятых двумя 5f электронами, и они вынуждены пристраиваться рядом с 7р и 6d электронными орбитами. Они образуют новую шестую ось симметрии с парой 7s электронных орбит с уже таким же образом стоящими 6s электронными орбитами на пятой оси симметрии. Эти 7s электронные облака легко переходят в возбуждённое состояние и становятся валентными. А за ними, при дальнейшем возбуждении, поочерёдно подтягиваются ещё три пары 7р электронов.
Формально унуноктиум Uuc газ инертный, фактически весьма химически активен и может принимать валентность 0, 2, 4, 6, 8. см. рис. ниже.
|
|
|
|
Валентность 2 |
Валентность 4 |
|
|
|
|
Валентность 6 |
Валентность 8 |
|
7s |
|
6d |
5f |
n |
n |
5d |
4f |
n |
4d |
n |
3d |
2p |
3s |
3p |
3d |
4p |
4d |
5p |
4f |
5d |
6p |
n |
5f |
6d |
7p |
7s |
|
7p |
6d |
5f |
n |
6p |
5d |
4f |
5p |
4d |
4p |
3d |
3p |
2s |
2p |
3d |
n |
4d |
n |
4f |
5d |
n |
n |
5f |
6d |
|
||
|
|
6d |
5f |
6s |
n |
5d |
4f |
n |
5s |
n |
4s |
2p |
1s |
3p |
3d |
4p |
4d |
5p |
4f |
4f |
6p |
n |
5f |
5f |
7p |
||
|
7p |
6d |
5f |
n |
6p |
5d |
4f |
5p |
4d |
4p |
3d |
3p |
3s |
2p |
3d |
n |
4d |
n |
4f |
5d |
n |
n |
5f |
6d |
|
||
|
|
6d |
5f |
n |
n |
5d |
4f |
n |
4d |
n |
3d |
2p |
2s |
3p |
3d |
4p |
4d |
5p |
4f |
5d |
6p |
n |
5f |
6d |
7p |
||
|
7p |
5f |
5f |
n |
6p |
4f |
4f |
5p |
4d |
4p |
3d |
3p |
1s |
2p |
4s |
n |
5s |
n |
4f |
5d |
n |
6s |
5f |
6d |
|
119. Унуне́нниум.
|
|
|
|
|
|
|
|||
|
Ядро изотопа унуне́нниум 319Uue J = 3/2- валентность 1 |
Развёртка протонной оболочки ядра Uue |
Электронная оболочка и эл. формула [Uuc]8s1 атома унуне́нниума валентность 1 |
Схема электронной оболочки атома унуне́нниума валентность 1 |
119. Унуне́нниум – Uue Химический элемент с нечётным зарядом имеет временное название, от лат. Ununnenium или эка-франций с атомным номером 119. Название «унуненний» используется как временное в научных статьях о поиске элемента 119. Предпоследний химический элемент. Появляется первый 8s- протон на одном из торцов ядра атома. Проявляет свойства щелочного металла.
Для получения относительно стабильного изотопа унуне́нниума 319U нужно синтезировать изотоп с прогнозированной атомной массой 319 а.е. J = 3/2- с минимально возможным набором нейтронов. Попытка синтеза элемента 119Uue предпринималась в 1985 году при помощи бомбардировки мишени из эйнштейния 254Еs ядрами кальция 48Са на ускорителе SuperHILAC в Беркли, Калифорния. Попытка окончилась неудачей, не было идентифицировано ни одного атома унуне́нниума.
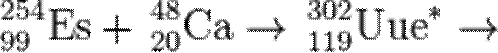 (ни
одного атома не было получено)
(ни
одного атома не было получено)
Крайне маловероятно, что эта реакция будет полезной. Для синтеза жизнеспособного изотопа унуне́нниума нехватает как минимум 17 нейтронов. Для столбчатого ядра атома унуне́нниума нужно создать два устойчивых торцевых 7s слоя-оболочки, как у долгоживущего изотопа франция 223Fr имеющего период полураспада 22 минуты. Для построения этих двух торцевых 6s слоёв-оболочек у изотопа франция 223Fr используется по 9 нуклонов, один протон и 8 нейтронов с каждого торца ядра.
Для увеличения чувствительности эксперимента до требуемого уровня необходимо сделать достаточно большую мишень из 254Es, что является экстремально сложной задачей. В 2013 году российские учёные из ОИЯИ планируют начать опыты по синтезу 119-ого элемента.
Предельную валентность унуне́нниума 1 обеспечивает один 8s электрон.
120 Унбинилий.
|
|
|
|
|
|
|
|||
|
Ядро изотопа унбинилий320Uub J = 0+ макс. валентность 2 |
Развёртка протонной оболочки ядра Uub |
Электронная оболочка и эл. формула [Uuc]8s2 атома унбинилия валентность 2 |
Схема электронной оболочки атомаунбинилия валентность 2 |
120 Унбинилий – Uub. Последний в природе химический элемент с чётным зарядом У него появляется второй 8s+ протон на втором торце ядра атома. Время полураспада ничтожно мало, поэтому унбинилий, до сих пор не синтезирован.
Проявляет свойства щелочноземельного металла. Но при определённых условиях унбинилий должен проявлять инертные свойства как у ртути. Пара 8s электронных орбит могут образовывать новую седьмую ось симметрии в электронной оболочке атома, как 6s и 7s электронные пары
Предельную валентность унуне́нниума 2 обеспечивают два 8s электрона.
|
|
|
Сечение электронной оболочки 120 химического элемента Унбинилий Uub |
3.Закономерности в строении атомных
ядер и электронных оболочек
120 химических элементов
Природа стремится к симметрии, атомное ядро и его электронная оболочка, в основном (не в возбуждённом) состоянии, стремятся к зарядовой симметрии. Рассмотрим, как зарядовая симметрия реализуется на практике при строительстве электронной оболочки атомов
На одной оси X можно разместить не более двух 1s электронов противоположной магнитной полярности как у гелия.
Появление третьего и четвёртого 2s электрона противоположной магнитной полярности требуют появления второй Y оси симметрии как у лития и бериллия.
Пятые и шестые 2р электроны противоположной магнитной полярности требуют появления третьей Z оси симметрии как у бора и углерода. При шести электронах возможны два варианта симметричного размещения электронов на плоскости как у графита и на сфере как у алмаза.
На плоскости, как на вогнутой полусфере симметрично можно разместить не более 6 электронов противоположной магнитной полярности.
Седьмые и восьмые 2р электроны противоположной магнитной полярности требуют появления четвёртой О оси симметрии как у азота и кислорода. При восьми электронах их можно симметрично разместить на одном расстоянии от центра симметрии только на сферической поверхности как у кислорода.
Размещение пятой стационарной (неподвижной) оси симметрии в пространстве проблематично. Поэтому появление девятого и десятого 2р электронов у фтора и неона вызывает образование у атомов второго слоя симметрии. Электроны у фтора и неона начинают выстраиваться цугом по осям симметрии, заполняя второй слой или энергетический уровень атома.
С дальнейшим прибавлением 3s электронов с 11 электрона у натрия по 18 электрон у аргона заполняется третий слой или энергетический уровень атома. Первые три слоя 3р 2р и ns электроны выстраиваться цугом по трём осям симметрии образуют на плоскости устойчивую симметричную электронную оболочку инертного газа аргона
С ростом количества электронов растёт количество слоёв (энергетических уровней).
Девятнадцатый и двадцатый 4s электроны у калия и кальция вызывают образование четвёртого энергетического слоя. Эти электроны занимают симметричное полярное равноудалённое положение на оси вращения над плоскостью аргонного остова.
Но при дальнейшем строительстве четвёртого слоя электронный цуг становится неустойчивым, и четвёртые электроны цуга постоянно сваливаются в щель между электронными цугами.
Эти электроны, постоянно сваливающиеся в щель между цугами на более низкий третий энергетический уровень, называются 3d электронами. У 3d электронов нет своей статической оси симметрии, они вынуждены постоянно вращаются вокруг 3р электронов.
Так природа «выкручивается» из затруднительного положения и создаёт новый вид симметрии «динамической симметрии». Для динамической балансировки третьей электронной оболочки вокруг каждого 3р электрона вращается по два электрона всего двенадцать электронов. Из этих 12 электронов десять 3d электронов и два 4s электрона. Последние два 4s электрона «падают» на 3d орбиты у атома криптона.
Только после того, как «фундамент» электронных цугов укреплён динамичными 3d электронами, появляются шесть статичных 4р электронов с 31 галлия по 36 криптона.
Тридцать седьмой и тридцать восьмой 5s электроны у рубидия и стронция вызывают образование пятого энергетического слоя. Эти электроны занимают симметричное полярное равноудалённое положение на оси вращения над плоскостью криптонового остова.
Но при дальнейшем строительстве пятого слоя электронный цуг становится неустойчивым, и электроны пятого слоя цуга постоянно сваливаются в щель между четвёртыми электронами цугов.
Эти электроны, постоянно сваливающиеся в щель между цугами на более низкий четвёртый энергетический уровень, называются 4d электронами. У 4d электронов нет своей статической оси симметрии, они вынуждены постоянно вращаются вокруг 4р электронов.
Для динамической балансировки четвёртой электронной оболочки вокруг каждого 4р электрона вращается по два электрона всего двенадцать электронов. Из этих 12 электронов десять 4d электронов и два 5s электрона. Последние два 5s электрона «падают» на 4d орбиты у атома ксенона.
Только после того, как «фундамент» электронных цугов укреплён динамичными 4d электронами, появляются шесть статичных 5р электронов с 49 индия по 54 ксенона.
Пятьдесят пятый и пятьдесят шестой 6s электроны у цезия и бария вызывают образование шестого энергетического слоя. Эти электроны занимают симметричное полярное равноудалённое положение на оси вращения над плоскостью ксенонового остова.
Но при дальнейшем строительстве шестого слоя электронный цуг становится неустойчивым, и электроны шестого слоя цуга постоянно сваливаются в щель между пятыми электронами цугов.
Эти электроны, постоянно сваливающиеся в щель между цугами на более низкий пятый энергетический уровень, называются 5d электронами. У 5d электронов нет своей статической оси симметрии, они вынуждены постоянно вращаются вокруг 5р электронов.
Но щель между 5р электронами настолько широка, что эти 5d электроны сваливаются на ещё более низкую 4f орбиту. У 4f электронов нет своей статической оси симметрии, они вынуждены постоянно вращаются вокруг 4р электронов за уже заполненной электронами 4d орбитой.
Для динамической балансировки четвёртой электронной оболочки вокруг каждого 4р электрона вращается по два 4f электрона всего двенадцать электронов. Последние два 4f электрона у атома радона «поднимаются» на более высокую 5d орбиту, где занимают места, предназначенные для 6s электронов.
Восемьдесят седьмой и восемьдесят восьмой 7s электроны у франция и радия вызывают образование седьмого энергетического слоя. Эти электроны занимают симметричное полярное равноудалённое положение на оси вращения над плоскостью радонового остова.
При этом оставшиеся без места 6s электроны вынуждены искать свою ось симметрии в плоскости вращения атома радона выше двух соседних 4f орбит электронов. Вероятнее всего эта ось симметрии также динамическая и орбиты бывших 6s электронов пролегают по 5g орбите
Но при дальнейшем строительстве седьмого слоя электронный цуг становится неустойчивым, и электроны седьмого слоя цуга постоянно сваливаются в щель между шестыми электронами цугов.
Эти электроны, постоянно сваливающиеся в щель между цугами на более низкий шестой энергетический уровень, называются 6d электронами. У 6d электронов нет своей статической оси симметрии, они вынуждены постоянно вращаются вокруг 6р электронов.
Но щель между 6р электронами настолько широка, что эти 6d электроны сваливаются на ещё более низкую 5f орбиту. У 5f электронов нет своей статической оси симметрии, они вынуждены постоянно вращаются вокруг 5р электронов за уже заполненной электронами 5d орбитой.
Для динамической балансировки пятой электронной оболочки вокруг каждого 5р электрона вращается по два 5f электрона всего двенадцать электронов. Последние два 5f электрона у атома 118 унуноктиума «поднимаются» на более высокую 6d орбиту, где занимают места, предназначенные для 7s электронов.
Два последних 8s электрона 119 унунениума и 120 иунунбилия завершают строительство симметричной электронной оболочки химических элементов. Эти электроны занимают симметричное полярное равноудалённое положение на оси вращения над плоскостью 118 унуноктиума остова.
При этом оставшиеся без места бывшие 7s электроны вынуждены искать свою ось симметрии в плоскости вращения атома 118 унуноктиума выше двух соседних 5f орбит электронов. Одновременно к ним присоединяются бывшие 6s электроны, вытесненные с более низкого энергетического уровня орбитами 5f электронов. Так бывшие 7s и бывшие 6s электроны образуют две новые оси симметрии, лежащие в плоскости вращения атома 118 унуноктиума. Вероятнее всего эти оси симметрии также динамические и орбиты бывших 7s и бывших 6s электронов пролегают по 5g орбите
В инертном не возбуждённом состоянии 8s электроны могут присоединяться к бывшим 7s электронам, занимая третью ось симметрии в плоскости вращения атома 118 унуноктиума между двух соседних 5f орбит электронов. При этом образуется абсолютно симметричная электронная оболочка последнего химического элемента унунбилия.
С ростом количества электронов симметрия электронных оболочек атомов всё более усложняется:
от линейной симметрии к плоскостной геометрической симметричной,
от симметрии плоскостной к сферически симметричной форме,
от простой сферической симметрии к сферически слоевой симметрии,
от статической слоевой симметрии к динамической слоевой симметрии.
Протоны атомного ядра в основном (не в возбуждённом) состоянии, стремятся к зарядовой симметрии. В отличие от электронных оболочек атомов строение ядер атомов происходит по другому принципу.
Изначально строение ядер атомов происходит, так же как и электронных оболочек. На одной оси X в ядре можно разместить не более двух 1s протонов противоположной магнитной полярности, изолированных одним или двумя нейтронами.
Появление третьего и четвёртого 2s протонов противоположной магнитной полярности требуют появления в ядре второй Y оси симметрии.
Пятые и шестые 2p протоны противоположной магнитной полярности требуют появления в ядре третьей Z оси симметрии. При шести протонах возможны два варианта симметричного размещения электронов на плоскости и на сфере.
На плоскости, как на вогнутой полусфере симметрично можно разместить не более 6 протонов противоположной магнитной полярности изолированных двумя нейтронами на каждой оси. Так образуется первый углеродный плоский протонный слой.
Седьмые и восьмые 2р протоны противоположной магнитной полярности требуют появления в ядре четвёртой О оси симметрии. При восьми протонах, как у кислорода, их можно симметрично разместить на одном расстоянии от центра симметрии только на сферической поверхности.
Но природа наложила запрет на слоевую сферическую симметрию ядер атомов. На одной оси симметрии в ядре атома не может наводиться более двух протонов. Причём протоны на одной оси симметрии обязательно должны быть разъединены одним или двумя нейтронами. Только такие ядра атомов устойчивы.
Дальнейшее построение ядер атомов идёт по другому принципу. Начиная с девятого 2р протона, начинается строительство нового второго плоского протонного слоя ядра атома. В отличие от электронной оболочки этот второй слой симметрии не сферический, а плоский как первый протонный слой.
С дальнейшим прибавлением протонов с 11 по 18 протон полностью заполняются второй и третий углеродный плоский протонный слой или энергетический уровень ядра атома. Строительство второго и третьего углеродного протонного слоя происходят «выше» и «ниже» первого плоского протонного углеродного слоя.
С дальнейшим прибавлением протонов с 19 по 36 протон заполняются четыре четвёртый, пятый, шестой и седьмой плоский протонный углеродный слой или энергетический уровень ядра атома. Строительство этих протонных углеродных слоёв происходят поочередно «выше» и «ниже» второго и третьего плоского протонного слоя.
Шестой и седьмой протонный слой разряжен в нём только по три 4р протона одной полярности, а не по шесть как в пяти предыдущих протонных углеродных слоях.
С дальнейшим прибавлением протонов с 37 по 54 протон заполняются четыре восьмой, девятый, десятый и одиннадцатый плоский протонный углеродный слой или энергетический уровень ядра атома. Строительство этих протонных слоёв происходит поочерёдно «выше» и «ниже» шестого и седьмого плоского протонного углеродного слоя.
Десятый и одиннадцатый протонный слой разряжен в нём только по три 5р протона одной полярности, а не по шесть как в пяти предыдущих протонных слоях.
С дальнейшим прибавлением протонов с 55 по 86 протон заполняются двенадцатый, тринадцатый, четырнадцатый, пятнадцатый, шестнадцатый семнадцатый восемнадцатый и девятнадцатый плоский протонный слой или энергетический уровень ядра атома. Строительство этих протонных слоёв происходят поочерёдно «выше» и «ниже» десятого и одиннадцатого плоского протонного слоя.
Шестнадцатый и семнадцатый протонный слой разряжен в нём только по три 6р протона одной полярности, а не по шесть как в предыдущих протонных слоях.
Восемнадцатый и девятнадцатый протонный слой разряжен в нём только по одному 6s протону одной полярности, а не по шесть как в полноценных протонных слоях
С дальнейшим прибавлением протонов с 87 по 118 протон заполняются двадцатый, двадцать первый, двадцать второй, двадцать третий, двадцать четвёртый, двадцать пятый, двадцать шестой и двадцать седьмой плоский протонный слой или энергетический уровень ядра атома. Строительство этих протонных слоёв происходят поочерёдно «выше» и «ниже» предыдущих плоского протонных слоёв.
Двадцать четвёртый и двадцать пятый плоский протонный слой разряжен в нём только по три 7р протона одной полярности, а не по шесть как в предыдущих протонных слоях.
Двадцать шестой и двадцать седьмой протонный слой разряжен в нём только по одному 7s протону одной полярности, а не по шесть как в полноценных протонных слоях.
Заключительные двадцать восьмой и двадцать девятый торцевые протонные слои содержат только по одному 8s протону.
При таком плоском слоевом или столбчатом расположении протонов ядер атомов обеспечивается прямая электромагнитная связь с электронами атома на сферических слоях различных энергетических оболочек.
Поэтому ядра атомов имеют столбчатое строение. Столбчатое строение ядер атомов ограничивает ориентацию оси вращения протонов ядра оказавшихся во внутреннем протонном слое. Протоны внутреннего слоя и связанные с ними электромагнитными силами электроны имеют «экваториальную» ориентацию оси вращения. Эти «экваториальные» электроны не могут участвовать в химических связях.
Только более «подвижные» торцевые протоны, которые могут менять ориентацию оси вращения с «экваториальной» на «полярную» могут участвовать в валентных химических связях через свои электроны. Электроны участвующие, в химических связях возбудившись, разворачиваются из инертного «экваториального» положения в «полярное», для S электронов, или «приполярное» положение, для р- d- f-электронов.
|
4. Строение ядер инертных химических элементов по Никитину А.Н. |
|
|
2гелий |
|
|
|
|
|
6 углерод-графит |
|
|
|
|
|
10неон |
|
|
|
|
|
18аргон |
|
|
|
|
|
36криптон |
|
|
|
|
|
54ксенон |
|
|
|
|
|
86радон |
|
|
|
|
|
118унуноктиум |
|
|
|
|
|
5. Порядок заполнения -s -p -d -f протонами протонных оболочек 8 инертных ядер химических элементов. |
||||||||||||||||||||||||||
|
2 гелий |
||||||||||||||||||||||||||
|
|
1s |
1s |
|
|||||||||||||||||||||||
|
6 углерод-графит |
||||||||||||||||||||||||||
|
|
1s |
|
||||||||||||||||||||||||
|
2s |
||||||||||||||||||||||||||
|
2p |
||||||||||||||||||||||||||
|
1s |
||||||||||||||||||||||||||
|
2s |
||||||||||||||||||||||||||
|
2p |
||||||||||||||||||||||||||
|
10неон |
||||||||||||||||||||||||||
|
|
3p |
1s |
|
|||||||||||||||||||||||
|
2p |
2s |
|||||||||||||||||||||||||
|
1p |
|
|||||||||||||||||||||||||
|
3p |
1s |
|||||||||||||||||||||||||
|
2p |
2s |
|||||||||||||||||||||||||
|
1p |
|
|||||||||||||||||||||||||
|
18аргон |
||||||||||||||||||||||||||
|
|
2p |
3s |
3p |
|
||||||||||||||||||||||
|
3p |
2s |
2p |
||||||||||||||||||||||||
|
2p |
1s |
3p |
||||||||||||||||||||||||
|
3p |
3s |
2p |
||||||||||||||||||||||||
|
2p |
2s |
3p |
||||||||||||||||||||||||
|
3p |
1s |
2p |
||||||||||||||||||||||||
|
36криптон |
||||||||||||||||||||||||||
|
|
n |
3d |
2p |
3s |
3p |
3d |
4p |
|
||||||||||||||||||
|
4p |
3d |
3p |
2s |
2p |
3d |
n |
||||||||||||||||||||
|
n |
4s |
2p |
1s |
3p |
3d |
4p |
||||||||||||||||||||
|
4p |
3d |
3p |
3s |
2p |
3d |
n |
||||||||||||||||||||
|
n |
3d |
2p |
2s |
3p |
3d |
4p |
||||||||||||||||||||
|
4p |
3d |
3p |
1s |
2p |
4s |
n |
||||||||||||||||||||
|
54ксенон |
||||||||||||||||||||||||||
|
|
n |
4d |
n |
3d |
2p |
3s |
3p |
3d |
4p |
4d |
5p |
|
||||||||||||||
|
5p |
4d |
4p |
3d |
3p |
2s |
2p |
3d |
n |
4d |
n |
||||||||||||||||
|
|
5s |
n |
4s |
2p |
1s |
3p |
3d |
4p |
4d |
5p |
||||||||||||||||
|
5p |
4d |
4p |
3d |
3p |
3s |
2p |
3d |
n |
4d |
n |
||||||||||||||||
|
|
4d |
n |
3d |
2p |
2s |
3p |
3d |
4p |
4d |
5p |
||||||||||||||||
|
5p |
4d |
4p |
3d |
3p |
1s |
2p |
4s |
n |
5s |
|
||||||||||||||||
|
86радон |
||||||||||||||||||||||||||
|
|
6s |
|
5d |
4f |
n |
4d |
n |
3d |
2p |
3s |
3p |
3d |
4p |
4d |
5p |
4f |
5d |
6p |
6s |
|
||||||
|
6p |
5d |
4f |
5p |
4d |
4p |
3d |
3p |
2s |
2p |
3d |
n |
4d |
n |
4f |
5d |
|
||||||||||
|
|
5d |
4f |
n |
5s |
n |
4s |
2p |
1s |
3p |
3d |
4p |
4d |
5p |
4f |
4f |
6p |
||||||||||
|
6p |
5d |
4f |
5p |
4d |
4p |
3d |
3p |
3s |
2p |
3d |
n |
4d |
n |
4f |
5d |
|
||||||||||
|
|
5d |
4f |
n |
4d |
n |
3d |
2p |
2s |
3p |
3d |
4p |
4d |
5p |
4f |
5d |
6p |
||||||||||
|
6p |
4f |
4f |
5p |
4d |
4p |
3d |
3p |
1s |
2p |
4s |
n |
5s |
n |
4f |
5d |
|
||||||||||
|
118унуноктиум |
||||||||||||||||||||||||||
|
7s |
|
6d |
5f |
n |
n |
5d |
4f |
n |
4d |
n |
3d |
2p |
3s |
3p |
3d |
4p |
4d |
5p |
4f |
5d |
6p |
n |
5f |
6d |
7p |
7s |
|
7p |
6d |
5f |
n |
6p |
5d |
4f |
5p |
4d |
4p |
3d |
3p |
2s |
2p |
3d |
n |
4d |
n |
4f |
5d |
n |
n |
5f |
6d |
|
||
|
|
6d |
5f |
6s |
n |
5d |
4f |
n |
5s |
n |
4s |
2p |
1s |
3p |
3d |
4p |
4d |
5p |
4f |
4f |
6p |
n |
5f |
5f |
7p |
||
|
7p |
6d |
5f |
n |
6p |
5d |
4f |
5p |
4d |
4p |
3d |
3p |
3s |
2p |
3d |
n |
4d |
n |
4f |
5d |
n |
n |
5f |
6d |
|
||
|
|
6d |
5f |
n |
n |
5d |
4f |
n |
4d |
n |
3d |
2p |
2s |
3p |
3d |
4p |
4d |
5p |
4f |
5d |
6p |
n |
5f |
6d |
7p |
||
|
7p |
5f |
5f |
n |
6p |
4f |
4f |
5p |
4d |
4p |
3d |
3p |
1s |
2p |
4s |
n |
5s |
n |
4f |
5d |
n |
6s |
5f |
6d |
|
||
|
Номер углеродного слоя-оболочки |
||||||||||||||||||||||||||
|
27 |
25 |
23 |
21 |
19 |
17 |
15 |
13 |
11 |
9 |
7 |
5 |
3 |
1 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
22 |
24 |
26 |
Протоны атомного ядра в основном не в возбуждённом состоянии, стремятся к зарядовой симметрии. Проследим, как изменяется строение ядер химических элементов с ростом количества протонов в ядре атомов. Все результаты занесём в таблицу «Периодическая система протонной структуры ядер химических элементов». Обозначим в таблице «Периодическая система протонной структуры ядер химических элементов» протон кружком, цвет которого соответствует спину, причём спин + (плюс) вверх ↑ обозначим красным цветом, а спин – (минус) вниз ↓ обозначим, синим цветом. В пояснительных рисунках протон обозначим шариком красно-синего цвета. Цвет обозначает магнитную полярность юг + (плюс) красный север – (минус) синий. А нейтрон зелёным цветом, магнитную полярность для упрощения на нём указывать не будем. Магнитная полярность нейтрона в ядре атома противоположна протонной полярности. Этим обеспечивается их магнитное сцепление между собой.
Из всех изотопов химического элемента для поясняющей картинки будем брать самый распространённый изотоп. А в таблицу «Периодическая система протонной структуры ядер химических элементов» заносить схематическое изображение развёртки протонной структуры ядра, самого распространённого изотопа химического элемента. Нейтроны для упрощения таблицы будем опускать.
Параллельно будем моделировать сферические пространственные взаимосвязи электронов и протонов ядра атоме. Раскроем причинно следственные связи, как изменения в ядре атома отражаются на строении его сферической электронной оболочки.
Проследим, как стремление к сферической зарядовой симметрии электронной оболочки влияет на предпочтительную валентность в многоэлектронных оболочках атомов.
Покажем причину ограничения предельной валентности в атомах цифрой 8.
|
6. Периодическая система протонной структуры ядер химических элементов. |
|
|
|
|
Легенда к периодической системы протонной структуры ядер химических элементов.
Эволюция протонной структуры ядер сведена в таблицу, выполненную по типу таблицы периодической системы химических элементов Менделеева. Форма таблицы, обозначение периодов, рядов, групп и подгрупп изменены по предложению автора.
Для наглядности протоны обозначены кружком, цвет кружка обозначает спин протона: красный (+) плюс, синий (-) минус. Разным цветом выделены s-, p-, d-, f- элементы.
Стрелками обозначены валентные протоны, цвет стрелки соответствует спину валентного протона: красный (+) плюс, синий (-) минус
Нейтроны обозначены кружком зелёного и белого цвета. Зелёный кружок обозначает нейтрон наружного слоя. Белый кружок обозначает, либо вакансию нейтрона в наружном слое, либо торцевое положение нейтрона внутреннего слоя.
Из таблицы видно, что строение ядер химических элементов с ростом количества протонов претерпевает несколько качественных изменений.
При структуре, основным элементом которой является циклическое образование типа "углеродного кольца", подавляющее большинство ядер имеют либо эллипсоидную форму, при количестве протонов до 17, либо цилиндрическую (столбчатую) форму при количестве протонов от 18 до 120.
7. Строение электронной
оболочки атома водорода.
Электрон в атоме водорода может занимать множество энергетических уровней и положений. Опираясь на анализ интенсивности спектральных линий излучения атома водорода, с учётом спина электрона, можно построить график визуализации орбит занимаемых электроном в атоме водорода.
|
|
|
График изменения суммарного спина электрона в зависимости от радиуса прецессионной орбиты (s, p, d, f, g, h, I, k, l, m и т. д.) электронного вихря пяти энергетических уровней занимаемых электроном в атоме водорода где: S- расстояние (высота) от ядра протона Р+ до центра массы электрона е- H- отклонение (вылет) центра массы электрона е- от оси вращения ядра протона Р+ J - спин или момент количества вращательного движения электрона. |
Видно, что рисунок орбит электрона в атоме водорода, в возбуждённом состоянии, получается не симметричным. Орбит с положительным спином (+), в электронной оболочке, у одинаковых энергетических уровней, больше чем с отрицательным спином (–).
Это подтверждается интенсивностью спектральных линий. Спектральные линий с положительным спином (J = +1/2) в три раза более интенсивны, чем спектральные линии с отрицательным спином (J = –1/2). Это значит, что электрон в атоме водорода в основном не возбуждённом состоянии находится в три раза чаще. у северного полюса протона (спин электрона J = +1/2) чем у южного полюса. (спин электрона J = –1/2). Пояснительный рисунок. из «Википедии» «Спин электрона в атоме водорода» см ниже.
|
|
|
|
Рис. спин электрона J = +1/2 |
Рис. спин электрона J = -1/2 |
Почему электрон в атоме водорода предпочитает северный магнитный полюс?
Подробно этот вопрос рассмотрен во второй части в главе «13. Аура элементарных частиц».
Тор электрона имеет два вида вращения осевое вращение и торовое вращение. Эти два вида вращения увлекают за собой окружающие частицы эфира. Вращающиеся частицы эфира выстраиваются в замкнутые силовые магнитные кольца и образуют электромагнитную ауру электрона. Такая же силовая электромагнитная аура возникает и у тора протона. В эти силовые магнитные кольца ауры электрона упираются силовые магнитные кольца ауры протона. Происходит чисто механическое трение электромагнитной ауры электрона и электромагнитной ауры протона об окружающий эфир см рис. ниже
Посмотрим на картинку ниже, на ней условно обозначены направления вращений электромагнитной ауры тора электрона и электромагнитной ауры тора протона. Как видим эти вращения электромагнитных аур электрона и протона встречные, что нами воспринимается как их магнитное взаимное отталкивание.
Если электронный тор будет захвачен южным магнитным полюсом протона (спин электрона J = -1/2), то нами это будет восприниматься как их взаимное магнитное притяжение. Тор электрона начнёт притягиваться протоном и проскочив «мёртвую сатурнианскую точку» тор электрона вернётся в устойчивое положение на северном магнитном полюсе протона.
|
|
|
|
Рис. Выталкивающий контакт электрона и протона, спин электрона J = +1/2 |
Рис. Затягивающий контакт электрона и протона, спин электрона J = -1/2. |
Направления вращений электромагнитной ауры (большие зелёные кольца рассечённого тора) тора электрона (синее кольцо) и электромагнитной ауры (малые зелёные кольца рассечённого тора) тора протона (красное кольцо). Наружное зелёное кольцо это сфера непроницаемости атома водорода.
Выталкивающий контакт выталкивает окружающий эфир, из зазора, между электронным тором ауры и протонным тором ауры. Такой контакт надёжен он понижает плотность эфира в зоне контакта. Окружающий более плотный эфир приталкивает электрон к протону. Поэтому, при захвате протоном электрона захват происходит, в основном, северными магнитными полюсами электрона и протона по выталкивающему контакту.
При контакте протона и электрона южными магнитными полюсами электрона и протона образуется затягивающий контакт, затягивает окружающий эфир в зазор между электронным тором ауры и протонным тором ауры. Такой затягивающий контакт менее надёжен он повышает плотность эфира в зоне контакта. Окружающий менее плотный эфир приталкивает электрон к протону с меньшей силой. Поэтому, при контакте протона и электрона южными магнитными полюсами электрона и протона по выталкивающему контакту электрон находится в неустойчивом состоянии. Такой контакт, статистически происходит в три раза реже.
Из за этого предпочтительного положения электрона происходит статистический перекос возможных орбит в электронной оболочке атома водорода. Так называемые «крайние орбиты» электрона, с положительным спином J = +, такие как 2р+, 3d+, 4f+, 5g+, 6h+, 7i+, 8k+, 9l+, 10m+, 11n+ и т.д., могут занимать «сатурнианские орбиты» в экваториальной плоскости вращения протона. Такой возможностью орбиты электрона с отрицательным спином J = -, не обладают. Так возникает статистическая асимметрия преобладание орбит с положительным спином электрона в атоме водорода.
|
|
|
Рис. Визуализация орбит шести энергетических уровней в атоме водорода, построенных по данным спектрометрии. Заметно преобладание орбит с положительным спином электрона в атоме водорода. |
В основном 1s энергетическом состоянии с положительным спином J = ½+ электронный вихрь может находиться сколь угодно долго (при нормальных условиях). Во всех остальных энергетических положениях (при нормальной температуре) электрон находится ограниченное время.
Почему электрон в возбуждённом состоянии занимает только определённые орбиты?
Надо помнить, что квантовая физика это статистическая физика, все квантовые числа в ней среднестатистические!
На рисунке орбит, приведённом выше, можно заметить, что квантовые орбиты отделены друг от друга пустым пространством. На самом деле электрон может занимать любые удобные в данный момент орбиты. Но, статистически, большую часть времени электрон проводит на этих строго проквантованных орбитах.
Собственная частота вращения электрона на первой Боровской орбите
ν = 6 576 176 300 000 000 Гц! Это чудовищная частота вращения! Такую частоту невозможно замерить, нет таких приборов. Это математически вычисленная частота по данным спектрометрии.
Так как измерить и сфотографировать реальный электрон в атоме водорода невозможно, из за чудовищной частоты вращения электрона, пользуются эмпирическими (подгоночными) формулами. Эти формулы подобраны методом «научного тыка» по данным спектрометрии.
Шрёдингер придумал, как описать электрон с помощью волновой функции, но электрон не может быть одновременно и волной и частицей, иначе он выглядел бы, как смесь слона (животное) с мотоциклом (механизм).
Шрёдингер практически говорит: "Вы всё неправильно поняли Волновая функция это удобный способ описания, но не более того".
Вот какое распределение вероятности обнаружения электрона в атоме водорода в состояниях 1s и 2s и 2р электрона дают теоретические вычисления по формулам Шрёдингера см рис. ниже.
|
|
|
|
|
Теоретическое распределение вероятности обнаружения электрона в атоме водорода в состояниях 1s. |
Теоретическое распределение вероятности обнаружения электрона в атоме водорода в состояниях 2р. |
Теоретическое распределение вероятности обнаружения электрона в атоме водорода в состояниях 1s и 2s. Где 1r = 5,29·10–11 м – радиус первой Боровской орбиты. |
Как образуются эти квантовые орбиты у электрона?
Электрон подобен волчку гироскопа.
Если на ось гироскопа начинает действовать сила или пара сил, стремящихся привести ось в движение (т. е. создающие вращающий момент относительно центра подвеса). То под действием этой силы конец оси гироскопа будет отклонять не в сторону действия силы, как это было бы при не вращающемся гироскопе, а в направлении перпендикулярном к этой силе; в результате электронный вихрь начнёт вращаться вокруг оси, притом не ускоренно, а с постоянной угловой скоростью.
Это вращение называется прецессией; оно происходит тем медленнее, чем быстрее вращается вокруг своей оси сам электрон. Если в какой-то момент времени действие силы прекратится, то одновременно прекратится прецессия и ось мгновенно остановится, т. е. прецессионное движение гироскопа безинерционно.
Ось прецессионного вращения электронного вихря параллельна оси вращения протона. При кратковременных воздействиях даже очень больших сил движение гироскопа изменяется незначительно. Гироскоп как бы сопротивляется попыткам изменить его момент импульса и кажется "затвердевшим".
Каждому углу наклона оси гироскопа (электрона) соответствует своё расстояние до протона и своя частота вращения.
Каждая прецессионная орбита электронного вихря характеризуется спином или моментом количества движения L.
Lе = rе mе vе
где rе - радиус электронного вихря
mе - масса покоя электрона
vе – скорость вращения массы электрона
Причем стационарными являются лишь те орбиты, при движении по которым момент количества движения Le электрона равен целому числу постоянной Планка.
Le = rе mе vе = nh
Один 1s уровень отличается от (2s, 3s, 4s, 5s …) уровня только «высотой орбиты», т. е. расстоянием до протона см. рисунок и таблицу «Строение электронной оболочки атома водорода».
Расстояния от s оси до осей вращения электрона p, d, f, g, h, I, k, l, m, n, o, k, r, t, u, v, w, x, y, z и т. д. орбитах строго квантуются. Они отличаются друг от друга проекцией момента количества движения на выделенную ось. Расстояние между осями вращения прецессионных орбит равно диаметру ns электронного вихря на данном энергетическом уровне, см. таблицу «Строение электронной оболочки атома водорода».
У электронного вихря собственный момент количества движения равен
Lе = 1/2 rе mе vе
Коэффициент ½ указывает на то, что электрон имеет форму вращающегося тора или кольца. Кольцо или тор электрона при столкновении с препятствием передаёт препятствию только половину импульса, так как у кольца или тора половина массы движется в одну сторону относительно оси вращения, а другая половина в противоположную.
Собственный момент количества движения электрона - величина постоянная и не меняется с изменением орбиты электрона.
Lе = 1/2 rе mе vе = const
На других (p, d, f, g, h, I, k, l, m, n, o, k, r, t, u, v, w, x, y, z и т. д.) орбитах орбитальный момент количества движения изменяется и вычисляется по стандартной формуле.
Lon = rе n mе vе n
где rе n - радиус центра массы электронного вихря на орбите N
mе - масса покоя электрона = const
vе n – орбитальная скорость вращения центра массы электрона относительно оси s на N орбите.
Пользуясь данными таблицы «Строение электронной оболочки атома водорода» рассчитаем суммарный момент количества движения электронного вихря для каждой орбиты.
Момент количества движения - величина векторная. Вектор перпендикулярен плоскости вращения и перпендикулярен направлению вращения. Условились направление вектора вверх, при вращении против часовой стрелки, считать за + (наблюдатель смотрит с поверхности протона). И наоборот, вектор считают (–), если вращение по часовой стрелке (наблюдатель смотрит с поверхности протона).
Векторы Le и Lon суммируются по правилу сложения векторов.
Le + Lon = L∑n
Результаты вычислений сведём в таблицу «Строение электронной оболочки атома водорода» см. ниже и в график изменения суммарного спина электрона от радиуса прецессионной орбиты (s, p, d, f, g, h, I, k, l, m и т. д.) электронного вихря см. график выше в начале главы.